2022-05-06 分子科学研究所
概要
自然科学研究機構分子科学研究所の古池美彦 助教、向山厚 助教、甲田信一 助教、秋山修志 教授、斉藤真司 教授、欧陽東彦 研究員、総合研究大学院大学後期博士課程のDamien Simonさん、名古屋大学の伊藤(三輪)久美子 特任助教、近藤孝男 特別教授、西脇(大川)妙子 准教授、大阪大学蛋白質研究所の山下栄樹 准教授、立命館大学の寺内一姫 教授らの研究グループは、シアノバクテリアの時計タンパク質(※1)の立体構造と生化学的性質を解明し、概日時計がエネルギーを節約しつつもダイナミックなリズムを生み出す仕組みを明らかにしました。
本成果は、「タンパク質がわずかな反応活性を精密に制御してリズム現象を生み出す仕組み」を解明した学問的意義の高いものです。本成果は、米国科学アカデミーが発行する国際学術誌「Proceedings of the National Academy of Sciences of the United States of America (PNAS)」に、2022年5月5日午前2時(日本時間)に掲載されました。
研究の背景
生命は、地球の自転が生み出す約24時間(概日)周期の環境変化に適応しています。このリズムを支えているのが「概日時計(一般的には体内時計と呼ばれる)」と呼ばれるシステムで、バクテリア・植物・昆虫・哺乳類などの広い生物種に共通して見られる生命現象です。なかでもシアノバクテリアの概日時計は、細胞はもとより試験管内でも研究できる利点があり、生物学のみならず幅広い分野で研究対象となっています。これまでの研究をとおして、シアノバクテリアの概日時計が、わずかなエネルギー消費で24時間周期のダイナミックなリズムを生み出していることが分かっていましたが、その仕組みは明らかになっていませんでした。
シアノバクテリアの概日時計は、3種類の時計タンパク質KaiA、KaiB、KaiCとアデノシン三リン酸(ATP)(※2)を試験管内で混ぜ合わせることで再構成できます(図1)。KaiA、KaiB、KaiCは集合と解離を24時間周期で繰り返すことによって時刻情報を細胞内に伝えます。このときKaiCはATPを加水分解することで、KaiAとKaiBを含めた時計システム全体を駆動します。ATPの加水分解は、主にKaiCの二重リングのうち、上部のC1リングで進行します。しかし、その反応速度は一定ではなく、24時間周期で加速と減速を繰り返します。KaiC内で起こる加水分解速度の変化が起点となって、時刻情報がKaiAやKaiBへ、最終的には細胞全体に伝わると考えられてきましたが、その仕組みは明らかにされていませんでした。
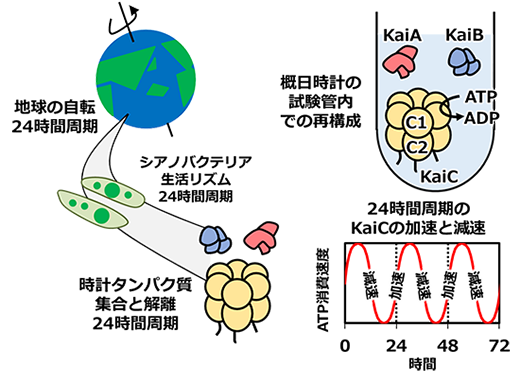
図1:KaiCのATP消費速度の加速・減速によって駆動される概日時計システム
研究の成果
研究グループは、ATP加水分解が速い状態・遅い状態のKaiC(図2左上)の立体構造を明らかにするため、X線結晶構造解析(※3)を進めました。KaiCの結晶を、兵庫県播磨の大型放射光施設SPring-8(BL44XU)に持ち込み分析することで、原子レベルのKaiCの構造を明らかにしました。ATP加水分解は、ATPの末端のリン原子に対して水分子が近づいて反応することで進行します。C1リングのATP結合部位に着目し、ATPに最も近い水分子のシグナルを観察しました(図2右上)。反応が加速された状態(朝)では、水分子はATPに対してより近く直線的な位置にあり、反応効率が高い配置になっていました。逆に、減速状態(夜)では、水分子がより遠く角度の大きい位置にあって、反応効率が低い配置になっていました。興味深いことに、このATPと水分子の原子レベルの配置調節は、C1リング全体にわたる規模の大きい構造変化と連動していました。
生化学実験を行うことで、このC1リング全体の状態変化が、KaiAやKaiBの結合・解離のタイミングを決め、特別な仕掛けをつかって時計システム全体の時刻を制御していることが分かりました(図2下)。減速状態のKaiCは、KaiBを結合し、さらにKaiAを捕捉することでシステム全体に強力なブレーキをかけていました。しかし、KaiCが反応速度を自発的に上昇させると(助走、夜明け)、わずかな量のKaiBとKaiAが解離し、これによって生じたKaiAがシステム全体に加速効果を与え始めます。研究グループが驚いたのは、解き放たれたKaiAが、まだ助走を始めていない別のKaiCに作用して助走と加速を促し、その結果として開放されたKaiAは再び他の未助走のKaiCに作用して加速させる・・・、という専門的には自己触媒反応(※4)と呼ばれる仕掛けが利用されている点でした。自己触媒反応は、多くの振動現象に共通してみられる過程であり、減速状態のKaiCを短時間のうちに加速状態へと促し、時刻情報を時計システム全体に迅速に伝播させるための重要な仕組みであることが分かりました。
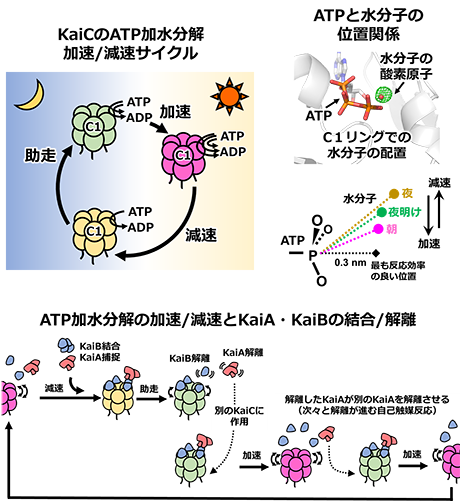
図2:時計システムを駆動するKaiCのATP加水分解反応
KaiCは、減速と加速を繰り返しつつ、平均すると一日に約14個のATPを消費します(減速状態では約6個/日、加速状態は約24個/日)。加速・減速時のエネルギー消費速度は、筋肉の収縮運動に関わるタンパク質の1/1000~1/10000程度であり、極めて省エネルギーなシステムであると言えます。概日リズムをわずかなエネルギー消費で細胞全体に行きわたらせることができるのは、本研究で明らかになったように、原子から分子全体、そして複数の分子にまたがる自己触媒的な現象が、綿密に連動する仕組みになっているからなのです。
今後の展開・この研究の社会的意義
タンパク質は、自律的に自身の反応速度を制御しながら、秩序ある生命現象を生み出しており、そのメカニズムに対する理解はあまり進んでいません。KaiCの原子レベルでの制御(0.1ナノメートル規模)が、分子全体の制御(1-10ナノメートル規模)と連動し、分子間の制御(10-100ナノメートル規模)を実現するメカニズムを明らかにした本研究の手法や戦略は、様々な生命システムの研究において応用することが可能です。
用語解説
(※1)時計タンパク質
概日時計の機能を維持するために必須となるタンパク質の総称。時計タンパク質を変異させたり欠損させたりすると、生物の行動のリズム特性に様々な影響が現れる。
(※2)ATP
アデノシン三リン酸(Adenosine Triphosphate)の略称。筋肉収縮など細胞における様々な運動のエネルギー源として利用される物質のことを指す。生物のエネルギーの利用・貯蓄に用いられ、その重要性から「生体におけるエネルギーの通貨」とも呼ばれる。アデノシンという物質に3つのリン酸基が結合した形をしている。ATP加水分解は、水分子との反応によってリン酸基が外されて分解される反応で、アデノシン二リン酸(ADP)が生成される。
(※3)X線結晶構造解析
分子の立体構造を明らかにするために用いられる解析手法のひとつ。原子や分子が3次元に配列した結晶にX線を照射し、回折されたX線の方向・強さを解析することで、電子の分布すなわち原子の配置についての情報を得ることができる。
(※4)自己触媒反応
化学反応で生じた生成物が、反応前の物質に作用して、その反応を促進する触媒の役割を果たすこと。初期の反応速度上昇は軽微だが、反応の進行とともに反応速度が加速して極大に達する。ベロウソフ・ジャボチンスキー(BZ)反応をはじめとする振動現象に見いだされる化学反応であり、概日時計システムにおいても各所で利用されている可能性がある。
論文情報
掲載誌:Proceedings of the National Academy of Sciences of the United States of America (PNAS)
論文タイトル:“Regulation Mechanisms of the Dual ATPase in KaiC”(「KaiCの2つのATP加水分解酵素反応の制御メカニズム」)
著者:Yoshihiko Furuike, Atsushi Mukaiyama, Shinichi Koda, Damien Simon, Dongyan Ouyang, Kumiko Ito-Miwa, Shinji Saito, Eiki Yamashita, Taeko Nishiwaki-Ohkawa, Kazuki Terauchi, Takao Kondo, Shuji Akiyama
掲載日:2022年5月5日午前2時(日本時間)(オンライン公開)
研究グループ
分子科学研究所
名古屋大学
大阪大学 蛋白質研究所
立命館大学
研究サポート
本研究は、科学研究費補助金No. 17H06165, No. 18K06171, No. 19K16061等の助成を受けて実施されました。
研究に関するお問い合わせ先
秋山修志(あきやましゅうじ)
分子科学研究所 教授
古池美彦(ふるいけよしひこ)
分子科学研究所 助教
報道担当
自然科学研究機構 分子科学研究所 研究力強化戦略室 広報担当
東海国立大学機構 名古屋大学広報室
大阪大学蛋白質研究所 広報室
立命館大学 広報課