2022-05-10 東京大学,日本医療研究開発機構
発表のポイント
- 乾癬(注1)炎症時の皮膚で、N-アシルエタノールアミン(NAE)(注2)という抗炎症作用を持つ脂質メディエーター(生理活性脂質)が増加することを見出しました。
- 乾癬の進行に伴い、cPLA2ε(注3)という「リン脂質を代謝する酵素」が皮膚の角化細胞に発現誘導され、NAE産生の調節に関わることを初めて明らかにしました。
- NAEの乾癬抑制効果は、新たな創薬標的となることが期待できます。
発表概要
東京大学大学院医学系研究科の村上誠教授らの研究グループは、東京都医学総合研究所の平林哲也研究員らとの共同研究により、マウス乾癬モデルの皮膚において、抗炎症作用を持つ脂質メディエーター(注4)であるN-アシルエタノールアミン(NAE)の産生が増加すること、リン脂質代謝酵素の一つである細胞質型ホスホリパーゼA2ε (cPLA2ε )が発現誘導されNAEの産生調節に関わること、NAEにはヒト皮膚角化細胞において炎症物質であるS100A9(注5)の発現を抑制し乾癬炎症を緩和させる作用があることを発見しました。本研究結果は、これまで不明だった生体内でのNAEの産生経路とその乾癬病態における役割を初めて示したものです。皮膚におけるcPLA2εの発現誘導はマウス乾癬モデルだけでなくヒト乾癬患者でも認められることから、cPLA2εやNAEを標的とした創薬は、乾癬の新たな治療に役立つ可能性が期待できます。
本研究成果は、2022年4月28日(米国東部標準時)に掲載されました。
発表内容
1)研究の背景
皮膚は全身の体表を覆う臓器であり、外界から生体を保護するバリア機能(皮膚バリア)を担っています。脂質は皮膚バリアに必須の生体成分であり、脂質代謝の異常は皮膚バリアの破綻と皮膚疾患の形成につながることが報告されています。
乾癬は、皮膚の新陳代謝のサイクルが早くなることで皮膚が赤くなって盛り上がり、表面に白色の乾いた角質(角化細胞)が増生を来す慢性の炎症性角化症です。近年、Th17免疫応答を標的とした抗体医薬が乾癬の治療に効果を上げていますが、高価な薬剤を永続的に投与し続けなければならず、根本的な要因の解明や、安価な新薬の開発が求められています。
村上らの研究グループは、長年にわたり脂質の代謝に関わる酵素群の研究を行ってきました。本研究では、マウスにおける乾癬モデルの網羅的な脂質プロファイリング解析から、乾癬病態に相関して産生される脂質の探索を行い、乾癬の進行を抑える新しい脂質代謝経路を同定しました。
2)研究内容
研究グループは今回、マウスの皮膚に乾癬惹起剤であるイミキモドを塗布し、経時的な網羅的脂質解析(リピドミクス解析)(注6)から、抗炎症作用を持つ脂質メディエーターであるNAEの多くの分子種の産生が病態の推移と相関して増加することを見つけました。これまで、試験管内においてNAEの生成に関わる酵素がいくつか報告されていましたが、生体内での機能は不明でした。これらの酵素のうち、cPLA2εの発現のみが乾癬病態の推移と相関していました。またcPLA2εの乾癬皮膚での発現は、ヒトとマウスの双方において表皮角化細胞の上層部に見られました(図1-①)。
cPLA2εは、ホスファチジルコリン(PC)のsn-1位の脂肪酸をホスファチジルエタノールアミン(PE)のアミノ基に転移してN-アシルPE(NAPE; NAEの前駆体)を生成するN-アシルトランスフェラーゼ反応を触媒します(図2)。そこで上記の結果(図1-①)を受けて、研究グループはcPLA2εの遺伝子を人為的に破壊したノックアウトマウスを作製し、乾癬モデルの表現型を解析しました。その結果、ノックアウトマウスでは野生型マウスと比べて、皮膚の肥厚が悪化するとともに、角化細胞の活性化マーカーであるS100a9や、Th17免疫応答に関わるサイトカインであるIl17aの発現が亢進しており、乾癬病態の増悪が認められました。リピドミクス解析の結果、cPLA2εノックアウトマウスの皮膚では正常時から多くのNAE分子種の産生が顕著に低下しており、イミキモド塗布により乾癬を惹起した後もNAEの増加が殆ど認められませんでした(図1-②)。このことから、乾癬病態におけるNAE産生の大部分は、cPLA2εにより制御されていることが分かりました。次に、NAEに乾癬を抑える作用があるか検証したところ、NAEのマウス皮膚への塗布により乾癬に伴う皮膚の肥厚や乾癬マーカー(S100a9, Il17a)の発現が低下し、またヒト培養角化細胞にNAEを添加すると乾癬関連サイトカイン(注7)によるS100A9の発現誘導が抑えられました(図1-③)。
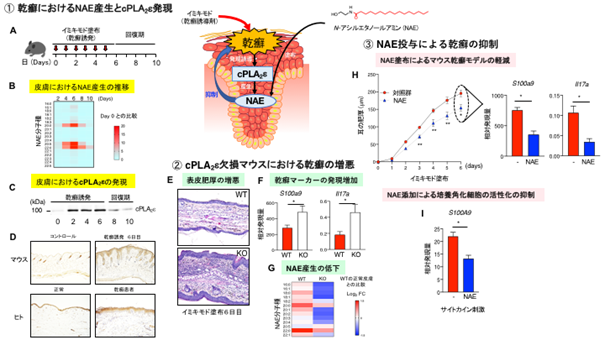
図1 cPLA2εは抗炎症性脂質メディエーターであるNAEの産生を介して乾癬を抑える①マウス皮膚にイミキモドを塗布して乾癬を惹起するとNAEの産生が増加し、イミキモド塗布を止めて回復期に入るとNAEの産生は低下する(A、B)。乾癬の進行に伴いリン脂質代謝酵素であるcPLA2εの発現が皮膚に誘導され、回復期に減少する(C)。マウス及びヒトの乾癬皮膚において、cPLA2εは表皮角化細胞の上層部に発現している(D)。
②cPLA2εノックアウトマウス(KO)では野生型マウス(WT)と比べて、イミキモド塗布による耳介の肥厚が悪化し(E)、乾癬マーカーの発現が増加し(F)、NAEの産生が減少する(G)。
③イミキモド誘導乾癬モデルにおいてNAEをマウス耳に塗布すると、耳介の肥厚と乾癬マーカーの発現が低下し(H)、培養角化細胞にNAEを添加すると、乾癬関連サイトカインの刺激による乾癬マーカーS100A9の発現誘導が抑えられる(I)。
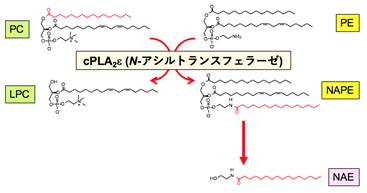
図2 cPLA2εは、ホスファチジルコリン(PC)のsn-1位の脂肪酸をホスファチジルエタノールアミン(PE)のアミノ基に転移してリゾホスファチジルコリン(LPC)とN-アシルPE(NAPE)を生成する(N-アシルトランスフェラーゼ反応)。NAPEがさらに別の酵素(皮膚では未同定)による加水分解を受けるとNAEが生成される。
以上の結果から、乾癬病態で増加するNAEは、cPLA2ε によりその生成が制御され、角化細胞の異常活性化を抑制することにより、抗乾癬作用を示すことが分かりました。
3)本研究の意義・今後の予定
本研究は、生体組織におけるNAE産生にリン脂質代謝酵素cPLA2εが関わること、本経路で産生されるNAEが乾癬の病態にブレーキをかける役割を担うことを初めて明らかにしたものです。NAEは乾癬病態における角化細胞の異常活性化を抑制する効果があることから、cPLA2εやNAEを標的とした創薬は、乾癬の治療に役立つ可能性が期待できます。
4)謝辞
本研究は、日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究開発課題「疾患脂質代謝に基づく生体組織の適応・修復機構の新基軸の創成と医療技術シーズの創出」(研究開発代表者:村上誠、課題番号:20gm1210013)、革新的先端研究開発支援事業ステップタイプFORCE(課題番号20gm4010005)、免疫アレルギー疾患実用化研究事業(課題番号20ek0410052)ならびに日本学術振興会科研費(新学術領域研究、基盤研究、挑戦的萌芽研究;課題番号JP15H05905, JP16H02613, JP18K06624, JP19K08597, JP19K07042, JP20H04939, JP20H05691, JP20H08314)の支援により実施されました。
論文情報
- 論文タイトル
- Group IVE Cytosolic Phospholipase A2 Limits Psoriatic Inflammation by Mobilizing the Anti-inflammatory Lipid N-Acylethanolamine
- 著者
- 梁陸伊韻1、高宮里奈1、三木寿美1、平家圭奈子2、武富芳隆1、杉本奈央1、山口碧3、設樂浩志3、西藤泰昌3、小林哲幸2、平林哲也4、村上誠1* (*責任著者)
-
- 東京大学大学院医学系研究科附属疾患生命工学センター健康環境医工学部門
- お茶の水大学理学部生物学科
- 公益財団法人東京都医学総合研究所基盤技術支援センター
- 公益財団法人東京都医学総合研究所細胞膜研究室
- 雑誌名
- FASEB Journal
- DOI番号
- 10.1096/fj.202101958R
- アブストラクトURL
- https://pubmed.ncbi.nlm.nih.gov/35478358/
用語解説
- (注1)乾癬
- 免疫反応の異常に伴う表皮角化細胞の過剰な増殖が特徴の慢性的な皮膚炎を伴う難病。欧米では一般的な皮膚疾患で(人口の2-11%)、日本においても近年患者数は増加しており、約10~20万人が乾癬に罹患していると推定される。病態形成にはヘルパーT細胞のうちインターロイキン22 (IL-22) やインターロイキン17(IL-17A, IL-17F)を分泌するTh17細胞が関わっており(Th17免疫応答)、これらのサイトカインを標的とした抗体医薬が臨床の現場で用いられているが、発症機構の解明や根本的な治療法の開発には至っていない。尖圭コンジローマ治療薬として用いられるイミキモドのマウス皮膚への反復塗布により、Th17免疫応答が活性化し、皮膚表皮の肥厚を伴う乾癬と類似した病態が発症する。
- (注2)N-アシルエタノールアミン(NAE)
- 脂質メディエーターの一種で、脂肪酸にエタノールアミンが縮合した構造をもつ(図1、2参照)。脂肪酸の種類によって多くの分子種が存在し、このうちアラキドン酸を持つNAEは別名アナンダミドと呼ばれ、大麻(マリファナ)の標的分子であるカンナビノイド受容体の内在性リガンドとして作用する。パルミチン酸やオレイン酸を持つNAEは、脂質を認識する核内受容体PPARα(ペルオキシソーム増殖剤活性化レセプター)のリガンドとして作用し、抗炎症作用、鎮痛作用、代謝改善作用を示す。生体内でのNAE産生経路の全容は分かっておらず、本研究ではその一部を解明した。
- (注3)細胞質型ホスホリパーゼA2ε(cPLA2ε)
- リン脂質のグリセロール骨格のsn-2位のアシル結合を加水分解して脂肪酸とリゾリン脂質を遊離する酵素群はホスホリパーゼA2(PLA2)と総称される。哺乳動物では50種類以上のPLA2分子種が存在し、それぞれが特有の生命応答に関わることが明らかとなってきている。このうち細胞質に局在するPLA2の一群はcPLA2 (cytosolic PLA2)と呼ばれ、哺乳動物にはαからζまでの6種の分子種が存在する。代表格であるcPLA2αはリン脂質からアラキドン酸を遊離し、プロスタグランジンやロイコトリエンの産生に関わる(注4参照)。本研究で取り扱っているcPLA2εはcPLA2ファミリーのひとつであるが、通常のPLA2反応とは異なり、N-アシルトランスフェラーゼ反応(図2参照)を触媒する。
- (注4)脂質メディエーター
- 生理活性脂質とも呼ばれる。脂肪酸の一種であるアラキドン酸から生合成されるプロスタグランジンやロイコトリエンが有名であり、一般に炎症を促進する活性を持つ。一方で、エイコサペンタエン酸やドコサヘキサエン酸などの脂肪酸から産生される脂質メディエーターは抗炎症作用を示す。本研究の対象であるNAEは、脂肪酸に由来する別タイプの脂質メディエーターである。
- (注5)S100A9
- 乾癬炎症時に表皮において発現が著しく増加する生体抗菌ペプチドで、炎症の増悪や感染防御に関わる。乾癬のほかにも、悪性腫瘍や自己免疫疾患などの炎症に伴って発現誘導されることが知られている。本研究では、乾癬における角化細胞の活性化マーカーとして利用している。
- (注6)リピドミクス
- ゲノミクス(遺伝子)、プロテオミクス(タンパク質)、グライコミクス(糖)に対応する、脂質を対象とした網羅的解析を指す。それぞれの脂質分子種の分子量が異なることを利用して、組織や細胞などの検体に存在する多種多様な脂質分子種を質量分析により一斉に同定、定量する。
- (注7)乾癬関連サイトカイン
- 乾癬の病態にはTh17免疫応答に関わるサイトカイン(IL-1β, IL-6, IL-17A, IL-17F, IL-22, TNF-α等)が関与することが知られている。本研究ではこれらのサイトカインのカクテルを実験に使用した。
お問い合わせ先
研究に関すること
東京大学大学院医学系研究科 附属疾患生命工学センター 健康環境医工学部門
教授 村上 誠(むらかみ まこと)
報道に関すること
東京大学 医学部・医学系研究科総務チーム
AMED 事業に関すること
日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課