2022-05-28 東京大学
1.発表者
加藤 一希(東京大学先端科学技術研究センター 特任助教)
岡崎 早恵(東京大学先端科学技術研究センター 学術専門職員)
西増 弘志(東京大学先端科学技術研究センター 教授)
2.発表のポイント
- Cas7-11-ガイドRNA-標的RNA複合体の立体構造を決定し、Cas7-11タンパク質が標的RNAを切断する分子メカニズムを解明した。
- 構造情報にもとづき、標的組織への送達が容易な小型のCas7-11改変体「Cas7-11S」を開発した。
- 「Cas7-11S」は遺伝子治療などへの応用が期待される。
3.発表概要
CRISPR-Cas獲得免疫機構(注1)に関与するCas7-11タンパク質はガイドRNAと複合体を形成し、標的となる1本鎖RNAを切断するはたらきをもつため、Cas7-11は新規のRNA切断ツールとして期待されています。しかし、Cas7-11が標的RNAを切断する分子メカニズムは謎に包まれていました。東京大学先端科学技術研究センターの加藤一希特任助教、西増弘志教授らは、Massachusetts Institute of Technology (MIT)のJonathan S. Gootenbergフェロー、Omar O. Abudayyehフェローとの共同研究として、クライオ電子顕微鏡(注2)を用いて、Cas7-11-ガイドRNA-標的RNA複合体の立体構造を決定し、Cas7-11が標的RNAを切断する分子メカニズムを解明しました。さらに、立体構造をもとに、標的組織への送達が容易な小型のCas7-11改変体(「Cas7-11S」)の開発に成功しました。
本研究成果は、2022年5月27日(米国東部夏時間)に米国科学誌「Cell」のオンライン版に掲載されました。
4.発表内容
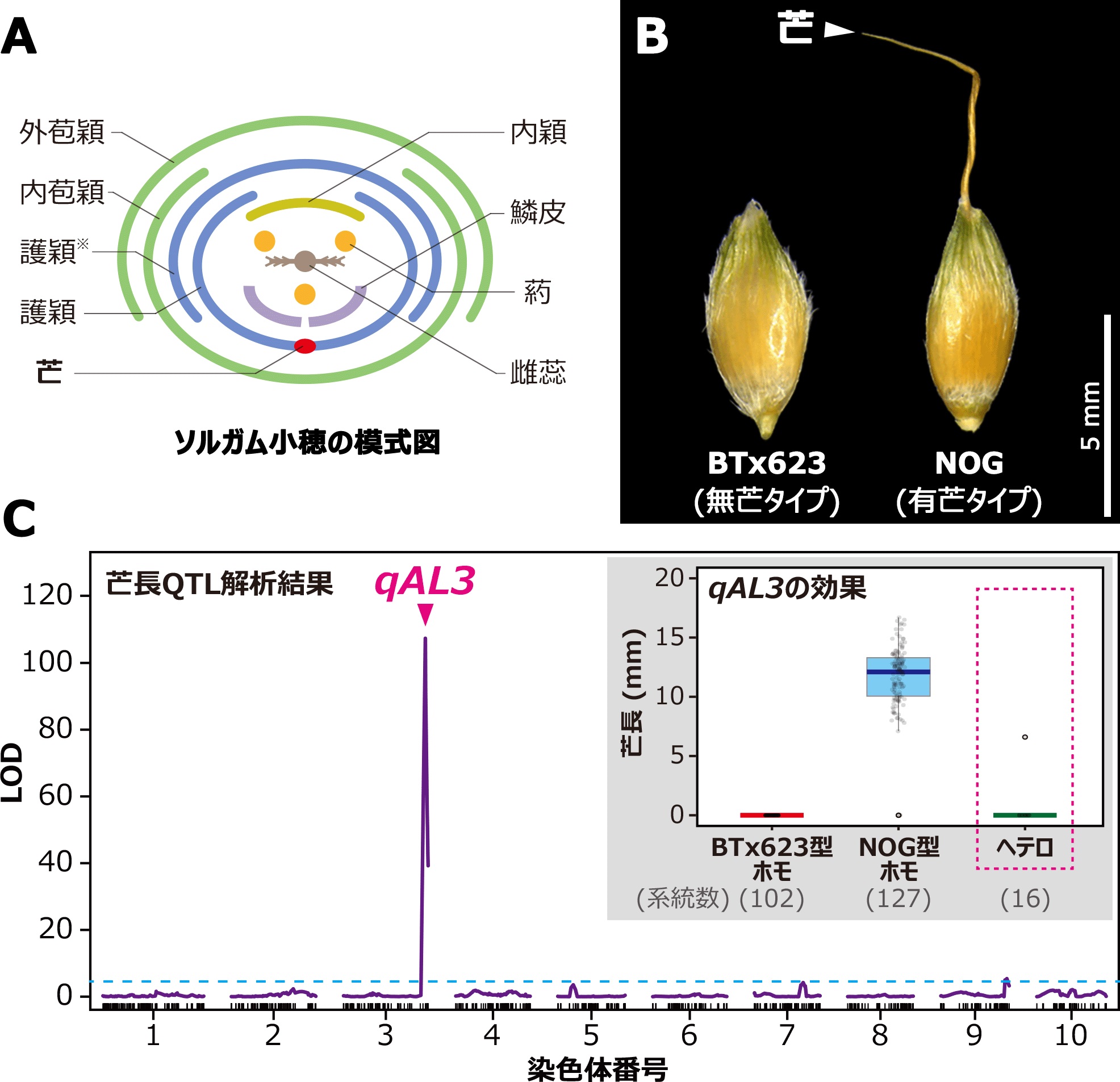
原核生物のCRISPR-Cas獲得免疫機構に関与するCas9タンパク質はガイドRNAと複合体を形成し、ガイドRNAと相補的な2本鎖DNAを切断するはたらきをもつため、ゲノム編集をはじめとする様々な新規技術に応用されています(図1)。Cas9の発見の後もCas12やCas13など新規のCRISPR-Cas酵素が相次いで発見され、核酸検出などの新規技術に応用されてきました。2021年、最新のCRISPR-Cas酵素としてCas7-11が発見されました。Cas7-11は4つのCas7ドメイン(注3)と1つのCas11ドメインをもつタンパク質で、ガイドRNAと複合体を形成し、ガイドRNAと相補的な1本鎖RNAを2か所で切断するはたらきをもちます(図1)。既知のCRISPR-Cas酵素と異なり、Cas7-11は標的RNAを特異的に切断するはたらきをもつため、細胞毒性の低いRNA抑制ツールとしての利用が期待されています。しかし、Cas7-11は新規のタンパク質であり、立体構造も不明であるため、Cas7-11が標的RNAを切断する分子メカニズムは不明でした。
今回、本研究チームは、クライオ電子顕微鏡を用いて、Cas7-11-ガイドRNA-標的RNA複合体の立体構造を決定することに成功しました(図2)。構造解析の結果、Cas7-11は4つのCas7ドメイン(Cas7.1~Cas7.4)とCas11ドメインに加えて、INS(insertion)ドメインとCTE(C-terminal extension)ドメインからなり、それぞれのドメインが4つのリンカー領域(L1~L4)でつながった特徴的な立体構造をもつことが明らかになりました。ガイドRNAの5′領域はCas7.1ドメインとCas7.2ドメインによって認識される一方、ガイド領域は標的RNAと塩基対を形成し、Cas7.2ドメイン、Cas7.3ドメイン、Cas7.4ドメイン、Cas11ドメイン、INSドメインによって認識されていました。興味深いことに、ガイドRNA-標的RNAの4番目、10番目の塩基はそれぞれCas7.2ドメイン、Cas7.3ドメインとの相互作用により、大きく向きを変え、切断されるホスホジエステル結合(注4)の近傍に触媒残基(D429とD654)が位置していることがわかりました。試験管内でのRNA切断実験の結果から、D429とD654はそれぞれ標的RNAの塩基3と塩基4との間、および、塩基9と塩基10との間のホスホジエステル結合の切断に関与することが明らかになりました。また、本研究チームは、立体構造において、INSドメインがRNA切断部位から離れていることに着目し、INSドメインを削除した小型のCas7-11改変体(「Cas7-11S」と命名)を作製しました(図3)。試験管内でRNA切断活性を測定したところ、「Cas7-11S」はCas7-11と同様のRNA切断活性を示すことを発見しました。さらに、「Cas7-11S」をアデノ随伴ウイルスベクターを用いてヒト培養細胞に導入し、標的RNAに対する抑制効果を調べたところ、「Cas7-11S」は標的RNAを効率的に抑制することを確認しました。今後「Cas7-11S」は有用なRNA抑制ツールとして遺伝子治療などへの応用が期待されます。また、切断活性を消失させたCas7-11変異体に脱アミノ化酵素を融合することにより、標的RNAに塩基置換を引き起こすことができるため、本研究成果は新規のRNA編集ツールの開発基盤となることも期待されます。
本研究は、稲盛財団InaRISフェローシップ、武田科学振興財団武田報彰医学研究助成、上原記念生命科学財団研究支援助成、科研費「挑戦的研究(開拓)(課題番号:20K20579)」、「学術変革領域研究(A)(課題番号:21H05281)」などの支援により実施されました。
5.発表雑誌
- 雑誌名:
- 「Cell」(オンライン版:5月27日)
- 論文タイトル:
- Structure and engineering of the type III-E CRISPR-Cas7-11 effector complex
- 著者:
- Kazuki Kato*, Wenyuan Zhou*, Sae Okazaki, Yukari Isayama, Tomohiro Nishizawa, Jonathan S. Gootenberg**, Omar O. Abudayyeh**, Hiroshi Nishimasu**(*筆頭著者、**責任著者)
- DOI番号:
- 10.1016/j.cell.2022.05.003
- アブストラクトURL:
- https://doi.org/10.1016/j.cell.2022.05.003
6.問い合わせ先
東京大学先端科学技術研究センター 構造生命科学分野
教授 西増 弘志(にします ひろし)
7.用語解説
(注1)CRISPR-Cas獲得免疫機構:
原核生物のもつ生体防御機構のひとつで、原核生物に感染するウイルス由来の核酸(RNAやDNA)の分解を担う。ウイルス由来核酸の分解にはCas9、Cas12、Cas13、Cas7-11など様々なCRISPR-Cas複合体が関与する。
(注2)クライオ電子顕微鏡:
液体窒素冷却下でタンパク質などの分子に電子線を照射し、試料の観察を行うための装置。タンパク質や核酸の立体構造の決定に利用されている。
(注3)ドメイン:
タンパク質の機能的なひとかたまりの領域。
(注4)ホスホジエステル結合:
DNAやRNAの5′リン酸基と3′ヒドロキシ基の間の結合。
8.添付資料
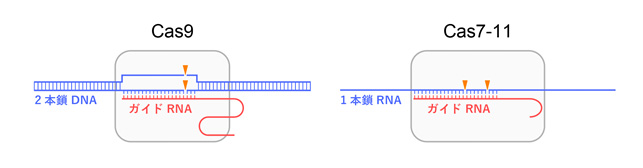
図1 Cas7-11のはたらき
Cas7-11はガイドRNAと複合体を形成し、ガイドRNAと相補的な1本鎖RNAを2か所(塩基3と4および塩基9と10の間)で特異的に切断する。
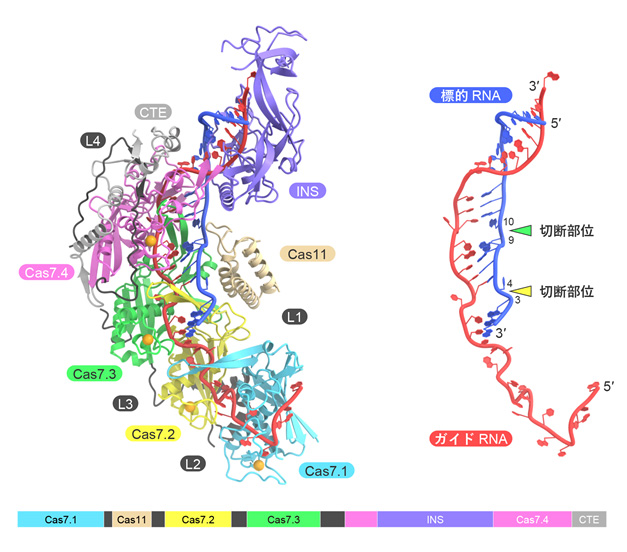
図2 Cas7-11-ガイドRNA-標的RNA複合体の立体構造
Cas7-11は4つのCas7ドメイン(Cas7.1~Cas7.4)、Cas11ドメイン、INSドメイン、CTEドメイン、4つのリンカー領域(L1~L4)からなる。INSドメインはCas7.4ドメインに挿入されたドメインで、ガイドRNA-標的RNAと相互作用していた。CTEドメインはC末端に存在し、Cas7.4ドメインとL4リンカーと相互作用していた。RNAのみの構造を右に示した。
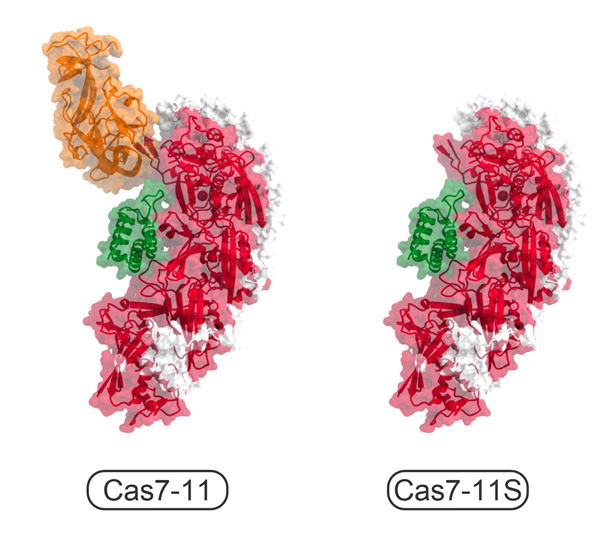
図3 小型のCas7-11S改変体
構造情報をもとにINSドメインを削除した「Cas7-11S」は、Cas7-11よりも小型であるためアデノ随伴ウイルスベクターに搭載し標的細胞へ効率的に送達することができる。Cas7ドメインを赤色、Cas11ドメインを緑色、INSドメインをオレンジ色、CTEドメインとリンカー領域を白色で示した。