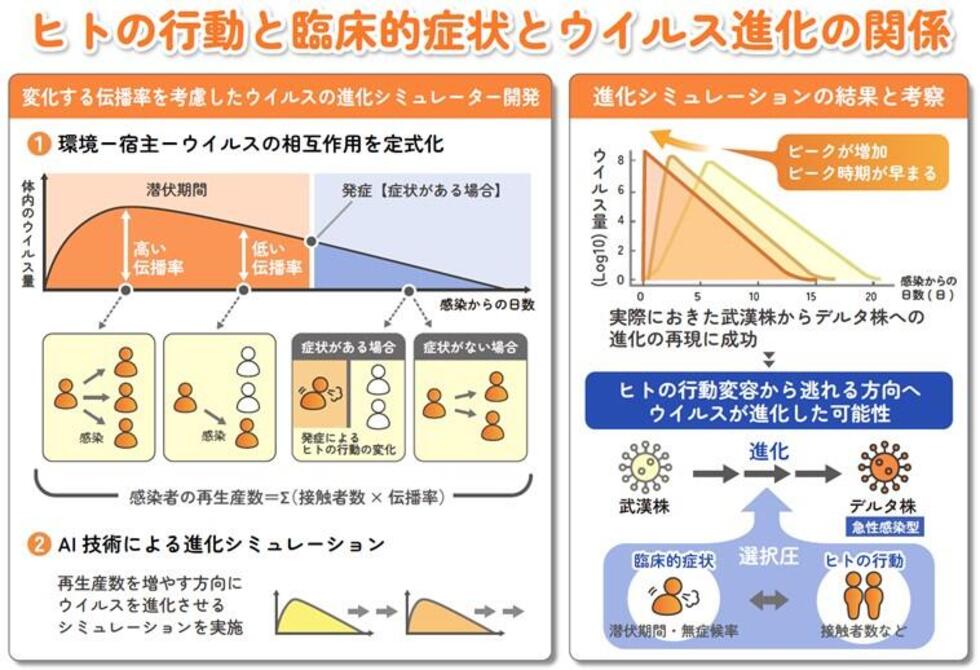
2023-11-22 東京大学
発表のポイント
◆ ブレビバチルス発現系と表面プラズモン共鳴法によるハイスループット相互作用解析装置を融合した、ハイスループットな抗原―抗体間相互作用解析系「BreviA(ブレビア)」を開発しました。この手法を用いて、ヒトPD-1タンパク質に結合する抗体をもとに、マウスPD-1タンパク質にも強く結合できるような抗体をデータ駆動的に設計しました。
◆ 抗体遺伝子クローニング、抗体発現、相互作用解析を多サンプル並列処理することで、解析に必要な時間・労力の大幅な削減を達成しました。
◆ 本解析系を用いて得られる抗体アミノ酸配列と相互作用パラメータのデータセットは、機械学習を用いた抗体設計への応用が期待されます。
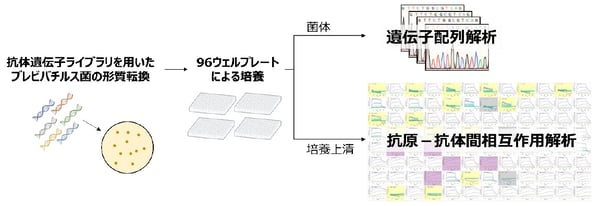
ハイスループットな抗原―抗体間相互作用解析系「BreviA」の概要
概要
東京大学大学院工学系研究科の松長遼助教、津本浩平教授らによる研究グループは、ブレビバチルス(注1)発現系と表面プラズモン共鳴法(SPR法)(注2)によるハイスループット(注3)相互作用解析装置を融合した、ハイスループットな抗原―抗体(注4)間相互作用解析系「BreviA」を開発しました。本解析系では、抗体遺伝子クローニング、抗体遺伝子配列解析、抗体発現、相互作用解析を多サンプル並列処理(最大384サンプル)することで、解析に必要な時間・労力の大幅な削減を達成しました。
本解析系の有用性を実証するため、ヒトPD-1タンパク質(注5)に結合する抗体をもとに、マウスPD-1タンパク質にも強く結合できるような抗体設計に取り組みました。BreviAを用いた抗体変異体スクリーニングにより、ヒトPD-1への結合能を維持したまま、マウスPD-1への結合能を高められる変異導入領域を特定し、その領域にさらに多様な変異を導入することでマウスPD-1への結合能を100倍以上高めた抗体の設計に成功しました。BreviAでは抗体配列と相互作用パラメータからなるデータセットをハイスループットに取得できることから、機械学習を用いた抗体設計への応用が期待されます。
発表内容
抗体とは、病気の原因となる物質(抗原)に結合して免疫機能に関与するタンパク質のことです。抗体を医薬品として用いるためには、どれだけ強くその抗原に結合できるかが重要です。この結合の強さを親和性(注6)と呼びます。一般的に、親和性が強い抗体は少ない量で効果が出るので、治療に必要な費用も少なくて済みます。しかし、動物などでつくられた抗体は、親和性が弱いことがあります。そのような場合には、抗体のアミノ酸(注7)配列の一部を変えて親和性を高める方法があります。
表面プラズモン共鳴法(SPR法)とは、分子同士の親和性を正確に測る方法の1つです。SPR法では、片方の分子をセンサーチップに固定した状態でもう片方の分子をその上に流し、結合した分子の量をリアルタイムで測定することができます。これにより、分子同士の結合速度や解離速度がわかり、そこから親和性を算出できます。しかしながら、従来は高純度のサンプルが必要で、さらに同時に測定できるのは数種類であったことから、抗原と抗体の親和性に関する大規模なデータ取得には不向きでした(図1)。
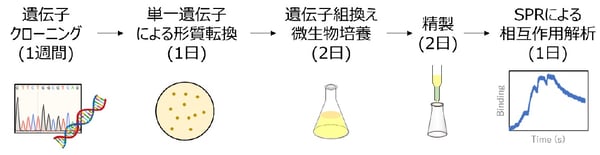
図1:従来の抗原-抗体間相互作用解析の手法(1種類の抗体あたり)
そこで、本研究では、簡便な操作により抗体を生産できるブレビバチルス発現系と、近年開発されたSPR法によるハイスループットな相互作用解析装置を融合した、抗原―抗体間相互作用解析系「BreviA」を開発しました。本解析系では、抗体遺伝子の単離、抗体遺伝子配列解析、抗体発現、相互作用解析を多サンプル並列処理(最大384サンプル)することで、解析に必要な時間・労力を大幅に削減することができました。
BreviAでは、はじめに分析したいさまざまな抗体の遺伝子が含まれるプラスミド(注8)ライブラリを作製し、それを用いてブレビバチルス菌の形質転換(遺伝子導入)を行います。遺伝子が導入された菌は寒天培地上でコロニーを形成します。各コロニーはそれぞれ、ライブラリ中の1種類の遺伝子がランダムに導入された菌の集合体です。これらを96ウェルプレートの各ウェルの液体培地に移して培養します。60時間培養後、遠心分離により、培養液を菌体と培地上清に分離します。菌体からは遺伝子を抽出し、その配列を解析することで、抗体のアミノ酸配列を同定します。培地上清には、そのアミノ酸配列を有した抗体が含まれています。これをSPR測定用のセンサーチップに固定化し、抗原との相互作用解析を行います。ここで、センサーチップの表面には抗体に融合したペプチドタグと特異的に結合できる官能基が存在するため、事前に手間のかかる精製作業を行うことなく、さまざまな分子が含まれる培養上清の中から、抗体だけを特異的に固定化することができます。
BreviAの有用性を示すために、ヒトPD-1タンパク質に結合する抗体(トリパリマブ)をもとに、マウスPD-1タンパク質にも強く結合できるような抗体設計に取り組みました。まず、トリパリマブの相補性決定領域(注9)の1つのアミノ酸残基をアラニン(注10)もしくはチロシン(注11)に変えた132種類の抗体配列から構成される遺伝子ライブラリを作製し、BreviAによる解析を行いました。その結果、抗体を構成するH鎖とL鎖のうち、L鎖の99-101番領域のアミノ酸を変えると、マウスPD-1への親和性が向上することがわかりました(図2左、図3)。
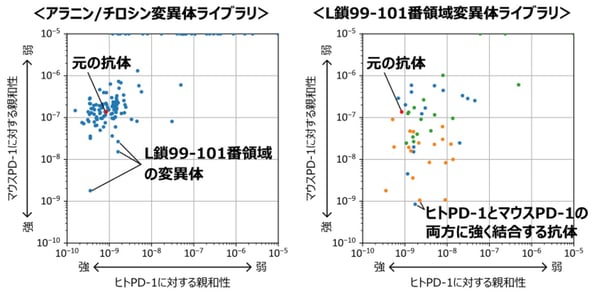
図2:トリパリマブ変異体ライブラリに対するBreviAスクリーニングの結果
右図の青い点はL鎖99番の変異体、橙の点はL鎖100番の変異体、緑の点はL鎖101番の変異体を示す。
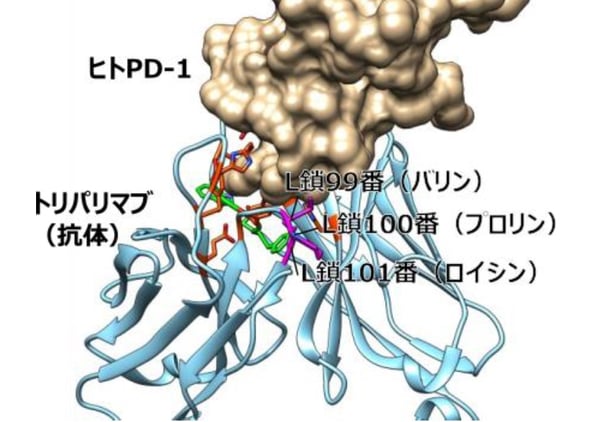
図3:トリパリマブとヒトPD-1の複合体構造(PDBID:6JBT)におけるL鎖99-101番領域の位置
紫の領域が、マウスPD-1に対する親和性獲得に重要な領域であるL鎖99-101番残基を示す。
そこで、その領域をさまざまなアミノ酸に変えた48種類の抗体配列から構成される遺伝子ライブラリを作製し、BreviAによる解析を行ったところ、元の抗体からたった1つのアミノ酸を変えるだけで、ヒトPD-1への親和性はあまり変わらずに、マウスPD-1への親和性が100倍以上高くなった抗体を取得することに成功しました(図2右)。この手法で必要な情報は抗体のアミノ酸配列のみで、どのように抗原と抗体が相互作用するのかに関する事前解析は必要ないことから、さまざまな抗体の設計に適用することが可能です。また、このような種特異性変換デザインは、創薬の観点で、動物モデルを用いた有効性試験のヒトへの外挿性を高めることに有効です。
BreviAでは抗体配列と相互作用パラメータからなるデータセットをハイスループットに取得できることから、今後は機械学習を用いた抗体設計への応用が期待されます。
発表者・研究者等情報
東京大学大学院工学系研究科
津本 浩平 教授
松長 遼 助教
氏家 寛 博士課程
稲垣 万優子 修士課程
ホルヘ フェルナンデス ペレス(Jorge Fernández Pérez) 博士課程
安田 佳生 博士課程
アステラス製薬株式会社
曽我 真司 主管研究員
三桝 信哉 主任研究員
論文情報
雑誌名:Scientific Reports
題 名:High-throughput analysis system of interaction kinetics for data-driven antibody design
著者名:Ryo Matsunaga, Kan Ujiie, Mayuko Inagaki, Jorge Fernández Pérez, Yoshiki Yasuda, Shinya Mimasu, Shinji Soga, Kouhei Tsumoto*
DOI: 10.1038/s41598-023-46756-y
研究助成
本研究は、JST ACT-X「特異的分子認識場のデータ駆動型設計」(課題番号:JPMJAX222I)、CREST「Antibody-Based Molecular Designに基づくウイルスの機能制御技術およびセンシング技術の開発」(課題番号:JPMJCR20H8)、文部科学省「データ創出・活用型マテリアル研究開発プロジェクト事業(課題番号:JPMXP1122714694)」の支援により実施されました。
用語解説
(注1)ブレビバチルス
細胞外にタンパク質を分泌発現する能力に優れた、グラム陽性菌の一種。大腸菌と同様に、簡便な操作で取り扱うことが可能。
(注2)表面プラズモン共鳴法(Surface Plasmon Resonance: SPR法)
金属薄膜基板表面への分子の結合および解離を、基板表面に入射した光に対する反射光の性質の変化によって測定する手法。蛍光分子などの標識が不要で、分子の結合の様子をリアルタイムで測定することが可能である。
(注3)ハイスループット
高速で大量の処理を行うこと。自動化や並列化などの技術により達成される。
(注4)抗体
B細胞とよばれる免疫細胞から産生されるタンパク質。いくつかの種類が知られており、医薬品としては主に免疫グロブリンG(IgG)が用いられる。IgGは2つのFab領域と1つのFc領域から構成され、Y字型の形をした分子である。このうち、Fab領域が抗原と結合する領域である。本研究では、簡単のため、このFab領域のことを抗体とよび、実験に用いている。
(注5)PD-1タンパク質
免疫細胞の表面に発現し、免疫応答を調節する役割をもつ受容体タンパク質。がんなどの疾患に関与することから、重要な創薬ターゲットの1つとして知られている。ヒトとマウスのPD-1のアミノ酸配列相同性は約60%である。
(注6)親和性
結合の強さを表す指標。解離平衡定数KDと呼ばれるパラメータ(単位:モル濃度)で定義される。KDの値が小さいほど、親和性が高いことを示す。
(注7)アミノ酸
タンパク質の構成単位となる分子。生物のタンパク質を構成するアミノ酸は20種類存在し、それぞれ構造と性質が異なる。
(注8)プラスミド
細菌の細胞内で複製できる環状DNA。この中に任意の遺伝子を組み込むことで、菌体内で抗体などのタンパク質を生産することができる。
(注9)相補性決定領域
抗体の抗原結合領域において、もっとも配列が多様に変化する部位。生体内では、この領域のアミノ酸配列をさまざまに変えることにより、抗原と強く結合する抗体がつくられる。
(注10)アラニン
タンパク質を構成する20種類のアミノ酸の1つ。側鎖がメチル基で小さいため、他のアミノ酸残基をアラニンに置換することで、元のアミノ酸側鎖の影響を取り除くことができる。
(注11)チロシン
タンパク質を構成する20種類のアミノ酸の1つ。水酸基を有する芳香族アミノ酸。相補性決定領域に高い割合で存在し、抗原との特異的な相互作用に貢献することが多い。
プレスリリース本文:PDFファイル
Scientific Reports:https://www.nature.com/articles/s41598-023-46756-y