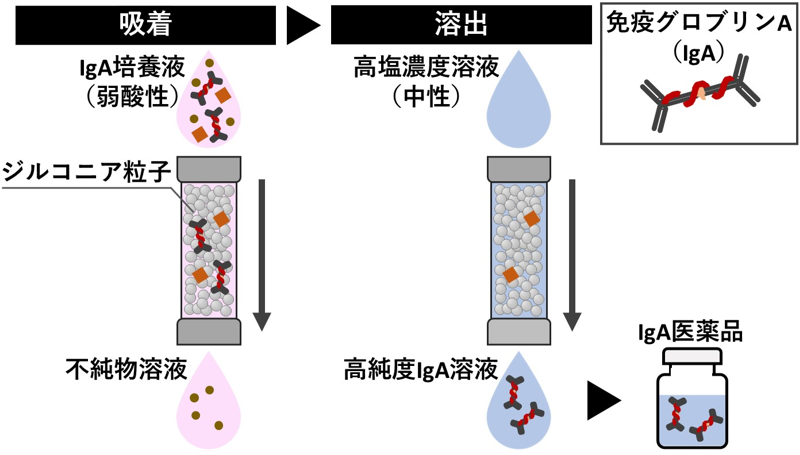
2025-08-27 京都産業大学
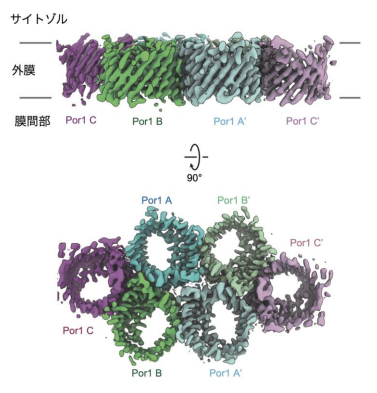
図1: クライオ電子顕微鏡で決定した酵母ポリン(Por1)の6量体構造
<関連情報>
- https://www.kyoto-su.ac.jp/news/news-001429.html
- https://www.kyoto-su.ac.jp/mt_uploads/20250827_press01.pdf
- https://www.nature.com/articles/s41467-025-62021-4
ミトコンドリアポリンのオリゴマー形成に基づく機能 Oligomer-based functions of mitochondrial porin
Hironori Takeda,Saori Shinoda,Chiho Goto,Akihisa Tsutsumi,Haruka Sakaue,Chunming Zhang,Takashi Hirashima,Yuta Konishi,Haruka Ono,Yu Yamamori,Kentaro Tomii,Hiroya Shiino,Yasushi Tamura,Solène Zuttion,Bruno Senger,Sylvie Friant,Hubert D. Becker,Yuhei Araiso,Nanako Kobayashi,Noriyuki Kodera,Masahide Kikkawa & Toshiya Endo
Nature Communications Published:25 July 2025
DOI:https://doi.org/10.1038/s41467-025-62021-4
Abstract
Porin, or the voltage-dependent anion channel (VDAC), is a primary β-barrel channel in the mitochondrial outer membrane. It transports small metabolites and ions through its β-barrel pore and plays key roles in apoptosis and inflammatory response. Here we report the cryo-electron microscopy structure of yeast porin (Por1) in its hexameric form at 3.2 Å resolution. This structure allows us to introduce various mutations at the protomer interfaces, uncovering three critical functions of Por1 assembly beyond transport. Por1 binds unassembled Tom22, a subunit of the mitochondrial protein import gate (the TOM complex), to facilitate protein import into the intermembrane space, maintains proper mitochondrial lipid composition in the outer membrane through lipid scramblase activity, and contributes to the retention and regulated loss of mitochondrial DNA, in cooperation with nucleases identified through screening enabled by the obtained Por1 mutant.