2019-08-23 大阪市立大学,東京大学,日本医療研究開発機構
本研究のポイント
- あらゆる粘膜で非常に高濃度の抗原特異的な免疫グロブリンA(IgA)を誘導する方法を開発、致死的な細菌感染の発症そのものの抑制が可能に。
- 生活習慣病の代表である肥満や糖尿病の原因となる病原常在腸内細菌を制御することで、発症を抑制できることが明らかに。
- 今後、さまざまな疾患において同定される腸内細菌(Pathobiont)を標的とした全く新たな予防法・治療法の確立につながる大きな成果。
概要
大阪市立大学大学院医学研究科 ゲノム免疫学の植松智教授、藤本康介助教(東京大学医科学研究所国際粘膜ワクチン開発研究センター自然免疫制御分野を兼任)らの研究グループは、全身の粘膜において致死的な感染症だけでなく、疾患特異的な腸内細菌の制御へ応用できる新規粘膜ワクチンを開発しました(特許WO/2016/199904)。
近年では、腸内微生物のゲノム解析研究が進み、さまざまな疾患と腸内細菌叢の乱れとの関連性や、疾患の発症に直接的に関わる病原常在腸内細菌が次々と発見されており、粘膜ワクチンも多数開発されています。しかしながら、ワクチン接種により全身の粘膜で抗原特異的な免疫応答を自在に誘導できる方法はなく、疾患制御のために消化や恒常性の維持に関わる有益菌を殺さずに病原常在腸内細菌だけを特異的に排除することができませんでした。 植松教授らの研究グループが開発したワクチンは、接種後に感染防御が必要な粘膜面へ抗原を加えるだけで、非常に高濃度の抗原特異的な免疫グロブリンA(IgA)※1を誘導でき、それによりコレラ毒素による下痢の抑制、肺炎の最大の原因菌である肺炎球菌感染の制御、ならびにヒトの肥満や糖尿病の原因となる腸内常在細菌の制御が可能になることが明らかとなりました。
本研究成果は2019年8月21日に国際科学雑誌『Gastroenterology』(IF=19.233)にオンライン掲載されました。
- ※1 免疫グロブリンA(IgA)
- …消化管をはじめとした粘膜面では、細菌やウイルスの侵入を防ぐために粘膜免疫が働いており、その中でも中心となって活躍している抗体
研究の背景
消化管をはじめとした粘膜面は、IgAが多量に存在して粘膜免疫防御機構の一端を担っていますが、あらゆる粘膜面に対して自在に抗原特異的IgAを誘導する技術はこれまで存在していませんでした。本研究グループは、これまで行ってきた腸管粘膜固有層の樹状細胞やIgAの誘導メカニズム解析(Nat Immunol.2006, Nat Immunol.2008, J Immunol.2011)を基盤として、IgA誘導能を持つ腸管型の樹状細胞の末梢組織での誘導を検討しました。
また、次世代シークエンサー※2をはじめとしたゲノム解析技術の進歩に伴い、常在微生物叢解析(特に腸内細菌叢解析)が盛んに行われるようになりました。近年では、肥満、糖尿病、動脈硬化、炎症性腸疾患、関節リウマチ、大腸がん、パーキンソン病などさまざま疾患において、腸内細菌叢の乱れと疾患との関係性が明らかとなっています。さらに、疾患の発症と直接的に関わる腸内細菌も発見され、胃がんにおけるピロリ菌のように、疾患の発症予防のために除菌が期待されています。しかしながら、抗生物質の使用は、有益菌も殺傷し、腸内細菌の乱れを助長する可能性があるため、病原常在腸内細菌だけを特異的に排除できる方法が求められていました。
- ※2 次世代シークエンサー
- …遺伝子の配列を高速に読み出せる装置で、圧倒的に短い時間で低コストでゲノム解析することが可能。
研究内容
本研究では、自然免疫受容体として知られているToll様受容体※3 9番のリガンドであるCpG-ODNおよびDectin-1のリガンド※4であるcurdlan(細菌の菌体成分)を用いた新規粘膜ワクチンを開発しました(図1)。この粘膜ワクチンを用いると、全身のリンパ節に抗原特異的なメモリーB細胞が誘導され、粘膜面へ抗原を加えることで抗原特異的なIgAを自在に誘導することが可能となりました。
- ※3 Toll様受容体
- …細菌やウイルスなどの特徴的な構造を見分ける病原体センサーの役割を果たす
- ※4 リガンド
- …ある特定の受容体に特異的に結合する物質
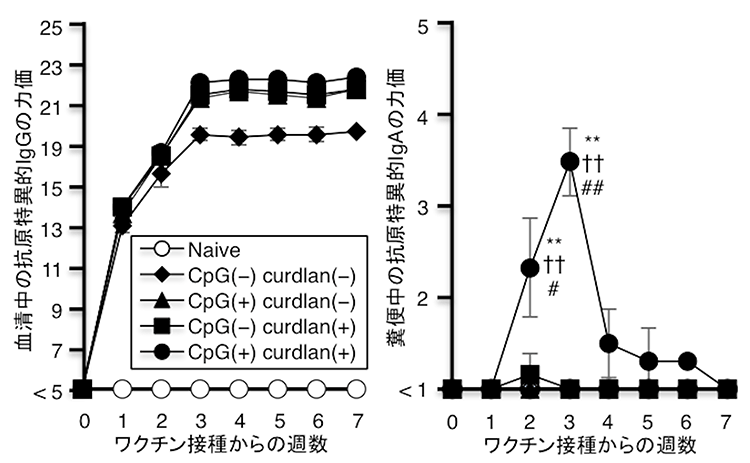
図1:ワクチン接種後の抗原特異的な血清中のIgG※5とIgAの推移
肺炎球菌性肺炎はわが国における市中肺炎の最大の原因であり、致死的な感染症になり得ることが知られています。そこで、肺炎球菌抗原を用いて肺炎球菌に対するワクチンを作成し、肺炎球菌感染の制御について検討しました。ワクチン接種6週間後に肺炎球菌抗原を経鼻投与した結果、気管支肺胞洗浄液中の抗原特異的なIgGとIgAが上昇することが明らかとなりました(図2A)。さらに、肺炎球菌を感染させると、本研究で開発した新規粘膜ワクチンを接種している群では、肺炎球菌の定着が阻害され、重篤な肺炎が起こらないことが明らかとなりました(図2B・C)。
- ※5 IgG(免疫グロブリンG)
- …侵入してきた細菌やウイルスの抗原と結合して白血球の働きの補助などを行う
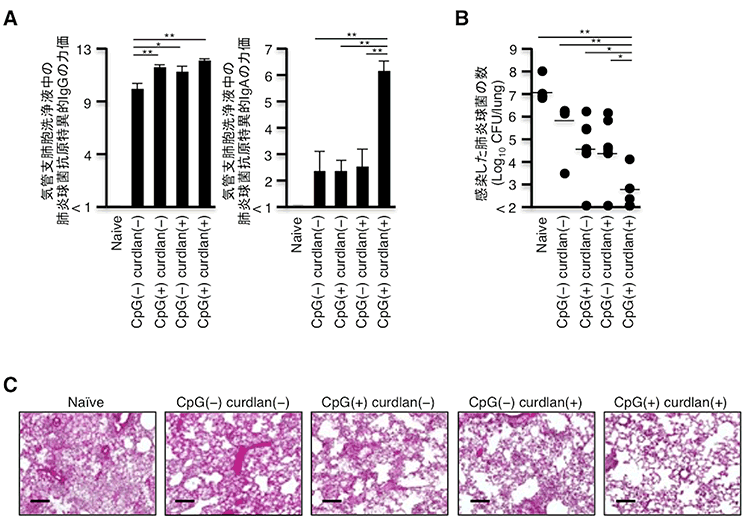
図2:肺炎球菌に対する新規粘膜ワクチンは肺炎球菌性肺炎を著明に抑えることができる
(A)ワクチン接種6週間後に肺炎球菌抗原を経鼻投与して1週間後の気管支肺胞洗浄液中の抗原特異的なIgGおよびIgAを測定
(B・C)ワクチン接種6週間後に肺炎球菌抗原を経鼻投与して1週間後に肺炎球菌を感染させ、感染2日後の菌量と組織(HE染色)を解析
さらに、肥満・糖尿病で増加することが報告されている腸内常在細菌Clostridium ramosumに特異的なワクチンを作成し、ヒト肥満者の糞便を定着させたノトバイオートマウス※6に接種したところ、肥満・糖尿病モデルで有意な改善を示しました(図3A・B)。
- ※6 ノトバイオートマウス
- …無菌のマウスに特定の微生物のみを定着させたマウス
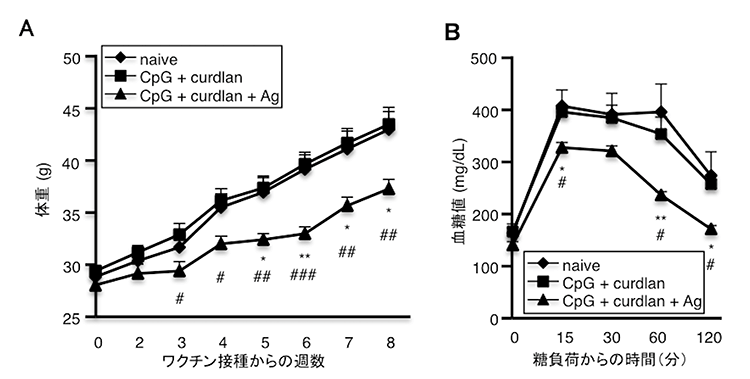
図3:肥満者の糞便を移植したノトバイオートマウスにC. ramosumに特異的なワクチンを接種すると高脂肪食で誘導される肥満や糖尿病は抑制される
(A)経時的な体重変化を示す
(B)経口糖負荷試験による血糖値の推移を示す
期待される効果
本研究成果である新規粘膜ワクチンの方法をヒトで実用化することにより、病原体の侵入門戸である粘膜において強力な粘膜免疫応答を誘導でき、「発症する前に抑制する」全く新しいコンセプトのワクチンの開発が期待されます。また、このワクチンの方法を疾患特異的な腸内細菌を標的として応用することで、これまで制御できなかった腸内細菌叢の乱れに関連するさまざまな難治性の疾患に対する新たな治療アプローチとして使える可能性が期待されます。
資金・特許等について
本研究は、日本医療研究開発機構(AMED)「創薬基盤推進研究事業」(JP16ak0101010、JP17ak0101069)、日本学術振興会科研費(若手研究:19K17932、基盤研究(B):17H04257、挑戦的萌芽研究:15K15469)、武田科学振興財団研究助成、キヤノン財団研究助成、the Chiba University-UC San Diego Immunology Initiativeの一環として行われました。 なお、この研究で開発された「ワクチン用アジュバント、ワクチン、及び免疫誘導方法」に関する技術は特許取得されています(WO/2016/199904)。
掲載誌情報
- 発表雑誌:
- Gastroenterology(IF=19.233)
- 論文名:
- Antigen-specific Mucosal Immunity Regulates Development of Intestinal Bacteria-mediated Diseases
- (抗原特異的な粘膜免疫は腸内細菌が媒介する疾患の発症を制御する)
- 著者:
- 最終頁ご参照
- 掲載URL:
- https://www.gastrojournal.org/article/S0016-5085(19)41241-9/fulltext
著者情報
- 著者一覧
- Kosuke Fujimoto1,2,†, Yunosuke Kawaguchi1,2,3,†, Masaki Shimohigoshi1,2,4,†, Yoshiyuki Gotoh5,6, Yoshiko Nakano1,2, Yuki Usui7, Tetsuya Hayashi1,8, Yasumasa Kimura7, Miho Uematsu6, Takuya Yamamoto9,10, Yukihiro Akeda11,12,13, Joon Haeng Rhee14, Yoshikazu Yuki15, Ken J Ishii9,10, Sheila E. Crowe16, Peter B. Ernst17,18,19, Hiroshi Kiyono17,18,20,21, and Satoshi Uematsu1,2,22,*
- 所属
- 1Department of Immunology and Genomics, Osaka City University Graduate School of Medicine, 1-4-3 Asahi-machi, Abeno-ku, Osaka 545-8585, Japan
2Division of Innate Immune Regulation, International Research and Development Center for Mucosal Vaccines, The Institute of Medical Science, The University of Tokyo, 4-6-1 Shirokanedai, Minato-ku, Tokyo 108-8639, Japan
3Department of Pediatric Surgery, Graduate School of Medicine, Chiba University, 1-8-1 Inohana, Chuo-ku, Chiba 260-8677, Japan
4Department of Molecular Immunology, Research Institute for Microbial Diseases, Osaka University, Suita 565-0871, Japan
5Division of Molecular Immunology, Medical Mycology Research Center, Chiba University, 1-8-1, Inohana, Chuo-ku, Chiba 260-8673, Japan
6Division of Mucosal Symbiosis, International Research and Development Center for Mucosal Vaccines, The Institute of Medical Science, The University of Tokyo, 4-6-1 Shirokanedai, Minato-ku, Tokyo 108-8639, Japan
7Division of Systems Immunology, The Institute of Medical Science, The University of Tokyo, 4-6-1 Shirokanedai, Minato-ku, Tokyo 108-8639, Japan
8Department of Hematology, Osaka City University Graduate School of Medicine, 1-4-3 Asahi-machi, Abeno-ku, Osaka 545-8585, Japan
9Laboratory of Adjuvant Innovation, National Institutes of Biomedical Innovation, Health and Nutrition, 7-6-8 Asagi Saito, Ibaraki, Osaka 567-0085, Japan
10Laboratory of Vaccine Science, WPI Immunology Frontier Research Center, Osaka University, 3-1 Yamada-oka, Suita, Osaka 565-0871, Japan
11Division of Infection Control and Prevention, Osaka University Hospital, 2-15 Yamada-oka, Suita, Osaka 565-0871, Japan
12Research Institute for Microbial Diseases, Osaka University, 3-1 Yamada-oka, Suita, Osaka 565-0871, Japan
13Department of Infection Control and Prevention, Graduate School of Medicine, Osaka University, 2-2 Yamada-oka, Suita, Osaka 565-0871, Japan
14Department of Microbiology and Clinical Vaccine R&D Center, Chonnam National University Medical School, 160 Baekseo-ro, Dong-gu, Gwangju 501-746, Republic of Korea
15Division of Mucosal Immunology, Department of Microbiology and Immunology, The Institute of Medical Science, The University of Tokyo, 4-6-1 Shirokanedai, Minato-ku, Tokyo 108-8639, Japan
16Department of Medicine, University of California, San Diego, La Jolla, 9500 Gilman Drive #0063, La Jolla, CA 92093, USA
17Division of Gastroenterology, Department of Medicine, CU-UCSD Center for Mucosal Immunology, Allergy and Vaccines, University of California San Diego, San Diego, La Jolla, 9500 Gilman Drive #0063, La Jolla, CA 92093, USA
18Division of Comparative Pathology and Medicine, Department of Pathology, University of California San Diego, San Diego, La Jolla, 9500 Gilman Drive #0063, La Jolla, CA 92093, USA
19Center for Veterinary Sciences and Comparative Medicine, University of California, San Diego, La Jolla, 9500 Gilman Drive #0063, La Jolla, CA 92093, USA
20Department of Mucosal Immunology, IMSUT Distinguished Professor Unit, The Institute of Medical Science, The University of Tokyo, 4-6-1 Shirokanedai, Minato-ku, Tokyo 108-8639, Japan
21International Research and Development Center for Mucosal Vaccines, The Institute of Medical Science, The University of Tokyo, 4-6-1 Shirokanedai, Minato-ku, Tokyo 108-8639, Japan
22Collaborative Research Institute for Innovative Microbiology, The University of Tokyo, 1-1-1 Yayoi, Bunkyo-ku, Tokyo 113-8657, Japan - †These authors contributed equally to this work
お問い合わせ先
研究内容に関するお問い合わせ先
大阪市立大学大学院医学研究科 ゲノム免疫学
担当:助教 藤本 康介
ご取材に関するお問い合わせ先
大阪市立大学 広報課
担当:長谷川 千晶
AMED事業に関するお問い合わせ先
国立研究開発法人 日本医療研究開発機構(AMED)
創薬戦略部医薬品研究課 創薬基盤推進研究事業