新たな免疫療法への応用に期待
2020-12-22 北海道大学,東北大学,日本医療研究開発機構
- 牛伝染性リンパ腫ウイルス感染症に対する免疫チェックポイント阻害薬(抗PD-L1抗体)の処置で、別の免疫抑制物質の産生が誘導されることを解明。
- ウシではプロスタグランジンE2が受容体EP4を介してT細胞の活性化を阻害していることを確認。
- 抗PD-L1抗体とEP4阻害剤を併用すると、マウスのリンパ腫で抗腫瘍効果が増強されることを証明。
概要
北海道大学大学院獣医学研究院、同人獣共通感染症リサーチセンター、東北大学未来科学技術共同研究センター/医学系研究科抗体創薬研究分野による研究グループは、免疫チェックポイント阻害薬*1抗PD-L1抗体の処置により誘導されるプロスタグランジンE2*2(PGE2)が、抗体治療効果を減弱させるという新たな耐性獲得機構を解明しました。
近年ヒト医療では、免疫チェックポイント阻害薬をはじめとした免疫療法ががん患者に対する第4の治療戦略として注目されています。一方で、免疫チェックポイント阻害薬の奏効率は20~30%に留まっており、耐性獲得機構や奏効率を高める併用療法の開発に関する研究が盛んに行われています。本研究グループでは致死性の牛伝染性リンパ腫(旧名:牛白血病)*3をモデルにした研究を通して、抗PD-1/PD-L1抗体が牛伝染性リンパ腫ウイルス(BLV)感染牛に対して一定の治療効果を発揮することをこれまでに報告しました(参考資料1、2参照)。さらに、PGE2の産生を抑制するCOX-2阻害剤*4と抗PD-L1抗体を併用すると、治療効果が増強されることも明らかにしました(参考資料4参照)。しかしながら、これらの併用により治療効果が増強される機序は明らかになっていませんでした。
本研究ではまず、抗PD-L1抗体を投与したBLV感染牛の解析を行い、抗PD-L1抗体の投与後に血中PGE2濃度が上昇していることを発見しました。試験管内(in vitro)における解析により、抗PD-L1抗体処置により炎症性サイトカインの一つであるTNF-αの産生が亢進し、このTNF-αを介してPGE2の産生が誘導されることを発見しました。さらに、PGE2が受容体EP4を介してT細胞の活性を直接抑制することを確認しました。そこでこれらの知見を基に、抗PD-L1抗体とEP4阻害剤を併用して効果を検証すると、ウシ及びマウスにおいて免疫活性化効果が観察され、リンパ腫モデルマウスにおいて抗腫瘍効果が増強されることを証明しました。本研究は、家畜の免疫療法に関する研究から得られた新たな知見をマウスモデルでも実証した画期的な研究であり、動物種によらない共通のメカニズムと予想されることから、家畜のみならずヒトにおける新規免疫療法として応用が期待されます。
なお、本研究成果は2020年12月21日(月)公開のImmunoHorizons誌に掲載されました。
背景
ヒトのがん医療において、免疫チェックポイント阻害薬を始めとした免疫療法が、外科的療法、化学療法、放射線療法に加えて第4の治療戦略として注目されています。抗PD-1抗体や抗PD-L1抗体等の免疫チェックポイント阻害薬は一部の患者さんに対して劇的な奏効を示す一方で、その奏効率は20~30%と報告されており、治療効果を減弱させてしまう耐性獲得機構の解明や治療効果を高める他の薬剤との併用療法の開発が強く求められています。
獣医学領域では、本研究グループがウシやイヌに対する免疫チェックポイント阻害薬を開発し、牛伝染性リンパ腫(旧名:牛白血病)やイヌの口腔内悪性黒色腫*5に対する治療効果を報告してきました。また、ウシの研究においては抗PD-L1抗体とPGE2の産生を抑制するCOX-2阻害剤の併用が、その治療効果を増強させることも報告しました。一方で、併用療法により治療効果が増強されたメカニズムに関しては不明でした。
本研究では、抗PD-L1抗体を投与したBLV感染牛を解析した結果、抗体投与後に血中PGE2量が増加することを確認しました。すなわち、抗PD-L1抗体は免疫賦活効果を発揮する一方で、免疫抑制物質PGE2も誘導していることを発見しました。そこで、抗PD-L1抗体投与によって誘導されたPGE2が抗体治療の効果を減弱させているのではないかと仮説を立て、抗PD-L1抗体存在下におけるPGE2誘導機序やPGE2によるT細胞の抑制機序の解析を行いました。さらに、抗PD-L1抗体とEP4阻害剤の併用療法の機能評価をウシに加えてマウスの腫瘍モデルを用いて行いました。
参考資料(過去の北海道大学プレスリリース)
(1)牛難治性疾病の制御に応用できる免疫チェックポイント阻害薬(抗PD-L1抗体)の開発にはじめて成功
(2)牛難治性疾病の制御に応用できる免疫チェックポイント阻害薬(抗PD-1抗体)を、抗PD-L1抗体薬に続き開発
(3)ヨーネ病の病態発生メカニズムを解明―家畜法定伝染病ヨーネ病に対する制御法への応用に期待―
(4)ウシの疾病に有効となる抗ウイルス効果の確認に成功―牛白血病などの新規制御法への応用に期待―
(5)イヌのがん治療に有効な免疫チェックポイント阻害薬 (抗 PD-L1 抗体)の開発にはじめて成功―北海道大学動物医療センターにおける臨床研究成果―
研究手法
ウシの血液を材料に、免疫学的な実験手法により抗PD-L1抗体投与後のPGE2動態、抗PD-L1抗体によるPGE2誘導機序、受容体EP4を介したPGE2の免疫抑制効果を解析しました。また、ウシ血液及びマウス脾臓の免疫細胞を材料に、抗PD-L1抗体とEP4阻害剤の免疫活性化効果を評価しました。さらに、リンパ腫モデルマウスに抗PD-L1抗体とEP4阻害剤を投与して、抗腫瘍効果の検討を行いました。
研究成果
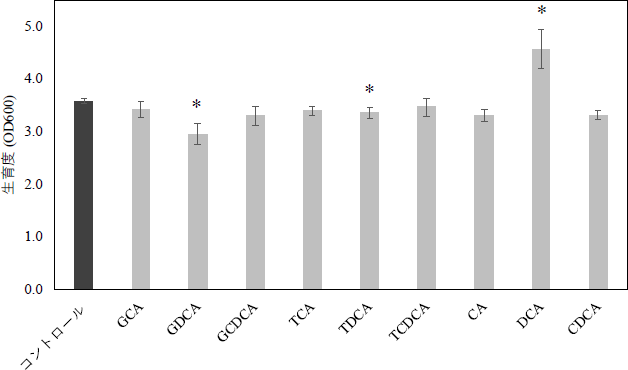
抗PD-L1抗体を単独で投与したBLV感染牛では、投与後に血中のPGE2濃度が上昇することを確認しました。試験管内での解析により、抗PD-L1抗体により免疫応答が活性化して炎症性サイトカインの一つであるTNF-αの産生が亢進し、このTNF-αを介してPGE2の産生が誘導されることを明らかにしました。また、PGE2は受容体EP4を介してT細胞の活性化やサイトカイン(IL-2、IFN-γ)の産生を阻害することも確認しました。一方で、抗PD-L1抗体とEP4阻害剤を併用すると免疫応答をより強く活性化できることを明らかにしました。この知見はマウスの免疫細胞を用いた実験でも観察されたことから、最後にリンパ腫モデルマウスを用いた抗腫瘍効果の評価を行いました。両薬剤を併用すると、腫瘍体積が減少しマウスの生存が延長する効果が確認されました(図1、2)。
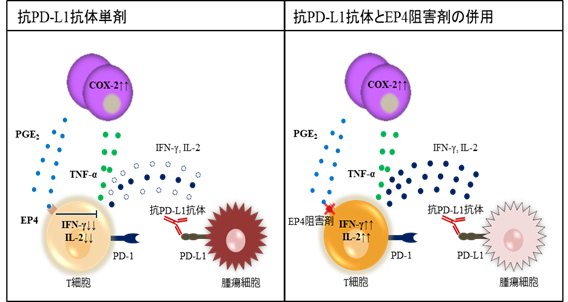
図1.抗PD-L1抗体とEP4阻害剤の併用における免疫活性化機構。免疫チェックポイント阻害薬(抗PD-L1抗体)の処置によりプロスタグランジンE2(PGE2)が誘導され、受容体EP4を介してT細胞の活性化を阻害する(左図)。この現象はEP4阻害剤を併用することで解消され、免疫応答が増強される(右図)。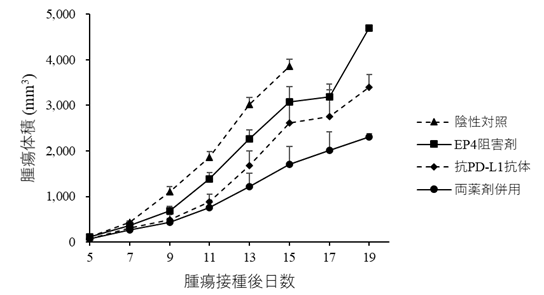
図2.リンパ腫モデルマウスにおける各投与群による腫瘍体積の変化
今後への期待
本研究では、抗PD-L1抗体は免疫賦活効果を発揮する一方、別の免疫抑制物質PGE2を誘導し免疫療法の効果を減弱させていること、並びにPGE2の作用を抑制するEP4阻害剤との併用が免疫療法の効果を増強させることを示しました(図1)。本研究で得られた知見は、獣医学領域のみならずヒトの研究にも応用できる可能性があります。今後は、本研究成果を広く活用し、獣医療並びにヒト医療の向上を目指した応用研究を展開していく予定です。
研究費・研究支援
本研究成果の一部は文部科学省科学研究費助成事業、国立研究開発法人農業・食品産業技術総合研究機構生物系特定産業技術研究支援センター・イノベーション創出強化研究推進事業並びに革新的技術開発・緊急展開事業(うち地域戦略プロジェクト)、農林水産省の安全な畜産水産物安定供給のため包括的レギュラトリーサイエンス研究推進委託事業及び東北大学における国立研究開発法人日本医療研究開発機構創薬等ライフサイエンス研究支援基盤事業(BINDS)JP20am0101078の支援の下で行われました。
論文情報
- 論文名
- Enhanced immunotherapeutic efficacy of anti-PD-L1 antibody in combination with an EP4 antagonist(抗PD-L1抗体とEP4阻害剤による免疫活性化及び抗腫瘍効果の増強)
- 著者名
- 佐治木 大和1、今内 覚1、Zimeng Cai1、高田 健介1、 岡川 朋弘1、前川 直也1、 藤澤 宗太郎1、加藤 幸成2、 鈴木 定彦1、3、 村田 史郎1、大橋 和彦1(1北海道大学大学院獣医学研究院、2東北大学大学院医学系研究科、3北海道大学人獣共通感染症リサーチセンター)
- 雑誌名
- ImmunoHorizons(免疫学の専門誌)
- DOI
- 10.4049/immunohorizons.2000089
- 公表日
- 2020年12月21日(月)(オンライン公開)
用語解説
- *1 免疫チェックポイント阻害薬
- 免疫チェックポイント因子を標的として、その機能を阻害する薬。免疫チェックポイント因子として、PD-1やPD-L1といったタンパク質が知られており、がん細胞や病原体が免疫を回避する機構として利用されている。例えば、免疫細胞(T細胞)のPD-1というタンパク質と病原体の感染細胞やがん細胞のPD-L1というタンパク質が結びつくと、免疫細胞はがん細胞や病原体に対する攻撃を⽌めてしまう。免疫チェックポイント阻害薬である抗PD-1抗体や抗PD-L1抗体は、PD-1とPD-L1の結合を阻害する薬剤であり、がん細胞や病原体に対する免疫応答を活性化させる作用を有する。なお、PD-1を発⾒し、新たながん治療薬に応⽤した京都⼤学の本庶 佑特別教授と、同じく免疫チェックポイント因⼦ CTLA-4をがん治療薬に応⽤したテキサス州⽴⼤学MDアンダーソンがんセンターの James P. Allison博⼠は、2018年のノーベル⽣理学・医学賞を受賞している。
- *2 プロスタグランジンE2
- アラキドン酸からシクロオキシゲナーゼ等の酵素を介して合成される生 理活性物質。炎症等に関与する一方で、免疫抑制作用を有することも知られている。
- *3 牛伝染性リンパ腫(旧名:牛白血病)
- 牛伝染性リンパ腫は、レトロウイルスである牛伝染性リンパ腫ウイルス(BLV)の感染が原因の牛難治性疾病の1つで、病態が進行するとリンパ球の増加や全身性の悪性リンパ腫(リンパ肉腫)を引き起こす。家畜伝染病予防法において監視伝染病に指定され、発生数はウシの監視伝染病では最多である(2019年の全国発生数は4、113頭、うち北海道での発生数は733頭)。すでに日本のウシの約35%がBLVに感染しており、畜産業に甚大な被害をもたらしている。日本の家畜衛生における最大の問題となっているが、現在有効な治療法が存在せず、新規制御法の開発が強く望まれている。
- *4 COX-2阻害剤
- 非ステロイド性消炎鎮痛薬(NSAIDs)の1つで PGE2の産生を阻害する薬剤。 PGE2 はアラキドン酸から律速酵素シクロオキシゲナーゼ(COX)によって産生される。COXには COX-1とCOX-2の2つのアイソザイムが存在するが、COX-2阻害剤は選択的にCOX-2を阻害してPGE2産生を抑制する。
- *5 イヌの口腔内悪性黒色腫
- 色素細胞(メラノサイト)を起源とする悪性腫瘍の一種。イヌでは口腔に好発し、致死的な経過をたどることが多い。メラノーマと呼ばれることもある。
お問い合わせ先
研究内容に関すること
北海道大学大学院獣医学研究院
准教授 今内 覚(こんない さとる)
東北大学未来科学技術共同研究センター/大学院医学系研究科抗体創薬研究分野
教授 加藤 幸成(かとう ゆきなり)
配信元
北海道大学総務企画部広報課
東北大学大学院医学系研究科・医学部 広報室
AMED事業に関すること
国立研究開発法人日本医療研究開発機構
創薬事業部 医薬品研究開発課
創薬等ライフサイエンス研究支援基盤事業(BINDS)