2020-12-25 理化学研究所,広島大学
理化学研究所(理研)生命機能科学研究センター先端バイオイメージング研究チームのアルノ・ジェルモン研究員、渡邉朋信チームリーダー(広島大学原爆放射線医科学研究所教授)らの共同研究グループは、培養細胞にレーザー光を照射したときに散乱する光(ラマン散乱光[1])を利用し、分化細胞からiPS細胞[2]へのリプログラミング[2]過程にある細胞のリプログラミング状態を非染色・低侵襲的に評価する手法を開発しました。
本手法は、タンパク質や遺伝子の発現を観察する従来法に比べて簡便・高速であり、今後の幹細胞研究の強力なツールになると期待できます。
分化した細胞がリプログラミングを経て多能性[2]を獲得する際、細胞のトランスクリプトーム[3]、プロテオーム[3]、メタボローム[3]には大きな変化が生じます。このような変化を観察し記録することは、リプログラミング現象の解明や、最終的なiPS細胞の品質を評価する上で重要な情報となりますが、検査に要する手間や時間、コストが課題です。
これら技術を代替する迅速かつ低コストなiPSリプログラミング評価技術の実現に向けて、共同研究グループは、細胞にレーザー光を照射した際に得られるラマン散乱光が、細胞の状態を反映したスペクトルを持つことに着目しました。マウスES細胞[2]に由来する分化細胞、リプログラミング中の細胞、iPS細胞それぞれのラマン散乱光を解析したところ、細胞の分化状態やリプログラミング状態を単細胞精度で判別できることが分かりました。
本研究成果は、科学雑誌『Analytical Chemistry』(11月17日号)に掲載されました。
細胞の分化状態を反映するラマン散乱スペクトル
背景
ES細胞やiPS細胞など、体の全ての細胞を作り出す能力である「多能性」を持つ幹細胞(多能性幹細胞)は、細胞分化や個体発生などの研究材料として広く用いられており、創薬・再生医療などへの応用も進められています。iPS細胞が分化細胞からリプログラミングを経て多能性を獲得する際、トランスクリプトーム、プロテオーム、メタボロームには大きな変化が生じます。このような変化を観察し記録することは、リプログラミング現象の解明や、最終的なiPS細胞の品質を評価する上で重要な情報となります。
細胞のリプログラミング状態は、多能性マーカー遺伝子などの発現によって確認できます。しかしこの方法は、細胞を免疫染色法[4]で観察したり、定量的PCR法[5]で遺伝子発現量を調べたりなど、細胞の固定や細胞抽出物の調製が必要であり、検査に要する手間や時間、コストがかかります。細胞を破壊せずに、細胞のリプログラミング状態を簡素かつ迅速に確認できれば、幹細胞研究を推進する強力な技術になると期待できます。
先端バイオイメージング研究チームは、これまでラマン散乱と呼ばれる光散乱現象を応用し、非染色・低侵襲・短時間で細胞の状態を判別する技術の開発に取り組んできました注1-2)。ラマン散乱とは、物質に光を照射した際に、物質を構成する分子の振動がエネルギーを光に与えたり、逆に光から奪ったりすることで、光の波長が少し変化してから散乱し、散乱光の一部が照射光と異なる波数(色)となる現象です。この波数の変化(色の違い)は、分子が持つ固有振動数に対応します。
細胞はタンパク質、核酸(DNAやRNA)、代謝物といったさまざまな分子で構成されているため、単一色の光を当てても、細胞から得られるラマン散乱光はさまざまな色(さまざまなピークを持つスペクトル)となります。このスペクトルの形状は細胞内部の分子組成を反映しており、分子組成は細胞の状態や種類によって異なります。したがって、細胞に障害を与えない強さのレーザー光を照射したときのスペクトルの形状から、細胞を傷つけずに細胞の状態を判別できると考えられます。
これまで、ES細胞が分化する際のラマン散乱光の変化を捉えた例や体細胞と幹細胞との差を調べた例はありますが、分化した細胞のリプログラミング過程におけるラマン散乱スペクトルの時間変化については、まだ報告されていませんでした。
注1)2015年6月16日プレスリリース「細胞の分化状態の可視化に成功」
注2)2018年7月17日プレスリリース「非染色・非侵襲・短時間で細菌を判別する光技術」
研究手法と成果
共同研究グループは、多能性幹細胞、分化細胞、リプログラミング中の細胞のそれぞれに特有のラマン散乱スペクトルを高い実験再現性で調べるため、全て同じ遺伝的背景を持つ下記の5種類の細胞を準備しました。
EB5細胞(マウスES細胞の一種)
N31細胞(EB5細胞から分化させた神経系の細胞)
N31d5細胞(N31細胞からiPS細胞へのリプログラミング5日目の細胞)
N31d10細胞(N31細胞からiPS細胞へのリプログラミング10日目の細胞)
N31d20細胞(N31細胞からiPS細胞へのリプログラミング20日目の細胞)
これらの細胞の分化状態をマーカー遺伝子の発現などで調べたところ、EB5細胞とN31d20細胞では多能性マーカー遺伝子が発現し、N31細胞では神経マーカー遺伝子が発現していたことから、分化とリプログラミングが想定通りに行われたことが確認できました(図1)。
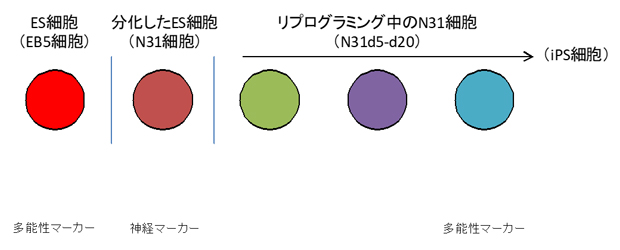
図1 ES細胞の分化とリプログラミング
本実験で用いた、全て同じ遺伝的背景を持ち、分化状態の異なる5種類の細胞。元となるES細胞(EB5細胞)とリプログラミング20日目の細胞(N31d20細胞)は、多能性マーカー遺伝子(Nanog=緑色)を発現し、分化細胞は神経マーカー遺伝子(Nestin=緑色)を発現する。これらの細胞は、京都大学iPS細胞研究所(CiRA)の升井伸二准教授(現山梨大学)の協力を得て準備した。
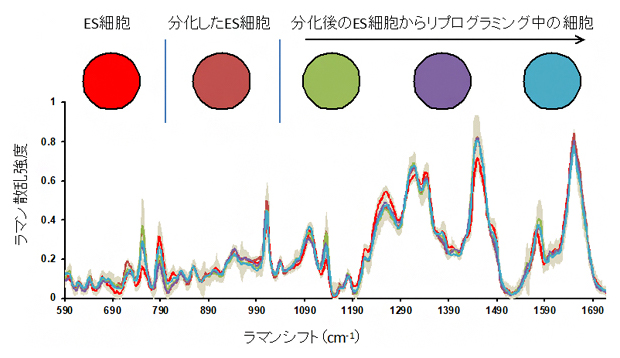
そこでこれらの細胞を用いて、先行研究で開発したハイスループットラマン散乱分光装置注2)により、1細胞ごとのラマン散乱スペクトルを取得しました(図2)。波数590cm-1から1710cm-1にかけて約40個の明瞭なピークを観察し、チトクロム[6]などを示す752cm-1付近、核酸などを示す1260cm-1付近など複数のピークに、細胞種による強さの違いが示されました(図2)。なお、レーザー照射前後で細胞の形状などに変化はなかったため、レーザー照射による細胞へのダメージは少ないと考えられます。
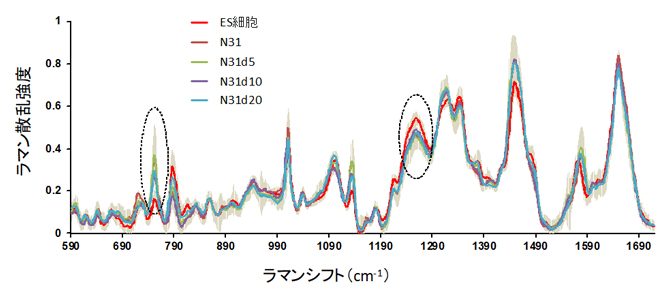
図2 ES細胞とES細胞に由来する細胞のラマン散乱スペクトル
ES細胞(EB5細胞)、分化細胞(N31)、リプログラミング中の細胞(N31d5、N31d10、N31d20)から得られたラマン散乱スペクトル。それぞれ60~70個の細胞を一つ一つ計測した結果を平均したもの。縦軸はラマン散乱光の強度、横軸はラマンシフト(照射したレーザー光と散乱光の波数の差)を表す。点線で囲んだ752cm-1付近や1260cm-1付近のピークなどが、5種の細胞ごとに異なる散乱光の強さを示した。
次に、機械学習[7]手法の一つであるニューラルネットワーク[7]を用いて、ラマン散乱スペクトルの形状だけから細胞の分化状態を推測するモデルを開発しました。このモデルは、平均して88.6%の精度で細胞種の違いを見分けることができたため、ラマン散乱スペクトルには細胞を判別するための十分な情報が含まれていることが示されました。
そこで、スペクトルの成分の中でそれぞれの細胞状態を特徴づける帯域がどこかを調べるため、分化した神経細胞(N31細胞)に対する多能性幹細胞(EB5細胞)の詳細な比較を行いました。その結果、752cm-1付近などの帯域が神経細胞の分化と強く関連しているのに対し、786cm-1や1240cm-1の帯域が多能性を特徴づけていました(図3)。また、リプログラミングの前(N31細胞)と後(N31d20細胞)の比較でも、ほぼ同様の結果が得られました。
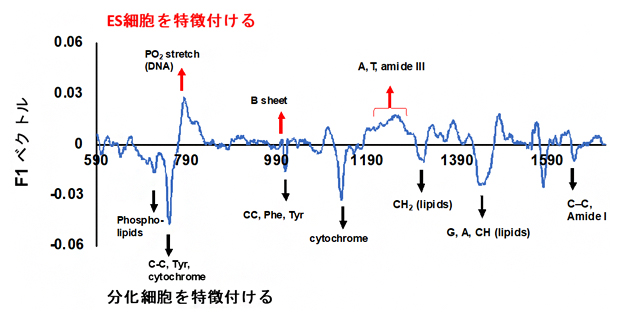
図3 ES細胞と分化細胞を特徴づけるラマン散乱スペクトルの帯域
ES細胞(EB5細胞)と分化細胞(N31細胞)の違いを反映するスペクトルの帯域を特定するため、これらの1細胞データを全て用い、部分的最小二乗判別分析(PLS-DA)と呼ばれる統計的手法を用いて解析した。縦軸のF1ベクトルは、2種の細胞を判別する重み付けを相対値で表したもの。赤と黒の矢印は、それぞれの判別に特に重要であると示されたピーク。
以上の解析から、ラマン散乱スペクトルには、多能性(ES細胞、リプログラムされた細胞)への傾向を特徴づける波数と、分化(神経細胞)への傾向を特徴づける波数が含まれていることが示されました。これら2種類の細胞のスペクトルの特徴を統計的な手法で1次元の数値(F1 値)に変換し、個々の細胞のF1値を平面上にプロットしたところ、二つの集団に分かれることが明らかになりました(図4左)。そこで、新たにN31細胞からリプログラミングを行った細胞のラマン散乱スペクトルを取得し、それらのF1値をテストデータとして平面にプロットしたところ、リプログラミングの進行に沿って細胞集団が分離されました(図4右)。この結果は、ラマン散乱スペクトルが、細胞のリプログラミング状態を記述するバイオマーカーとして利用できることを示しています。
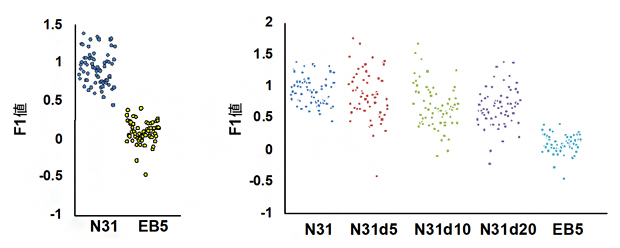
図4 細胞のリプログラミング状態を記述するラマン散乱スペクトルのスコア
左)図3と同様に部分的最小二乗判別分析(PLS-DA)で解析した分化細胞(N31細胞)とES細胞(EB5細胞)の違いを1次元の数値(F1値)で表した図。点は一つ一つの細胞を示す。細胞が二つの集団に分離されることが分かる。
右)N31細胞を左端に、EB5細胞を右端に配置し、N31細胞からリプログラミング中の細胞(N31d5、N31d10、N31d20)のF1値をプロットした図。リプログラミングの進行に沿って細胞集団が分離された。
今後の期待
今回共同研究グループは、細胞のラマン散乱スペクトルを解析することで、非侵襲かつ簡便に細胞の分化状態やリプログラミング状態を単細胞精度で評価できる可能性を示しました。本成果をもとに、判別に必要なスペクトルの帯域を絞り込むことができれば、解析の高速化などさらなる手法の改良も考えられます。
また、同研究グループは現在、観察したスペクトルの変化とトランスクリプトームとの関連性を調査しています。さらに、プロテオーム、メタボロームなど細胞に生じる具体的な現象との対応関係を示すことができれば、今後の幹細胞研究に強力なツールとなることが期待できます。
補足説明
1.ラマン散乱光
光を物質に入射すると、その一部が散乱する。そのほとんどは入射光と同じ波長(レイリー散乱光)であるが、一部の光は、物質を構成する分子の固有の振動からエネルギーを得たり、逆に奪われたりすることで、入射光とは異なる波長で散乱される。この現象をラマン散乱といい、そのときの光をラマン散乱光と呼ぶ。1928年に、インドの物理学者C. V. Ramanによって発見された。
2.iPS細胞、リプログラミング、多能性、ES細胞
動物の初期胚が持つ、体を構成する全ての種類の体細胞へ分化する能力を多能性という。また、成体の細胞(体細胞)の核を未分化な状態に初期化(リセット)することをリプログラミングと呼ぶ。iPS細胞は、皮膚や血液などから採取した細胞に少数の遺伝子などを導入することで、リプログラミングされた多能性幹細胞。ES細胞は、哺乳類の着床前胚(胚盤胞)に存在する内部細胞塊から作製された多能性幹細胞。
3.トランスクリプトーム、プロテオーム、メタボローム
生体分子や細胞の挙動などの生体活動に関わる網羅的な情報をオミックスと呼ぶ。一つのゲノム、または特定の細胞・組織・器官の中で生産される全転写産物(RNA)、全タンパク質、全代謝産物をそれぞれ、トランスクリプトーム、プロテオーム、メタボロームと呼ぶ。
4.免疫染色法
細胞や組織中の標的分子に対する抗体を使い、その分子の発現や局在を可視化する手法。
5.定量的PCR法
PCR(ポリメラーゼ連鎖反応)法により増幅したDNAを定量的に検出する方法。逆転写法と組み合わせることで、サンプル中の少量のRNAを定量することができる。
6.チトクロム
細胞の呼吸に関わるタンパク質。ヘム鉄を持つ。
7.機械学習、ニューラルネットワーク
機械学習は、コンピュータに反復的にデータを与え、データの特徴づけや分類などを自動的に習得させるデータ解析法である。この特徴づけや分類に従って、未知のデータに対する推定や将来予測などが可能になる。ニューラルネットワークは機械学習の一種で、脳内の神経細胞および神経細胞同士の結合を数式的にモデル化したもの。
共同研究グループ
理化学研究所 生命機能科学研究センター
先端バイオイメージング研究チーム
研究員 アルノ・ジェルモン(Arno Germond)
国際プログラムアソシエート(研究当時) ユリア・パニーナ(Yulia Panina)
チームリーダー 渡邉 朋信(わたなべ とものぶ)
(広島大学 原爆放射線医科学研究所 教授)
大阪大学大学院 情報科学研究科
大学院生 志賀 幹夫(しが みきお)
大阪大学 データビリティフロンティア機構
特任准教授 新岡 宏彦(にいおか ひろひこ)
原論文情報
Arno Germond, Yulia Panina, Mikio Shiga, Hirohiko Niioka, and Tomonobu M. Watanabe, “Following Embryonic Stem Cells, Their Differentiated Progeny, and Cell-State Changes During iPS Reprogramming by Raman Spectroscopy”, Analytical Chemistry, 10.1021/acs.analchem.0c01800
発表者
理化学研究所
生命機能科学研究センター 先端バイオイメージング研究チーム
研究員 アルノ・ジェルモン(Arno Germond)
チームリーダー 渡邉 朋信(わたなべ とものぶ)
(広島大学 原爆放射線医科学研究所 教授)
報道担当
理化学研究所 広報室 報道担当
広島大学 財務・総務室 広報部広報グループ