2021-04-23 東京大学医科学研究所,慶應義塾大学医学部,川崎市産業振興財団 ナノ医療イノベーションセンター,神奈川県立病院機構 神奈川県立がんセンター,札幌医科大学,日本医療研究開発機構
発表のポイント
- 乳がん、膵がんで発現が亢進している転写因子であるPRDM14遺伝子を標的とした配列特異性の高いキメラ型siRNA(注1)と核酸を病変に送達するY-shaped block co-polymer (YBC) (注2)からなる核酸医薬候補を開発しました。
- 乳がん、膵がんを模した動物モデルに本核酸医薬候補を静注投与したところ、腫瘍径の増大を抑制しました。また、遠隔転移モデルにおいても、転移巣の減少、生存期間の延長が認められました(9. 参考資料を参照)。
- 本研究の成果は、2021年4月13日公開のInternational Journal of Cancer誌にオンライン掲載されました。また、本研究の成果を受けて2020年9月より本核酸医薬候補の医師主導型治験が開始されました。
発表内容
PRDM14分子は、乳がんでその発現が特に高いことが札幌医科大学において豊田実(故人)、今井浩三らにより発見されました(Cancer Res, 2007) (文献1)。その後、谷口らによりPRDM14分子が膵がん等の悪性腫瘍においても発現が高く、がん幹細胞性形質(抗がん剤耐性、転移・浸潤、血管新生等)を腫瘍細胞に付与することが見出されました(Oncotarget, 2017; Carcinogenesis, 2017)(文献2、3)。PRDM14分子ががん組織にのみ発現し、正常細胞で発現を認めないことから、がん治療の良い分子標的になることが想定されました。
一方、PRDM14分子が核内転写因子であることから、遺伝子情報から創薬が可能である核酸創薬に着手しました。また、治癒的切除ができない患者を対象とした静注投与による全身投与法の創出を目標としました。これらの核酸医薬のハードルを克服するために、核酸、及びそのデリバリーシステムに関して革新的な技術を適用しました。東京大学大学院理学研究科で開発された、極めて安全性・血中安定性が高く十分なRNA干渉効果が得られる「キメラ型siRNA」を用い、また、siRNA配列探索プログラム(注3)(文献4)を基盤に、off target効果を排除した治療用配列を選定しました。さらに、東京大学大学院工学系研究科、ナノ医療イノベーションセンターで開発された核酸ナノキャリアである、YBCを用いました。YBCは優れた血中滞留性を示し、さらに、EPR効果(注4)によりがん組織への高い集積性を示します (文献5)。
難治性であるトリプルネガティブ乳がん(TNBC)(注5)、及び膵がんより樹立されたPRDM14分子が陽性であるがん細胞株を用いた動物モデルを作製し、PRDM14遺伝子を標的とするsiRNA核酸医薬候補の治療効果を評価しました。静注投与にてPRDM14 siRNA核酸医薬候補を投与した結果、乳がん同所移植モデル、膵がん皮下移植モデルの双方において、腫瘍径の増大を抑制し、その効果は抗がん剤との併用で相乗的な治療効果を呈しました(9.参考資料、図1を参照)。さらに、遠隔転移モデルに適用したところ、転移巣の減少、生存期間の延長が認められました (9.参考資料、図2を参照)。YBCの先行型である、分岐型PEG-poly(L-lysine)と比較して、現在、治験に用いられている分岐型PEG-poly(L-ornithine)を用いることにより、より少量のポリマーにて同等の治療効果が得られることも判明しました。また、安全性試験 (非臨床試験)において、重篤な有害事象は認められませんでした。この成果を受け、がん研究会有明病院において、治癒的切除不能又は遠隔転移を有する再発乳がんの患者に対して、医師主導治験 (第Ⅰ相)が現在進行中です。
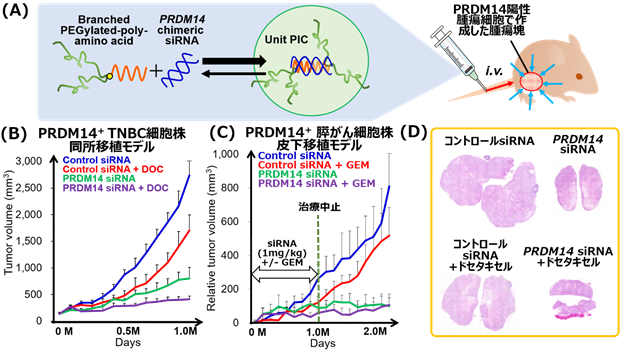
図1 PRDM14遺伝子を標的としたsiRNA核酸医薬候補(A)PRDM14 siRNA核酸医薬候補は、配列選定を行ったキメラ型siRNAと核酸を病変部位に送達する分岐型PEGとポリオルニチンが共有結合したポリマーにより構成される。それらが複合体を形成し径17nmのunit PIC(ポリイオンコンプレックス)となる。(B) PRDM14陽性のTNBC細胞株を免疫不全マウスの乳腺に移植、一定の腫瘍径を超えたのちに上記核酸医薬候補を静注投与した際の腫瘍径。(C)PRDM14陽性の膵がん細胞株を免疫不全マウスの皮下に移植、一定の腫瘍径を超えたのちに核酸医薬候補を静注投与した際の腫瘍径。その後、1か月間無治療で経過を追った。(D)(B)においてエンドポイントで得られた腫瘍のHE染色像。
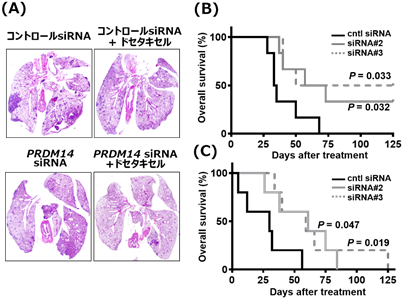
図2 乳がん、膵がんの転移モデルに対するPRDM14 siRNA医薬の効果(A)PRDM14陽性のTNBC細胞株を用いて作製した肺転移モデルに対して、核酸医薬候補を静注投与した際のエンドポイントにおける肺の切片。 (B) (A)におけるマウスの生存曲線、(C)PRDM14陽性の膵がん細胞株を用いて作製した肝転移モデルに対して、核酸医薬候補を静注投与した際のマウスの生存曲線
発表雑誌
雑誌名
International Journal of Cancer ( 4月13日オンライン版)
論文タイトル
Treatment of primary and metastatic breast and pancreatic tumors upon intravenous delivery of a PRDM14-specific chimeric siRNA/nanocarrier complex
著者
Hiroaki Taniguchi*, Yukikazu Natori, Yohei Miyagi, Kotaro Hayashi, Fumitaka Nagamura, Kazunori Kataoka, and Kohzoh Imai. (* 責任著者)
DOI 番号
10.1002/ijc.33579
助成金
以下の助成を受けています。
日本医療研究開発機構(AMED)研究費
- H27~28年度 革新的がん医療実用化研究事業「PRDM14を標的とする革新的核酸治療による難治性がん克服のための実用化に関する臨床研究」(代表:谷口博昭)
- H27~28年度 革新的がん医療実用化研究事業「新規バイオマーカーPRDM14による難治性乳がん・すい臓がんの診断法の開発」(代表:今井浩三)
厚生労働省科学研究費
- H24~26年度 難病・がん等の疾患分野の医療の実用化研究事業「癌幹細胞を制御する転写因子を標的とした難治性乳癌治療法の開発」(代表:谷口博昭)
民間助成研究費
- 仙台厚生病院研究助成、リレーフォーライフジャパンプロジェクト未来研究助成、膵臓病研究財団 研究奨励賞、日本消化器病学会臨床研究助成
用語解説
(注1)キメラ型siRNA
東京大学大学院理学系研究科西郷薫名誉教授らの研究成果であるキメラ型siRNAは、siRNAがRISC複合体上でmRNAと対合する際に最重要なシード配列に相当する部分をDNAに置換したsiRNAです。siRNAとノックダウン効果が同等であり、血清中で安定、免疫応答誘導性が低く、代謝産物は生命体由来のものです。
(注2)Y-shaped block co-polymer (YBC)
共著者の片岡一則教授らが開発した分岐型 PEG-ポリオルニチンブロックポリマーです。ポリオルニチンとポリエチレングリコール(PEG)から構成され原材料の安全性の懸念がありません。優れた血中滞留性を示すとともに粒子径が均一かつ極小でありEPR(Enhanced Permeability and Retention)効果(注4)を最大に発揮し、効果的に癌組織特異的に集積します。
(注3)siRNA配列探索プログラム (siDIRECT)
東京大学理学系研究科で開発されたsiRNA設計ツールです。Refseq情報(レファレンスとなる配列情報)に対応し、配列依存的なオフターゲット効果を最小化したsiRNAの配列を高速で設計することができます。本研究では共著者である名取幸和先生のご協力により、本ツールを基盤に治療用の核酸配列の最適化を行いました。
(注4)EPR (Enhanced permeation and retention) 効果
腫瘍組織で増生する腫瘍血管は、正常組織の毛細血管に比べ血管透過性が著しく亢進しているため、一定の粒径の分子は、腫瘍血管の間隙から腫瘍組織へ濾出されます。同時に、腫瘍組織はリンパ系が未発達のため、腫瘍組織に到達した物質が蓄積されます。このような特性をEPR効果と称します。
(注5)トリプルネガティブ乳がん(TNBC)
TNBCは乳がん全体の約10~15%を占め、女性ホルモン(エストロゲンとプロゲステロン)により増殖する性質を持たず、かつ、がん細胞の増殖に関わるタンパク質の一つであるHER2を過剰にもっていないという特徴を有する乳がんで、3つの陰性 (エストロゲン受容体(ER)陰性、プロゲステロン受容体(PgR)陰性、HER2陰性)を意味してトリプルネガティブと言われます。そのため、ホルモン療法や、HER2を標的とした分子標的薬の効果が乏しく、抗がん剤治療を行います。
引用文献
- Nishikawa N, Toyota M*, Suzuki H, et al. Gene Amplification and Overexpression of PRDM14 in Breast Cancers. Cancer Res.15;67(20):9649-57, 2007.
- Taniguchi H*, Hoshino D, Moriya C, et al. Silencing PRDM14 expression by an innovative RNAi therapy inhibits stemness, tumorigenicity, and metastasis of breast cancer. Oncotarget. 8:46856-46874, 2017.
- Moriya C, Taniguchi H*(co-first), Miyata K, et al. Inhibition of PRDM14 expression in pancreatic cancer suppresses cancer stem-like properties and liver metastasis in mice. Carcinogenesis. 38(6): 638-648, 2017.
- Ui-Tei K*, Naito Y, Zenno S, et al. Functional dissection of siRNA sequence by systematic DNA substitution: modified siRNA with a DNA seed arm is a powerful tool for mammalian gene silencing with significantly reduced off-target effect. Nucleic Acids Res. 36(7):2136-2151, 2008.
- Watanabe S, Hayashi K, Toh K, et al. In vivo rendezvous of small nucleic acid drugs with charge-matched block catiomers to target cancers. Nat Commun.10(1):1894, 2019.
(* 責任著者)
共同研究グループ
谷口 博昭(慶應義塾大学医学部臨床研究推進センター 特任准教授、東京大学医科学研究所 分子療法分野 客員准教授)
名取 幸和(慶應義塾大学医学部 客員研究員、大阪大学医学系研究科 招聘教授)
宮城 洋平(神奈川県立がんセンター臨床研究所 所長)
林 光太郎(ナノ医療イノベーションセンター 研究員)
長村 文孝(東京大学医科学研究所 先端医療開発推進分野 教授)
片岡 一則(ナノ医療イノベーションセンター センター長、東京大学 名誉教授)
今井 浩三(北海道大学遺伝子病制御研究所 客員教授)
謝辞
研究開発において国立研究開発法人日本医療研究開発機構、医療イノベーション推進センター(TRI)、日本消化器病学会、仙台厚生病院の御支援を受けました。また、キメラ型siRNAの設計、GMP合成において、株式会社RNAi、Abnova社、ST Pharm社、YBCの合成においてナノキャリア株式会社、日油株式会社、非臨床試験に株式会社イナリサーチ社のご協力を得ました。
お問い合わせ先
研究に関すること
慶應義塾大学医学部 特任准教授 谷口博昭(たにぐち ひろあき)
札幌医科大学名誉教授 今井浩三(いまい こうぞう)
開発に関すること
公益財団法人川崎市産業振興財団 ナノ医療イノベーションセンター
COINS研究推進機構支援事務局 島﨑(しまざき)、佐竹(さたけ)
報道に関すること
東京大学医科学研究所
国際学術連携室(広報) 清水麻子
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課 革新的がん医療実用化研究事業事務局