2021-06-02 理化学研究所,日本医療研究開発機構
理化学研究所(理研)脳神経科学研究センター親和性社会行動研究チームの吉原千尋研究員、時田賢一研究員(研究当時)、黒田公美チームリーダーらの共同研究グループ※は、母親マウスが自らの身の危険を冒してでも子を助ける行動の一端を担う分子神経機構を発見しました。
本研究成果は、子が育つために親の助けが必要な哺乳動物において、親が困難な状況下でも子育て意欲を維持するための脳のメカニズムの解明に貢献し、将来的にはヒトの子育て意欲の低下への理解と、それに対する支援にもつながると期待できます。
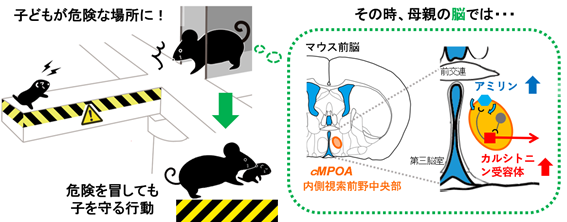
黒田公美チームリーダーらは2012年に、マウスの子育てに必須の脳部位として、内側視索前野中央部(cMPOA)[1]を発見しました。
今回、共同研究グループは、マウスcMPOAにおいて、子育て中に最も高い比率で活性化するカルシトニン受容体(Calcr)[2]を発現する神経細胞群と、その脳内リガンドであるアミリン[3]を発現する神経細胞群を発見しました。Calcrとアミリンは、いずれも出産すると発現が大幅に上昇します。そして、Calcr発現神経細胞の機能が子育てに必要であること、Calcrによるシグナル伝達が母親特有の高リスク条件下における子育て意欲を維持する「母性」の一端を担うことを明らかにしました。
崖っぷちの子を助けに行く母親の脳で起きている分子機構を発見
本研究は、科学雑誌『Cell Reports』オンライン版(2021年6月1日付:日本時間2021年6月2日)に掲載されました。
※共同研究グループ
- 理化学研究所
- 脳神経科学研究センター
- 親和性社会行動研究チーム
- チームリーダー 黒田 公美(くろだ くみ)
- 研究員 吉原 千尋(よしはら ちひろ)
- 基礎科学特別研究員 福光 甘斎(ふくみつ かんさい)
- 研究員 篠塚 一貴(しのづか かずたか)
- テクニカルスタッフⅡ 宮澤 絵里(みやざわ えり)
- 研究員(研究当時) 時田 賢一(ときた けんいち)(現 専修大学 法学部 准教授)
- 研究員(研究当時) 恒岡 洋右(つねおか ようすけ)(現 東邦大学 医学部 講師)
- 神経回路・行動生理学研究チーム テクニカルスタッフⅠ アーサー・ファン(Arthur Jyh-Yen Huang)
- チームリーダー トーマス・マックヒュー(Thomas John McHugh)
- 行動遺伝学技術開発チーム
- チームリーダー(研究当時) 糸原 重美(いとはら しげよし)
- 生命機能科学研究センター
- 比較コネクトミクス研究チーム
- チームリーダー 宮道 和成(みやみち かずなり)
- 日本獣医生命科学大学 応用生命科学部 動物科学科
- 教授 田中 実(たなか みのる)
- 大学院生(研究当時) 丸山 徹歩(まるやま てっぽ)
- 大学院生(研究当時) 金子 美里(かねこ みさと)
- 東京大学大学院 農学生命科学研究科 応用生命化学専攻 生物化学研究室
- 教授 東原 和成(とうはら かずしげ)
研究支援
本研究は、日本医療研究開発機構(AMED)脳科学研究戦略推進プログラム(JP20dm0107144)、日本学術振興会(JSPS)科学研究費補助金JP20H02710(研究代表者:黒田公美)、同JP15K19755(研究代表者:時田賢一)による支援を受けて行われました。
背景
自己の安全や欲求を満たすための行動と、他者のニーズに応えるための向社会行動[4]は、多くの場合、一方を優先すれば同時にもう一方はできない競合関係にあります。
典型的な向社会行動である子育てを考えてみると、哺乳動物の子は未発達な状態で生まれるため、親が子育てをしなければ生きていけません。そのため、特に母親では、授乳、子を危険から守る、子を運ぶなど、さまざまな子育てに対する意欲が高まります(図1a)。しかし、外敵や飢えなど、さまざまな危険が隣り合わせの自然界では、時に親は自らが生きるだけで精一杯で、子を危険から守ることが難しい状況に置かれることもあります。そのような中でも、子育ての意欲を失わず、できる限り子を守ろうとしてきた親たちの子孫が、私たちヒトを含めた現在を生きる哺乳動物だといえます。では、この子育ての意欲は、脳のどこで作られるのでしょうか。
黒田公美チームリーダーらはこれまで、親の子育て行動に必要な脳内メカニズムを研究してきました。マウスは、母親だけでなく父親やきょうだい、さらには同じ縄張り内の雌ならどのマウスでも子育てをするため、子育ての研究に適しています。そこでマウスを用いて、子育てに必須の役割を果たす内側視索前野中央部(Medial preoptic area, the central part;cMPOA)という部位を発見し、cMPOAの機能が低下すると、子育て意欲の最も高い経験を積んだ母親マウスでさえも、子育てをしなくなることを2012年に報告しました注1)。
しかしcMPOAには7種類以上の神経細胞が存在しており、そのうちのどれが子育てに必要なのかは分かっていませんでした。
注1)Tsuneoka, Y., Maruyama, T., Yoshida, S., Nishimori, K., Kato, T., Numan, M., and Kuroda, K.O. (2013). Functional, anatomical, and neurochemical differentiation of medial preoptic area subregions in relation to maternal behavior in the mouse. J Comp Neurol 521, 1633-1663. E-Pub ahead, 2012.
研究手法と成果
共同研究グループはまず、雌のマウスが母親になる前と後で子育て意欲にどのような違いがあるのかを知るために、高リスク環境下を模した高架式十字迷路[5]上で、レトリービング(仔を集めて巣に戻る)行動を調べる実験系を構築しました。すると、母親マウスは安全な場所に仔を集めることができましたが、母親になる前のほとんどのマウスは仔を集められないことが分かりました(図1a)。
次に、母親マウスのcMPOA内で子育て中に活性化する神経細胞のマーカー分子を探索しました。その結果、20以上の候補遺伝子の中から、「カルシトニン受容体(Calcr)」を発現する神経細胞(Calcr神経細胞)が最も高い比率で活性化することを見いだしました(図1b)。
神経細胞の膜表面にある受容体は、特定の分子(その受容体のリガンドと呼ばれる)と結合することで神経細胞の活動を制御します。Calcrの代表的なリガンドであるカルシトニンは脳内には存在せず、代わりにいくつかのペプチドがCalcrに結合することが知られています。そこでcMPOAにおいてCalcrのリガンドが発現しているかを調べたところ、リガンドの一つであるアミリンというペプチドを発現する神経細胞群(アミリン神経細胞)がcMPOA内に存在していました。さらに、母親になると、cMPOA内のCalcr抗体に対する反応性(Calcr分子の総量に相当)は、母親になる前の8倍に増加しました(図1c)。また、アミリンの発現も増加し、検出限界以上のアミリンmRNAが認められる神経細胞も、母親になる前の3倍に増加することが分かりました。
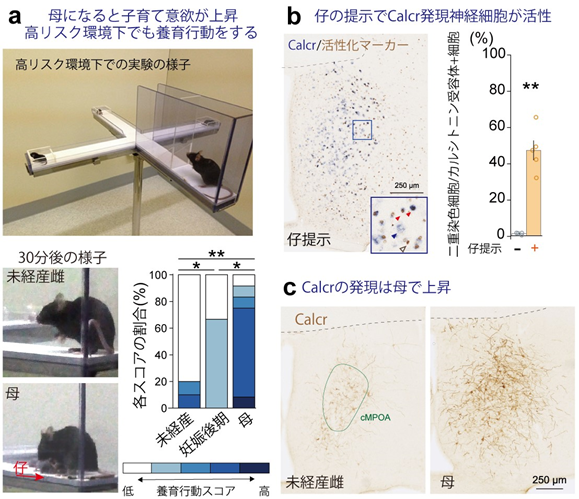
図1 母親マウスにおける子育て意欲の上昇と活性化される神経細胞の探索a)母親マウスは高リスク環境である高架式十字迷路においても、3匹の仔を安全な場所に集めることができたが、未経産の雌マウスの大部分は集められなかった。群左からN=10, 6, 12, * P<0.05, ** P<0.01。
b)母親マウスに仔を見せると、カルシトニン受容体(Calcr)を発現する神経細胞が大きく活性化した。青矢頭はCalcr、白矢頭は活性化マーカー(c-Fos)、赤矢頭は両方を発現する神経細胞を示す。仔提示-群N=4, +群N=5。**P<0.01。
c)母親マウスの脳では、子育てで活性化するCalcr神経細胞の中のCalcrが母親になる前と比べ8倍に増加した。
子育て中に活性化する細胞の全てが、子育てに必要とは限りません。そこで、Calcr神経細胞の子育て行動における機能を調べるため、組換えアデノ随伴ウイルスベクター[6]に組み込まれたテタヌストキシン(TeTX)[7]を用いて、cMPOAのCalcr神経細胞が神経伝達できないように細胞機能を操作しました。すると、母親になる前、また母親になった後でも、授乳や子を運ぶ行動などが激減し、ストレスがほとんどない環境でも子育てができなくなってしまいました(図2)。一方で、交尾や出産など、他の行動には問題が見られなかったことから、Calcr神経細胞には子育てに必須な機能を持つことが細胞レベルで明らかになりました。
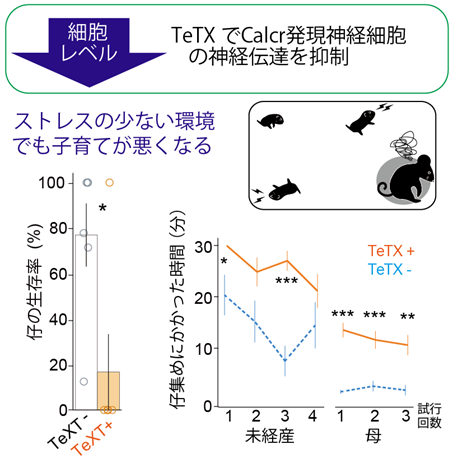
図2 Calcr神経細胞は子育てに必須低ストレス(通常飼育)環境下であっても、テタヌストキシン(TeXT)を発現させることで神経伝達を抑制し、cMPOAのCalcr神経細胞の機能を抑えたマウス(TeXT+)では、仔の生存率が20%以下になり(左)、仔集めにかかった時間も著しく増大した(右)。各群N≧6, *P<0.05, **P<0.01, ***P<0.001。
Calcrを発現する神経細胞が子育てに重要であることは分かりましたが、その細胞全体の中で、Calcrという一種類の分子が実際の子育てにどのように影響するのかは分かりません。そこで、Calcr神経細胞の中で、Calcr分子がどのような機能を持っているのかを分子レベルで明らかにするために、Calcrの発現をRNA干渉[8]という手法により、約半分に減らしました。すると、ホームケージ内での子育ては正常だったものの、高架式十字迷路上のレトリービング行動は抑制されることが分かりました(図3)。従って、母親になると増えるCalcrは、リスクを冒してでも子育て意欲を維持する「母性」の一端を担っていることが明らかになりました。
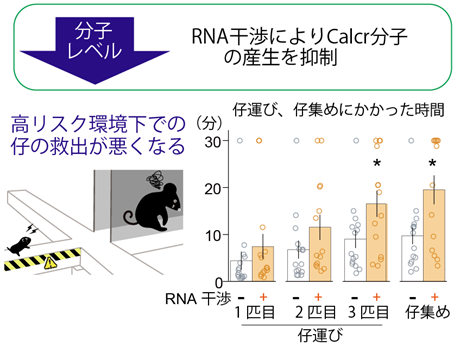
図3 Calcr分子の量を減らしたマウスの高リスク環境における子の救出の抑制RNA干渉によりCalcr神経細胞の中のCalcr分子の量を約半分に減らすと、高リスク環境である高架式十字迷路上で仔集めにかかった時間が増加した。各群N≧14, * P<0.05。
今後の期待
現代社会に生きるヒトにとっても、子育てと親子関係は非常に重要なものです。親子間の関係づくりがうまくいかないと、子どもへの虐待にまで発展してしまうこともあります。子育て行動は哺乳類で種を超えて保存されており、そうした行動がある以上、そこには脳内メカニズムが必要です。
cMPOAのある脳領域は大脳皮質などと比べ、ヒトとほかの哺乳類との差が小さく、解剖学的にかなりよく似ています。また黒田公美チームリーダーらはこれまでに、哺乳動物において子育てができなくなる背景要因を進化生物学と行動神経科学の視点から整理した枠組みを作り、またその枠組みがヒトにも適用できることを報告してきました注2-3)。それらから、子育ての基本的な脳内メカニズムも、ヒトと他の哺乳動物に共通している可能性が高いといえます。
ただし、マウスcMPOAのようにヒトcMPOAにもCalcr神経細胞が存在し、マウスと同じようにヒトでも子育てに重要な役割を果たしているのか、直接答えることは、現時点では困難です。これを明らかにするためには、まずヒト以外の霊長類(サルの仲間)で調べることが役立ちます。
現在共同研究グループでは、霊長類のコモン・マーモセット[9]を用いて、その疑問に答えるべく、研究を行っています。霊長類でもほとんどの種は、母親だけが子育てをしますが、マーモセットは母親、父親、年上のきょうだいからなる家族が交代で子を背負って運びながら分担して子育てをするという、ヒトに似た行動を取ります。もし、マーモセットでもCalcr神経細胞の子育てに対する機能がマウスと共通することが細胞レベルと分子レベルで分かれば、今回の発見を将来的にヒトに応用できる期待が高まります。そして、より複雑な認知機能を持つ霊長類において、子育てにまつわる問題の脳内メカニズムを明らかにできると考えられます。
注2)Kuroda KO, Shiraishi Y, Shinozuka K: “Evolutionary-adaptive and nonadaptive causes of infant attack/desertion in mammals: Toward a systematic classification of child maltreatment”, Psychiatry Clin. Neurosci., 74(10), 516-526(2020)
注3)黒田公美、白石優子、篠塚一貴、時田賢一「子ども虐待はなぜ起こるのか―親子関係の脳科学」こころの科学2016,7月増刊号,16-24
論文情報
- タイトル
- Calcitonin receptor signaling in the medial preoptic area enables risk-taking maternal care
- 著者名
- Yoshihara, C., K. Tokita, T. Maruyama, M. Kaneko, T. Tsuneoka, K. Fukumitsu, E. Miyazawa, K. Shinozuka, A.J. Huang, T.J. McHugh, M. Tanaka, S. Itohara, K. Touhara, K. Miyamichi, and K.O. Kuroda.
- 雑誌
- Cell Reports
- DOI
- 10.1016/j.celrep.2021.109204
補足説明
- [1]内側視索前野中央部(cMPOA)
- 前脳底部、視床下部前方にある視索前野の中の小領域。この部分の機能を阻害すると、特異的に子育てができなくなる。マウスのほか、サルにも同じ領域が存在する。cMPOAは、Medial preoptic area, the central partの略。
- [2]カルシトニン受容体(Calcr)
- カルシトニン受容体は骨ではカルシトニンと結合し、骨へのカルシウム沈着を促進する。脳にもCalcrがあり、後脳ではアミリンと結合して食欲を抑える機能がある。本研究では、CalcrがcMPOAにおいては子育てを促進する機能を報告した。同じ分子がこのように多様な目的で利用されていることは一見不思議だが、ほかにもそのような分子は多く存在する。例えば、オレキシンは食欲と睡眠の両方に強い調節力がある。Calcrは、calcitonin receptorの略。
- [3]アミリン
- 膵臓や脳内で産生され、Calcrに結合するペプチドリガンド。
- [4]向社会行動
- 同種の他個体に対する行動、すなわち社会行動には大きく分けて、縄張り争いのように反発し合うものと、群れでの狩りや共同営巣のように協力し合う性質のものがあり、後者をここでは向社会行動と呼ぶ。
- [5]高架式十字迷路
- 十字型の細い通路(幅5~6㎝)が地面から40㎝の高さに水平に置かれている。通路のうち1本には左右に透明な壁があり、落ちる心配はない(クローズドアーム)が、他の3本には壁がない(オープンアーム)。マウスはオープンアームに出ることを好まず、不安が強いほど、クローズドアームに留まる。本研究ではまず被験マウスだけをこの迷路に置き、10分間行動を観察した後、3本のオープンアームの端に仔マウスを置き、被験マウスが仔に対しどのように行動するかを30分間観察した。
- [6]組換えアデノ随伴ウイルスベクター
- アデノ随伴ウイルスはパルボウイルス科の一本鎖DNAウイルスで、病原性がないなどの性質から、遺伝子治療や生物学実験で人工的に細胞に遺伝子を挿入したいときによく用いられる。その目的でアデノウイルスを組み替えて使うとき、「組換えアデノ随伴ウイルスベクター」と呼ぶ。
- [7]テタヌストキシン(TeTX)
- 破傷風菌が産生するタンパク質毒素で、神経伝達物質の分泌を抑制する作用がある。そのため、脳科学実験では、神経細胞の神経伝達を抑える目的でしばしば用いられる。
- [8]RNA干渉
- 遺伝子発現の際に作られるメッセンジャーRNA(mRNA)は、相補的な塩基配列があると分解される性質がある。これを利用し、標的遺伝子の配列と相補的なRNAを人工的に細胞内に導入し、標的遺伝子の発現を抑制する手法。本研究では、アデノ随伴ウイルスに標的遺伝子であるCalcrと相補的な配列shRNAを組み込み、cMPOA神経細胞に感染させることで、Calcrの発現を約半分に抑制した。
- [9]コモン・マーモセット
- 中南米を原産とする、小型の新世界ザル。夫婦と子どもたちで生活し、分担して新生児の世話をしたり、多彩な音声コミュニケーションを行うなど、高い社会性が注目されている霊長類。
お問い合わせ先
発表者
理化学研究所 脳神経科学研究センター 親和性社会行動研究チーム
チームリーダー 黒田 公美(くろだ くみ)
研究員 吉原 千尋(よしはら ちひろ)
機関窓口
理化学研究所 広報室 報道担当
AMED事業に関するお問い合わせ先
日本医療研究開発機構(AMED)疾患基礎研究部 疾患基礎研究課