がん細胞の浸潤・転移に関わるGタンパク質複合体の構造解析
2021-07-22 理化学研究所,日本医療研究開発機構
理化学研究所(理研)生命機能科学研究センタータンパク質機能・構造研究チームの白水美香子チームリーダー、新野睦子上級研究員らの研究グループは、細胞の運動を促進する「DOCK5[1]」と呼ばれるタンパク質が、その結合パートナーである「ELMO1[2]」タンパク質の助けを借りて「Rac1[3]」というGタンパク質[3]を活性化する仕組みを、クライオ電子顕微鏡法[4]を用いた高解像度の構造解析により解明しました。
本研究成果は、細胞の運動性が深く関与している浸潤がんの治療に向けた創薬研究に貢献すると期待できます。
細胞の運動は、免疫応答や神経突起の形成、がんの転移など、体のさまざまな重要なプロセスに関与しています。Gタンパク質Rac[3]は、アクチン細胞骨格[5]を制御し細胞の形態変化を誘導することで、がん細胞の運動を促進します。DOCKファミリータンパク質はRacを活性化する役割を担っていますが、その機能にはELMO[2]タンパク質との結合が必要です。しかし、ELMOがDOCKの機能をどのように助けるのかは謎でした。
今回、研究グループは、クライオ電子顕微鏡法による立体構造解析と、決定した構造に基づくELMO1変異体の機能解析により、DOCK5により活性化される最中のRac1にELMO1が結合し、その活性化効率を高めていることを明らかにしました。ELMO1がRac1の活性化を助ける仕組みは、Racを選択的に活性化する他のDOCKファミリータンパク質にも共通すると考えられます。
本研究は、科学雑誌『Science Advances』オンライン版(7月21日付:日本時間7月22日)に掲載されます。
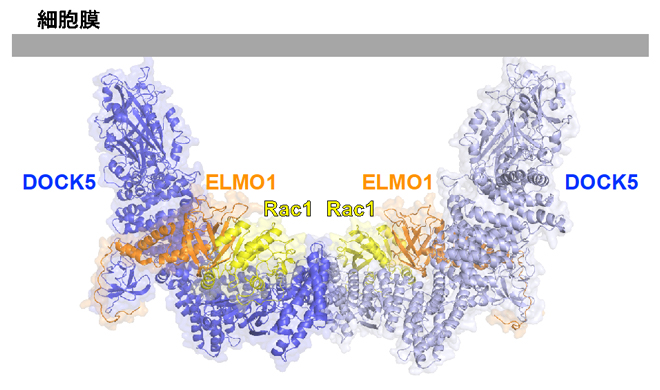
細胞膜に結合したときのELMO1-DOCK5-Rac1複合体の予想図
背景
DOCKタンパク質ファミリーは、酵母菌、線虫のような微小生物からヒトに至るまで進化的に保存された分子群で、細胞運動の調節に重要な役割を果たしています。DOCKタンパク質は、RacやCdc42[3]などのGタンパク質に結合したGDP(グアノシン二リン酸)をGTP(グアノシン三リン酸)に交換することによって、これらのGタンパク質を活性化します。活性化されたGタンパク質は細胞骨格であるアクチンタンパク質の重合を促進し、細胞の形態を変化させることで細胞の運動を制御します。Racは、がん細胞が運動方向に伸ばす膜突起の形成に関与することが知られています。
DOCKタンパク質には機能の異なる複数のドメインがあり、Racに結合したGDPをGTPに交換する反応を担うのは、「DOCKホモロジー領域2(DHR-2)」と呼ばれるドメインです。またこの反応には、別のドメインである「DHR-1」を介した細胞膜への結合が必須であると考えられています。DHR-1とDHR-2は、哺乳類のDOCKタンパク質ファミリー全てに共通するドメインです。
一方、DOCKタンパク質ファミリーのうち5種類(DOCK1~DOCK5)は、さらに三つ目のドメインとして「Srcホモロジー3(SH3)」を持ち、これにより結合パートナーであるELMOタンパク質と結合します。試験管内での実験から、DHR-2ドメインは単独でもGタンパク質を活性化できることが示されていますが、これらのDOCKタンパク質が細胞内で機能するためには、ELMOと結合することが不可欠です。つまり細胞の運動は、Rac、DOCK、ELMOの複雑な相互作用により制御されていると考えられ、この仕組みを解明すればがんの浸潤・転移を抑制する手法を発見できる可能性があります。しかし、これまでDOCKとELMOの部分的な構造は知られているものの全体の構造解析は困難で、これらのタンパク質結合による活性制御の仕組みはよく分かっていませんでした。
先行研究において、免疫応答を制御する鍵分子であるDOCK2とELMO1の結合領域を同定し、これらの領域を用いて、二つのタンパク質が複合体を形成して互いの自己抑制を解除する仕組みを解明しました注1)。今回、研究グループは、DOCK5によるRac1の活性化にELMO1がどのように関わるか観察することを試みました。
注1)2012年2月14日プレスリリース「免疫系細胞が刺激に応答し動く仕組みを原子レベルで解明」
研究手法と成果
研究グループはRac1を結合したときのELMO1-DOCK5複合体の構造を、クライオ電子顕微鏡を用いて観察しました。得られた高分解能の立体像を用いて、DHR-1、DHR-2、SH3の各ドメインの構造を解析し、さらに未知領域に対する三次構造予測計算を行うことで、最終的にC末端[6]領域を除くほぼ完全長のDOCK5(全長1,840アミノ酸残基のうち1,642アミノ酸残基)の構造をほぼ原子レベルの3.8オングストローム(Å、1Åは100億分の1メートル)の解像度で決定することに成功しました。
ELMO1-DOCK5-Rac1複合体は、主にα-ヘリックス[7]から作られる複雑な複合体を形成しており、二つの複合体が会合した二量体の構造になっていました(図1左)。この二量体はDOCK5のDHR-2ドメインを中心とする2回転対称構造をとり、両端に位置するDHR-1ドメインが同じ方向を向くことで、細胞膜に安定して結合できると考えられます(図1右)。
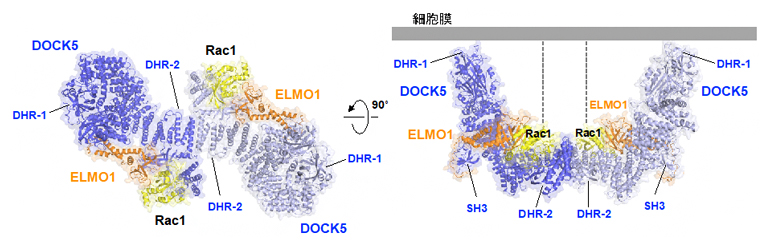
図1 細胞運動におけるELMO1-DOCK5複合体によるRac1の活性化
(左)クライオ電子顕微鏡で観察されたELMO1(橙)-DOCK5(青)-Rac1(黄)複合体の二量体構造。
(右)細胞膜に結合したときのELMO1-DOCK5-Rac1複合体の予想図。DOCK5はDHR-1ドメインを通じて細胞膜に結合する。膜に結合するRac1のC末端領域を点線で示している。
複合体構造におけるDOCK5、Rac1、ELMO1の結合様式を詳しく見ると、三者が向かい合う三つ巴(みつどもえ)のようになっていることが分かりました(図2A)。つまり、ELMO1のC末端領域(PHドメイン)はDOCK5のDHR-2ドメインと異なる方向からRac1に結合するとともに、DHR-2ドメインにも結合し、Rac1を活性化するDHR-2ドメインの構造を支えていました。これまでRac1とDHR-2ドメインの結合様式は知られていましたが、結合パートナーであるELMO1とRac1の直接の相互作用は今回初めて立証されました。一方、ELMO1のN末端[6]側は、今回解析した複合体では一定の安定した構造をとらないことも分かりました。
決定した構造に基づいてDOCK5の生化学的活性を調べたところ、DOCK5にELMO1のC末端領域を結合させると、Rac1活性化の速度がDOCK5単独と比較して大幅に上昇しました(約3倍)。そして、ELMO1-DOCK5複合体においてRac1との結合に関わるELMO1のC末端領域のPHドメインに二つの変異を導入すると、Rac1活性化の速度が30%低下することが分かりました(図2B)。これらの結果から、Rac1の活性化にはELMO1のC末端領域が重要であり、ELMO1がRac1との特異的な相互作用を通じて、DOCK5によるRac1活性化を調節していることが明らかになりました。
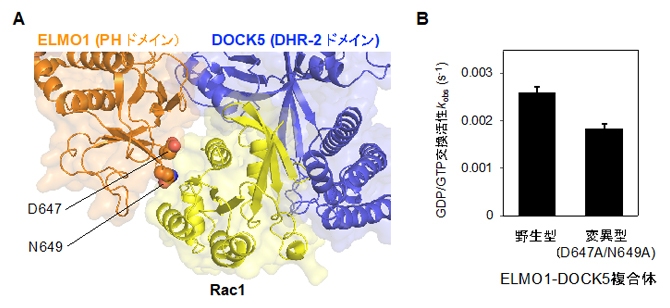
図2 DOCK5によるRac1の活性化を補助するELMO1のPHドメイン
(A)ELMO1はPHドメインとRac1との間の特異的な相互作用によって、DOCK5のDHR-2ドメインとRac1の結合を安定化している。
(B)ELMO1-DOCK5複合体のELMO1(PHドメイン)に2カ所の変異(D647とN649のアミノ酸残基をアラニンに置換)を導入すると、Rac1に対するGDP/GTP交換活性の低下が見られた。
今後の期待
DOCK5は、上皮細胞の浸潤・転移を促進し、がんの進行に関与することが知られています。また、DOCK5は、破骨細胞が骨吸収する際の骨への接着機能を制御しており、抗骨粗鬆症薬の開発ターゲットとしても期待されている分子です。本研究から、今後、DOCK5や他のDOCKファミリータンパク質のGタンパク質活性化を調節する仕組みの理解が進むことで、これらの病気に対する新しい治療薬の開発の道が拓けるものと期待できます。
補足説明
1.DOCK5
DOCKタンパク質はGDP結合型(不活性型)Racタンパク質からGDPを乖離させ、GTP結合型への変換を促進する機能を持つグアニンヌクレオチド交換因子の一種。機能・構造が類似したタンパク質ファミリーを構成し、哺乳類のDOCKファミリータンパク質には11種のDOCKタンパク質が含まれ、DOCK5はその一つ。DOCKはdedicator of cytokinesisの略。
2.ELMO1、ELMO
ELMOは複数のタンパク質に結合し、タンパク質複合体形成の「足場(スキャッフォルド)」となるタンパク質の一種で、ELMO1はその一つ。ELMOはengulfment and cell motilityの略。
3.Gタンパク質、Rac、Rac1、Cdc42
Gタンパク質は、グアニンヌクレオチド結合タンパク質の総称。グアノシン二リン酸(GDP)が結合している不活性型と、グアノシン三リン酸(GTP)が結合している活性型の間でタンパク質のコンフォメーションが変化し、分子スイッチとして働く。ヒト白血病細胞株から同定されたRacや酵母細胞で見つかったCdc42は、細胞の運動などを調節するシグナル伝達に関わっている。Rac1はRacの一つ。
4.クライオ電子顕微鏡法
タンパク質などの試料を液体エタン中で急速凍結して、薄い氷の層に閉じ込め、透過型電子顕微鏡を用いて観察する手法。画像処理により、観察された粒子の立体構造情報を得ることができる。
5.アクチン細胞骨格
細胞の運動を調節するために必要な繊維状の構造で、アクチンタンパク質が重合して形成される。がん細胞が浸潤する際に細胞膜に形成される突起構造の中心となる。
6.C末端、N末端
タンパク質はアミノ酸同士が脱水縮合して形成されたポリマーであり、隣接するアミノ酸は、それぞれのアミノ基とカルボキシ基がペプチド結合をしている。このポリマーの末端のフリーのアミノ基側をN末端、カルボキシ基側をC末端と呼ぶ。
7.α-ヘリックス
タンパク質の二次構造の一つ。ポリペプチド鎖が右巻きのらせん構造をとり、アミノ基とカルボキシ基の間の水素結合によって安定化されている。
研究グループ
理化学研究所 生命機能科学研究センター
タンパク質機能・構造研究チーム
チームリーダー 白水 美香子(しろうず みかこ)
上級研究員 新野 睦子(にいの むつこ)
技師 桂 一茂(かつら かずしげ)
研究員 横山 武司(よこやま たけし)
専門技術員 加茂 友美(かも ともみ)
技師(研究当時) 津曲 千恵美(つまがり ちえみ)
技師 池田 眞理子(いけだ まりこ)
技師 花田 和晴(はなだ かずはる)
創薬タンパク質解析基盤ユニット
テクニカルスタッフⅠ 米持 まゆ美(よねもち まゆみ)
転写制御構造生物学研究チーム
研究員 江原 晴彦(えはら はるひこ)
分子配列比較解析チーム
専門職研究員 中川 れい子(なかがわ れいこ)
構造バイオインフォマティクス研究チーム
チームリーダー ケム・ツァン(Kam Zhang)
研究員 ラフル・カウシク(Rahul Kaushik)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本学術振興会(JSPS)科学研究費補助金 基盤研究(C)「多様なドメイン連携によるRhoGEF制御機構の解明(研究代表者:柊元睦子)」、同基盤研究(C)「細胞運動を調節するタンパク質の構造的基盤の解明(研究代表者:柊元睦子)」、同基盤研究(B)「タンパク質の構造設計の計算方法の研究開発および実験検証(研究代表者:ZHANG KAM)」、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業 創薬等先端技術支援基盤プラットフォーム(BINDS)「統合的構造解析に向けた高難度複合体の生産支援と高度化(研究代表者:白水美香子)」、「クライオ電顕による細胞内ネイティブ複合体構造解析(研究代表者:吉川雅英)」による支援を受けて行われました。
原論文情報
Mutsuko Kukimoto-Niino, Kazushige Katsura, Rahul Kaushik, Haruhiko Ehara, Takeshi Yokoyama, Tomomi Uchikubo-Kamo, Reiko Nakagawa, Chiemi Mishima-Tsumagari, Mayumi Yonemochi, Mariko Ikeda, Kazuharu Hanada, Kam Y. J. Zhang, Mikako Shirouzu, “Cryo-EM structure of the human ELMO1-DOCK5 complex”, Science Advances, 10.1126/sciadv.abg3147
発表者
理化学研究所
生命機能科学研究センター タンパク質機能・構造研究チーム
チームリーダー 白水 美香子(しろうず みかこ)
上級研究員 新野 睦子(にいの むつこ)
報道担当
理化学研究所 広報室 報道担当
AMED事業について
日本医療研究開発機構(AMED)創薬事業部 医薬品研究開発課
創薬等ライフサイエンス研究支援基盤事業(BINDS)