2022-06-10 京都大学iPS細胞研究所
ポイント
- マイクロRNA (miRNA)注1)に応答する人工メッセンジャーRNA注2)(miRNA応答OFFスイッチ)と磁気ビーズによる細胞選別方法(Magnetic cell sorting;MACS法注3))を組み合わせ、簡便に短時間でかつ大量の高純度の心筋細胞を収集する技術(miRNAスイッチMACS法)を開発した。
- miRNAスイッチMACS法を用いてインスリン注4)産生細胞も収集することができた。
- miRNAスイッチMACS法による細胞の大量収集は、様々な細胞種への応用が可能と考えられ、細胞移植治療での移植細胞の供給方法などでの臨床応用が期待される。
1. 要旨
辻坂勇太 大学院生(CiRA増殖分化機構研究部門)、羽溪健 元研究員(元CiRA同部門)、齊藤博英 教授(CiRA未来生命科学開拓部門)、吉田善紀 准教授(CiRA増殖分化機構研究部門)らの研究グループは、人工mRNAを用いた細胞選別方法と磁気ビーズを用いた細胞選別方法を組み合わせることで、数億個単位の大量の心筋細胞を、短時間かつ高い純度(97%以上)で純化・収集することに成功しました。
研究グループではこれまでに、細胞種特有の小さなRNA(マイクロRNA;miRNA)に応答して、人工メッセンジャーRNA (mRNA)からのタンパク質の発現を抑制させる技術(miRNA応答OFFスイッチ)を開発しました(CiRAプレスリリース2015年5月22日「マイクロRNAをつかった細胞の選別方法の開発〜高純度な心筋細胞の作製に成功〜」)。この技術は、miRNA応答OFFスイッチを細胞へ導入することで、心筋細胞をはじめとした特異的な細胞表面抗原注5)が同定されていない細胞の選別を可能にしてきました。また、ゲノムを傷つける心配がなく、細胞内へ導入されたmiRNA応答OFFスイッチの寿命も短いため、安全性が高い手法です。
本研究では、このmiRNA応答OFFスイッチと磁気ビーズを用いて細胞を選別する方法(MACS法)とを組み合わせることで、数億個単位の大量の心筋細胞を、短時間かつ高い純度(97%以上)で純化・収集することに成功しました(miRNAスイッチMACS法)。また、miRNAスイッチMACS法を用いて収集した心筋細胞を心筋梗塞モデルマウスに移植したところ、移植細胞の良好な生着と心機能の回復が確認されました。
さらに、本研究ではmiRNAスイッチMACS法を用いてインスリン産生細胞の純化・収集にも成功しました。このように本手法は様々な細胞種への応用が可能と考えらえれ、心筋細胞だけではなく、高度に純化された目的細胞を短時間かつ大量に供給可能であり、細胞移植治療での移植用細胞の供給への応用が期待できます。
この研究成果は2022年6月10日(日本時間)に「Stem Cell Reports」でオンライン公開されました。
2. 研究の背景
心不全は心筋梗塞や心筋症を背景として生じ、心臓のポンプ機能の低下によって血液循環が悪化する病気で、薬剤が効かない心不全に対する最終的な治療法は現状では心移植しかありません。心不全患者は増加の一途をたどっており、心不全を中心とした心疾患への心筋細胞移植治療として、心移植に代わる数々の治療法研究が進められてきました。また、iPS細胞から分化誘導した心筋細胞を移植する心筋細胞移植治療の実用化が期待されています。
しかし、臨床応用に向けては1億~10億個程度の大量の心筋細胞が必要です。また、未分化な細胞など非心筋細胞の混入は、癌化や予期せぬ合併症を伴う恐れがあり、高度な純化も求められます。細胞の選別や純化にはフローサイトメーター注6)を用いるのが一般的です。しかし、移植に必要な1億個以上の細胞をフローサイトメーターで収集することは、数日単位での機器の稼働が必要であり、費用もかかることから非現実的です。また、心筋細胞は、特異的な細胞表面抗原が同定されていないため、フローサイトメーターによる選別では純化率にも問題があり、非心筋細胞の混入の恐れがありました。
本研究では、数億個単位の大量の細胞を、短時間かつ高い純度で純化・収集する方法(miRNAスイッチMACS法)を開発すべく研究を進めました。
3. 研究結果
1)miRNAスイッチMACS法による心筋細胞の抽出
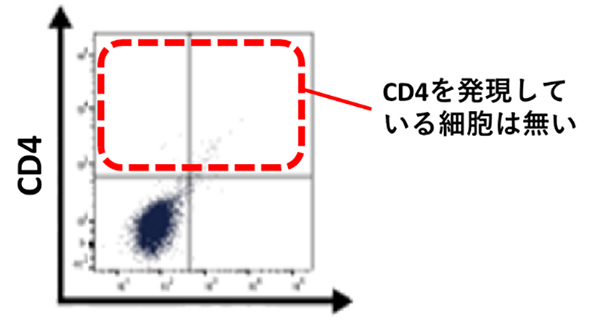
まず、iPS細胞から分化誘導した心筋細胞(以下、心筋細胞)を含む細胞集団に細胞表面抗原の一種であるCD4の発現が無いことを確認しました(図1)。
次に、心筋に特異的に存在するmiRNAであるmiRNA-208aに応答するmiRNA応答OFFスイッチにCD4の遺伝子を組み込み、心筋細胞を含む細胞集団に導入しました。同時に、抗菌薬(ピューロマイシン注7))耐性遺伝子(Puromycin N-acetyltransferase; PAC)のmRNAも同時に導入しました。
心筋細胞に導入されたmiRNA応答OFFスイッチは心筋細胞内のmiRNA-208aと反応するため、CD4のmRNAの翻訳がされず(オフ)CD4は発現しません。それに対して、非心筋細胞ではmiRNA応答OFFスイッチが反応しないため、mRNAが翻訳されCD4が発現します。この状態で、CD4と結合する磁気ビーズを加え、MACS法を用いると、磁気による吸着でCD4を発現している細胞(=非心筋細胞)が効率的に除去されます。
また、mRNA応答OFFスイッチの導入がされなかった細胞は、CD4が発現していないためMACS法では除去できません。これらを除去するために、抗菌薬耐性遺伝子のmRNAをmiRNA応答OFFスイッチと一緒に導入し、MACS法による細胞選別後に抗菌薬を加えました。miRNA応答OFFスイッチやmRNAの導入ができていない細胞は抗菌薬耐性が発現しないため、抗菌薬の投与によって除去されます。一方で、導入されている細胞は抗菌薬に耐性を獲得するため、抗菌薬投与で除去されることはありません。このように、MACS法、そして抗菌薬の投与を行い、最終的には97%以上という極めて高純度の心筋細胞の収集に成功しました(図2,3)。
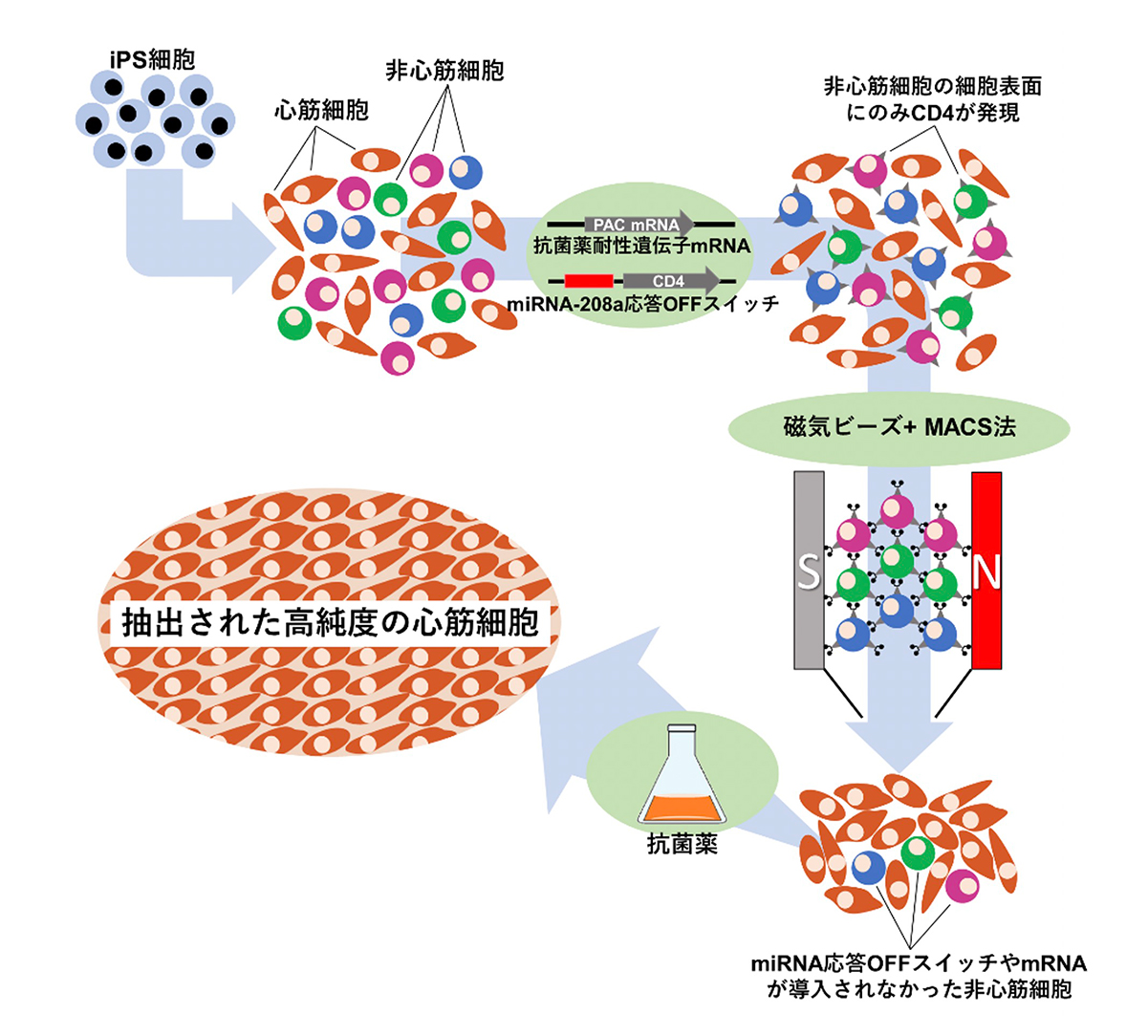
(図2)miRNAスイッチMACS法を用いた心筋細胞抽出の模式図
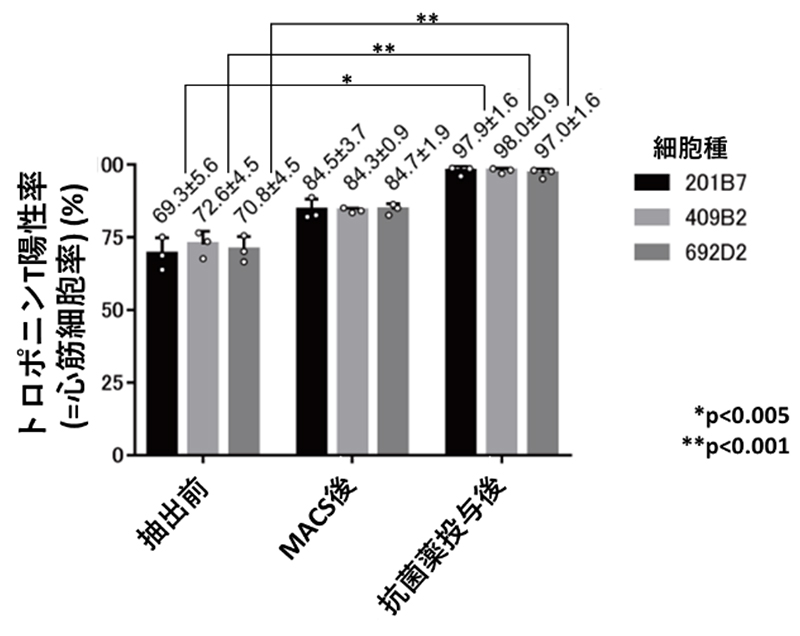
(図3) MACS法と抗菌薬投与で、97%以上の高純度の心筋細胞の抽出に成功した
心筋細胞のマーカーであるトロポニンTが陽性の細胞の割合は、MACS法と抗菌薬投与後に、97%以上に増加しました。このmiRNAスイッチMACS法による高純度の抽出が行えることは、複数種のiPS細胞(201B7, 409B2, 692D2)で確認できました。
2)miRNAスイッチMACS法と従来法の比較
これまでに同研究グループでは、miRNA応答スイッチにアポトーシス注8)を引き起こす遺伝子であるBimを組み込むことでフローサイトメーターを用いずに心筋細胞を抽出する方法(miRNA-Bimスイッチ法)を報告していました(CiRAプレスリリース2015年5月22日)。この従来法と、今回の新たなmiRNAスイッチMACS法を比較したところ、miRNAスイッチMACS法がより高純度の心筋細胞を抽出できることが分かりました(図4)。
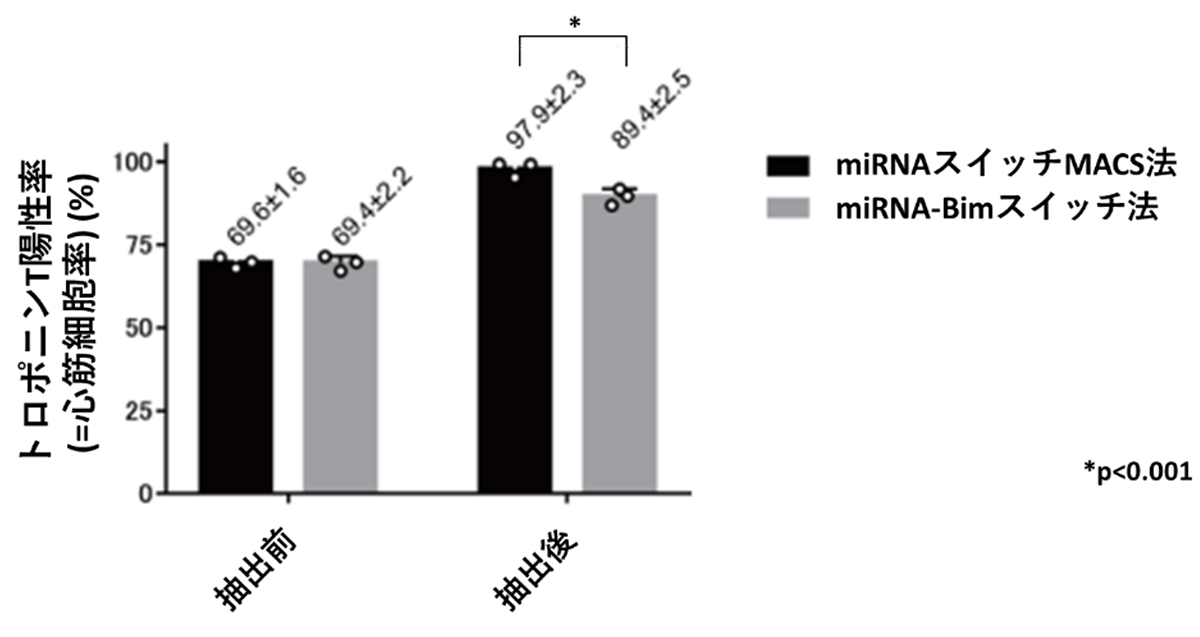
(図4) miRNAスイッチMACS法と従来法(miRNA-Bimスイッチ法)の比較
また、miRNAスイッチMACS法によって収集できる細胞数や作業時間を、従来のフローサイトメーターを用いた方法と比較しました。フローサイトメーターを使用してmiRNA-208a応答OFFスイッチに反応した心筋細胞を抽出した場合は約30分で、miRNAスイッチMACS法の約150分の1にあたる約120万個程度の心筋細胞が収集できました。一方で、miRNAスイッチMACS法を用いると、同程度の作業時間(MACS実施にかかる時間注9))で、フローサイトメーターの150倍にあたる、約1.8億個を抽出することができました。
以上のことから、miRNAスイッチMACS法は細胞移植治療に必要な十分量の心筋細胞を、極めて高純度にかつ短時間で収集することが可能であることが分かりました。
3) 収集した心筋細胞のマウス心臓への移植
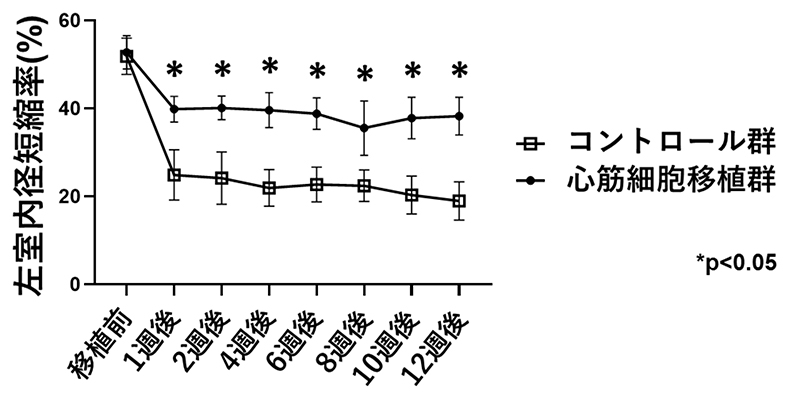
心筋梗塞モデルの免疫抑制マウスの心臓へ、miRNAスイッチMACS法を用いて収集した心筋細胞を移植したところ、良好な生着(図5A)と、心機能の改善(図5B)が確認できました。
(図 5A)
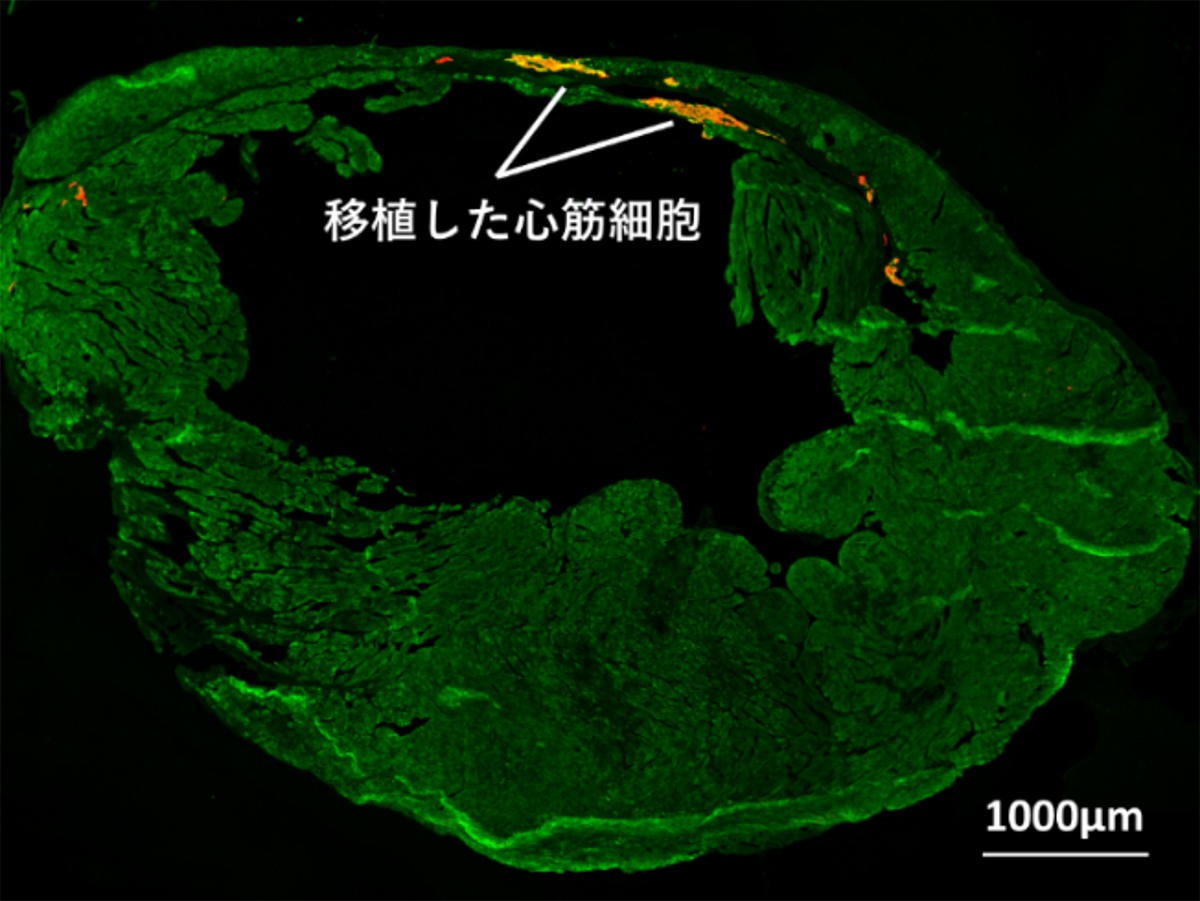
(図 5B)
4) miRNAスイッチMACS法を用いて選別できる細胞種
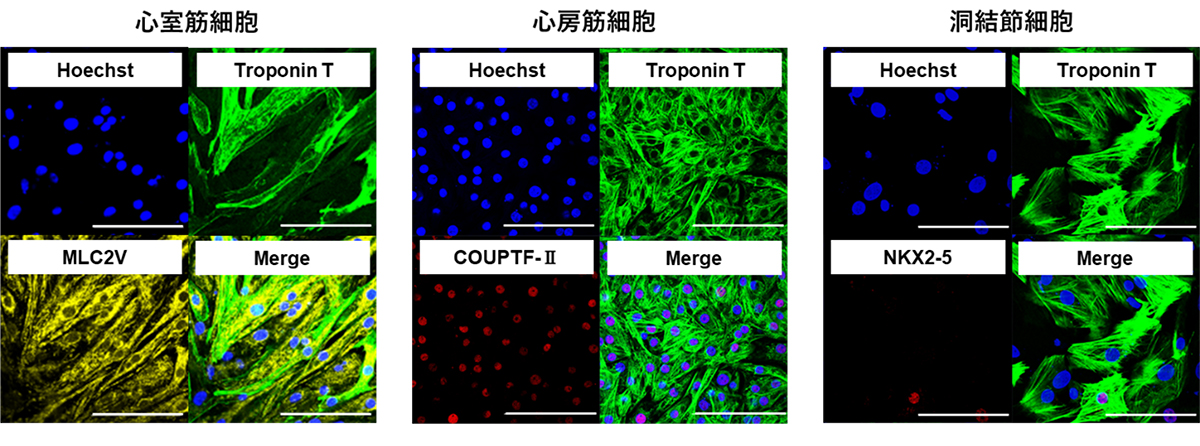
3種類の心筋細胞(心室筋細胞、心房筋細胞、洞結節細胞)それぞれに分化誘導させた細胞集団に対して、miRNA-208a応答OFFスイッチを使用したところ、miRNA-208a応答OFFスイッチは3種類すべての心筋細胞に対して反応し、収集できることが分かりました(図6A,B)。
(図 6A)
(図 6B)
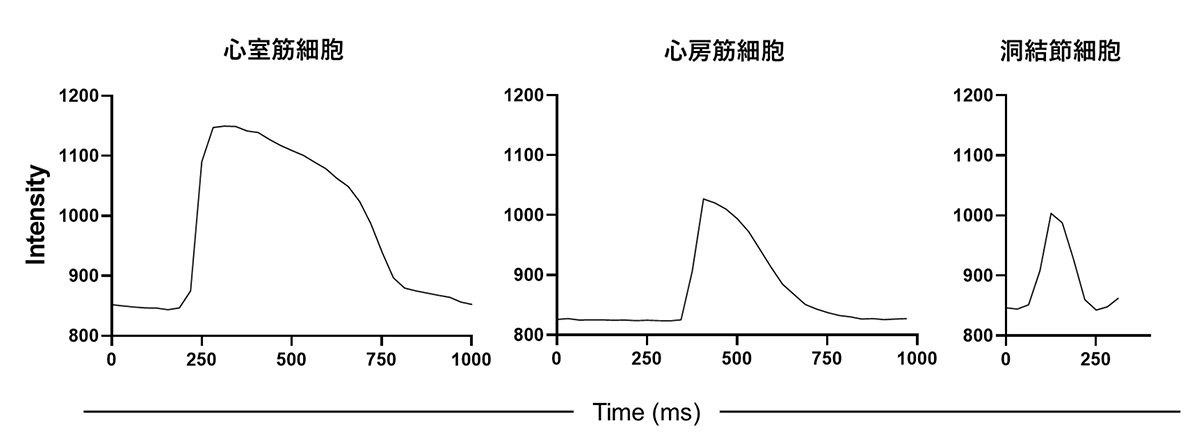
(図6) miRNA-208a応答OFFスイッチを用いて収集した心筋細胞
(A) それぞれの細胞種に特徴的な免疫染色が観察された(心室;MLC2V陽性、
心房;COUPTF-Ⅱ陽性、洞結節;NKX2-5陰性)(bar; 100µm)
(B) それぞれの細胞種に特徴的な活動電位が記録された
さらに、インスリン産生細胞に特異的に発現するmiRNA-375を用いて、miRNAスイッチMACS法を使用すると、インスリン産生細胞も効率的に収集できることがわかりました(図7)。
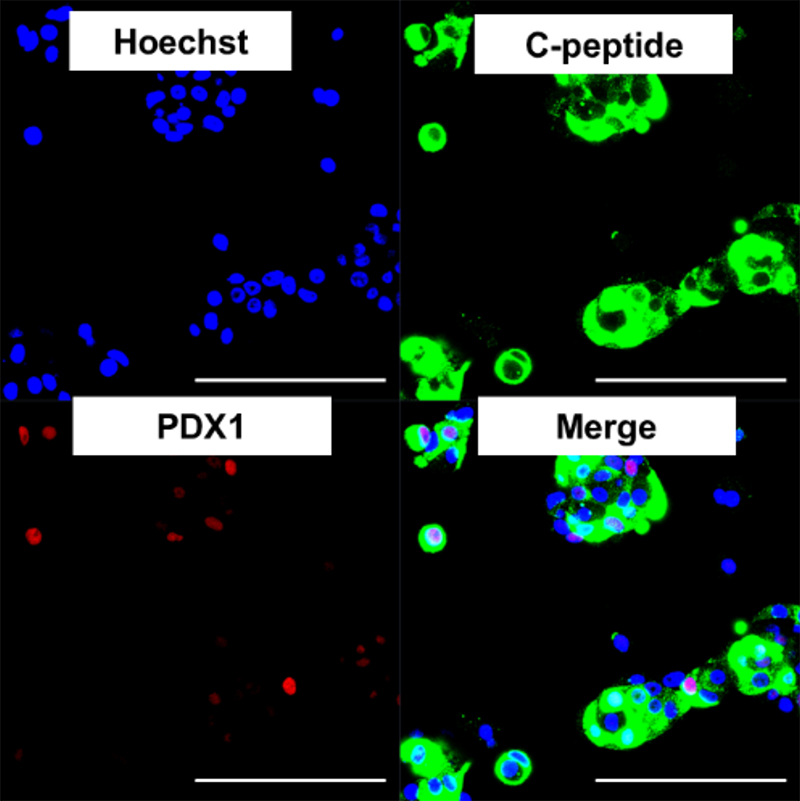
(図7) miRNA-375スイッチMACS法で収集したCペプチド陽性のインスリン産生細胞。
一部で膵β細胞のマーカーであるPDX1も発現を認める。 (bar; 100µm)
4. 本研究の意義と今後の展望
iPS細胞から分化誘導した心筋細胞を短時間でかつ高純度に、細胞移植治療にも十分な量を収集できる新手法を開発しました。また、本手法は心筋細胞だけでなく、インスリン産生細胞にも適応可能であり、その他の細胞種への応用も可能と考えられ、細胞移植治療を中心とした臨床応用が期待されます。
5. 論文名と著者
- 論文名
Purification of human iPSC-derived cells at large scale using microRNA switch and magnetic-activated cell sorting - ジャーナル名
Stem Cell Reports - 著者
Yuta Tsujisaka1,2*, Takeshi Hatani1,2*, Chikako Okubo1, Ryo Ito1, Azuma Kimura1, Megumi Narita1, Kazuhisa Chonabayashi1,3, Shunsuke Funakoshi1,4, Antonio Lucena-Cacace1, Taro Toyoda1,
Kenji Osafune1, Takeshi Kimura2, Hirohide Saito1**, and Yoshinori Yoshida1,4**
*:共同筆頭著者 **:共同責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学医学部医学研究科循環器内科学
- 京都大学医学部医学研究科血液内科学
- タケダ-CiRA共同研究プログラム(T-CiRA)
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム
「iPS細胞研究中核拠点」「拠点I」「拠点III」 - 日本医療研究開発機構(AMED)医薬品等規制調和・評価研究事業
- 日本医療研究開発機構(AMED)再生医療実用化研究事業
- 日本学術振興会 科研費 (JP15H05722)(JP17H04176)(JP21H02912)「特別推進研究」(JP20H05626)
- Leducq財団 (18CV05)
- 公益財団法人 セコム科学技術振興財団
- iPS細胞研究基金
7. 用語説明
注1)マイクロRNA(miRNA)
20〜25塩基程度の長さの短いノンコーディング(アミノ酸配列を指定する役割を持たない)RNA。相補的な配列を持つmRNAに結合してタンパク質への翻訳を抑制したり、mRNAを分解したりすることで、その遺伝子の発現を抑制する働きをもつと考えられている。
注2)メッセンジャーRNA(mRNA、伝令RNA)
細胞内でタンパク質が合成される際にアミノ酸配列を指定する役割を持つ。DNA上の遺伝子情報はメッセンジャーRNAに転写された後メッセンジャーRNAからタンパク質へと翻訳され、細胞内で機能する。
注3)MACS法(Magnetic cell sorting法)
特定の細胞表面抗原に結合する抗体に、磁気ビーズを結合させた特殊な抗体を用いて、細胞を選別、収集する方法。この抗体が結合した細胞は、磁石が吸着するため、抗原の有無で細胞を選別することが可能となる。短時間で大量の細胞を収集できる。
注4)インスリン
血液中の糖を取り込ませるように細胞に働きかけ、血糖値を下げる効果があるホルモン。膵臓の中でも膵島と呼ばれる部分にある内分泌細胞であるβ細胞で作られ、放出される。
注5)細胞表面抗原
細胞の表面に存在するタンパクで、特にその細胞に特異的な抗原性を示すもの。
注6)フローサイトメーター
水流の中に細胞を流し、細胞一つ一つに対してレーザー光を照射することで、細胞の大きさや蛍光を観察することができ、また、それらに応じて目的細胞を選別し、収集することができる機器。
注7)ピューロマイシン
抗生物質の一つ。翻訳のプロセスを阻害することでタンパク質合成を阻害する。
注8)アポトーシス
細胞死の一種で、プログラムされた細胞死。いわゆる「細胞の自殺」。
注9)MACS実施にかかる時間
MACSによる細胞選別の約30分の作業時間の後、48時間の抗菌薬投与後に心筋細胞を収集します。