2023-08-08 東京大学,奈良県立医科大学
発表のポイント
- 既存の血栓症治療薬を上回る薬効と、相補鎖DNAなどの添加により薬効中和が可能な高い安全性を兼ね備えた天然型核酸アプタマーの開発に成功しました。
- DNAアプタマー史上最高の抗血液凝固活性をもつ”M08s-1″に二重特異性を導入することで、薬理活性が約10倍向上、または血中半減期が約5倍向上するバイスペシフィックアプタマーを獲得しました。
- 血液凝固因子を標的とする治療薬開発において、二重特異性を導入することで、血液中における天然型DNAアプタマーの大幅な機能向上が可能であることを実証しました。
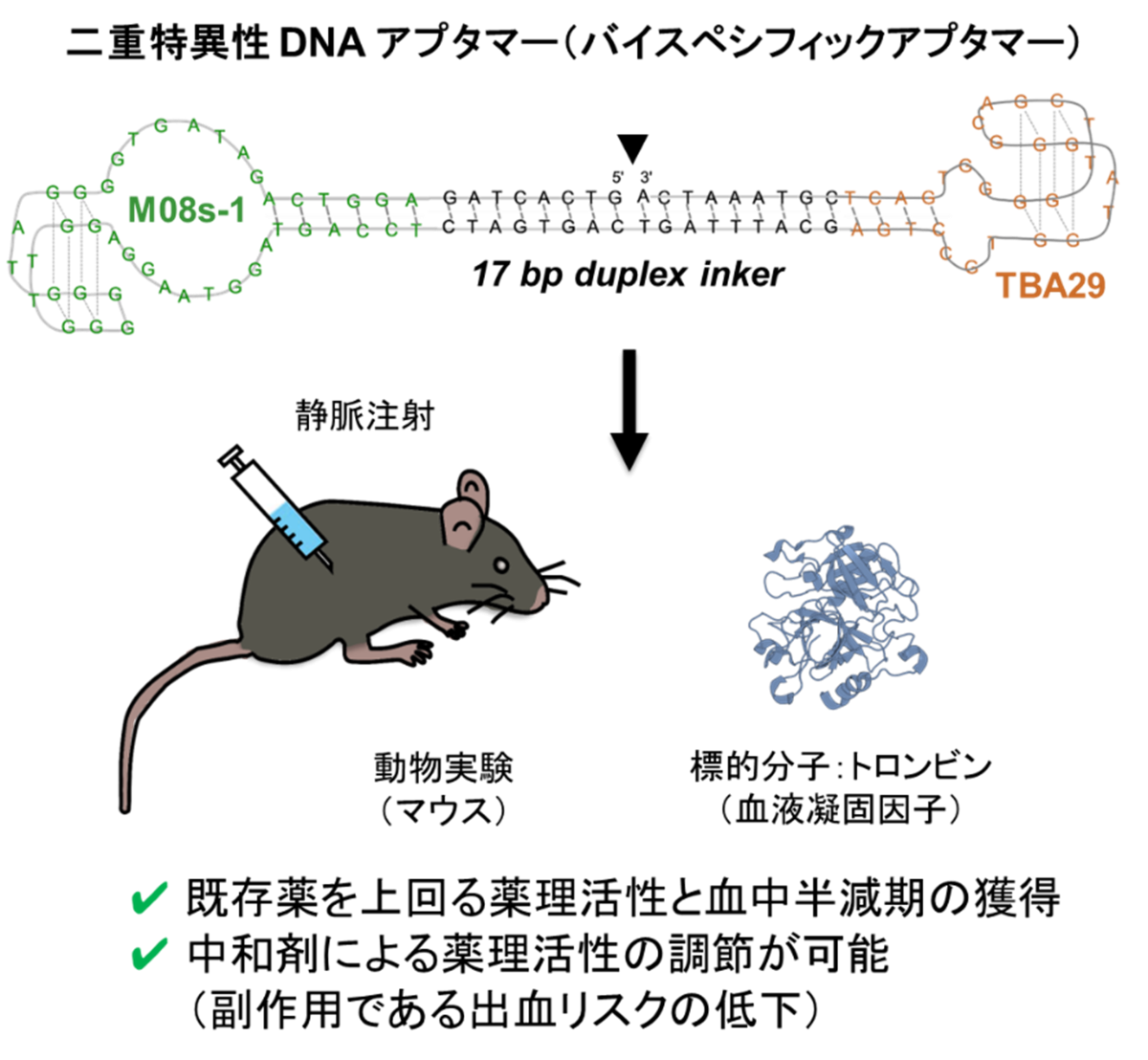
本研究で開発した二重特異性DNAアプタマーの構造と動物実験で得られた成果の概要
発表内容
東京大学大学院総合文化研究科の吉本敬太郎准教授と、奈良県立医科大学血栓止血医薬生物学共同研究講座の坂田飛鳥特任助教らによる研究グループは、血栓症の既存低分子治療薬の薬効を大幅に上回り、相補鎖DNAなどの添加により薬効中和が可能な核酸アプタマー(注1)の開発に成功しました。具体的には、DNAアプタマー史上最高の抗血液凝固活性をもつ”M08s-1″を二重特異性(注2)アプタマー(以後、バイスペシフィックアプタマー)とすることで、M08s-1および既存低分子薬を上回る薬理活性と血中半減期をもつ新規DNAアプタマーを作製しました。このバイスペシフックアプタマーの薬理活性は相補鎖や硫酸プロタミンを用いて停止(中和)・調節することができるため、抗凝固薬利用時に懸念される出血リスク(注3)を低減することができる、安全性の高い新規血栓症予防・治療薬として期待できます。
〈研究の背景〉
血液凝固反応が血管内で暴走すると血栓症のリスクが高まります。図1は、血液凝固因子の1つであるトロンビンが、基質であるフィブリノーゲンと反応して血液凝固を起こすまでの反応経路です。血栓症は、同経路が暴走して血管内で血液凝固が起こる疾患で、発生した血栓が血流を停止することで重篤な症状を引き起こします。血栓症の予防や治療時に用いられる薬剤は抗凝固薬と呼ばれ、生体内の血液凝固因子に結合して血液凝固を抑制します。トロンビンに結合し、トロンビンとフィブリノーゲン間のタンパク質-タンパク質相互作用を阻害する分子は、血液凝固を抑制する分子標的薬として大きなポテンシャルをもちます。
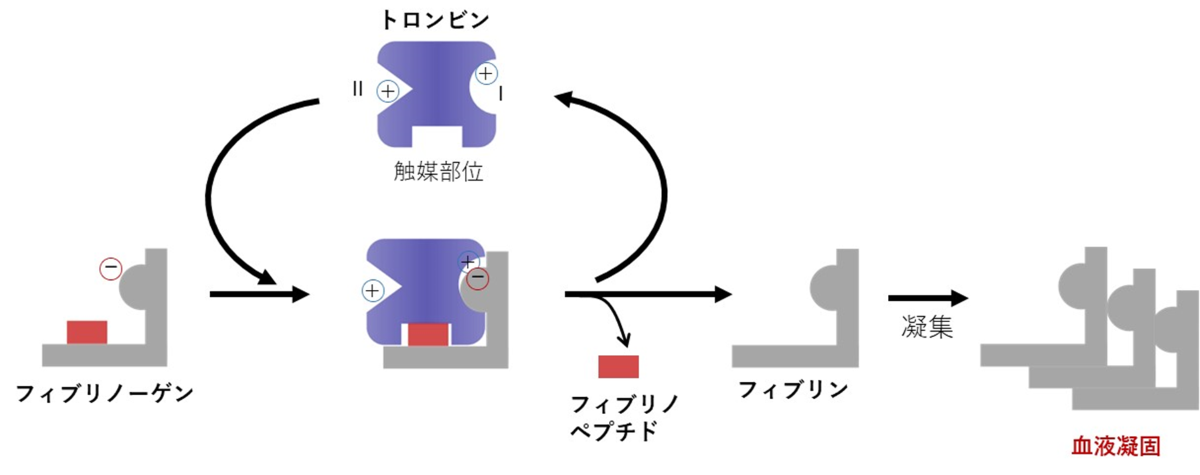
図1:トロンビンとフィブリノーゲンの結合がもたらす血液凝固反応の概略図
トロンビンには、カチオン性アミノ酸残基が集中したエキソサイトIとエキソサイトIIの2つの領域が存在します。基質であるフィブリノーゲンはトロンビンに対して触媒部位とエキソサイトIの2箇所で結合し、限定分解を受けた後にフィブリノペプチドとフィブリンが遊離します。遊離したフィブリンは自己凝集し、フィブリンポリマーを形成することで血液凝固を誘起します。フィブリノーゲンとトロンビンの複合体形成を阻害することで、血液凝固の抑制が可能となります。
ヘパリン誘発性血小板減少症(HIT)は、抗凝固剤の一種であるヘパリンの投与によって引き起こされる血栓症治療時における合併症で、血小板減少とともに血栓塞栓症を引き起こす疾患です。最近の新型コロナウイルス感染症のパンデミックにより、ヘパリンの使用量が増加したためにHIT患者の数が増加しました。残念ながら、現在使用されているアルガトロバンという低分子型トロンビン阻害剤(図2)は、副作用として発生する重度の出血を停止するための中和剤がないこと、さらに胎盤通過性があるために妊婦に対する使用が推奨されていないなど、安全性の面で課題を残しています。
図2:アルガトロバンの分子構造
HIT治療薬として利用されている低分子型薬剤だが、薬効を即座に無効化する中和剤がなく、さらに動物実験で胎盤通過性や乳汁移行が確認されている。
このような背景のもと本研究グループは、血栓症予防・治療薬として利用できる安全性の高い核酸アプタマーの開発研究に取り組みました。中分子型分子標的薬の一つである核酸アプタマーは、分子認識能をもつ一本鎖核酸であり、①製造コストが安価、②輸送・保管時の低温管理が不用、③相補鎖で薬効の停止(中和)が可能、さらに④複数のアプタマーの連結(二重特異性化)が容易、などの特長をもちます。特に③は、抗凝固薬利用時に懸念される出血リスクを低減することができる核酸アプタマー特有のもので、安全性の高い血栓症治療の開発に繋がります。さらに、中分子薬である核酸は胎盤通過性が極めて低いことが知られています。
血液凝固因子であるトロンビンに結合するDNAアプタマーは、1992年に初めてHD1と呼ばれる15の塩基配列からなるトロンビン結合性DNAアプタマー(TBA15)が SELEX 法(注4)で発見されて以降、様々な配列のアプタマーが獲得・報告されています。なかでも、吉本准教授らの研究グループは、2019年当時、独自に開発したMACE®-SELEX法(注5)を用いてトロンビンに対する10個のDNAアプタマー群”Mシリーズ”の獲得に成功し、Mシリーズの中から、DNAアプタマー史上最高の抗凝固作用を示すM08とその短鎖化配列 M08s-1を発見しています(関連URL参照)。
本研究成果では、上述した核酸アプタマーの特長④「複数のアプタマーの連結(二重特異性化)が容易」を活用することで、M08s-1ベースのバイスペシフィックアプタマーを考案し、既報のトロンビン結合性アプタマーや現行のHIT治療薬よりも高い薬理活性と安全性を兼ね備えた新規HIT治療用薬剤の可能性を示しました。核酸アプタマーの高機能化の常套手段として化学修飾や人工核酸を導入などがありますが、二重特異性を導入することで、血液中における天然型DNAアプタマーの大幅な機能向上が可能であることを実証しました。
〈研究の内容〉
アンチトロンビンアプタマーの二量体は既に幾つか報告されていますが、トロンビンのエキソサイトIに結合する抗凝固活性の低いTBA15と、エキソサイトIIに結合するTBA29を、柔軟な一本鎖DNAで連結されたもの、または剛直な二本鎖型DNAで連結されたものがほとんどでした。この知見に基づき、本研究では、図3に示すM08s-1を含む4種類のバイスペシフィックアプタマーをリンカー種(2つのアプタマーを繋ぐ一本鎖核酸または二本鎖核酸)やアプタマーの組み合わせを変えて新規に設計・作製し、評価を行いました。
まず、トロンビンに対する結合親和性を評価したところ、ヒトトロンビン、およびマウストロンビンに対する結合親和性は、4種類すべてが単量体アプタマーM08s-1よりも約100倍向上することが明らかとなりました。
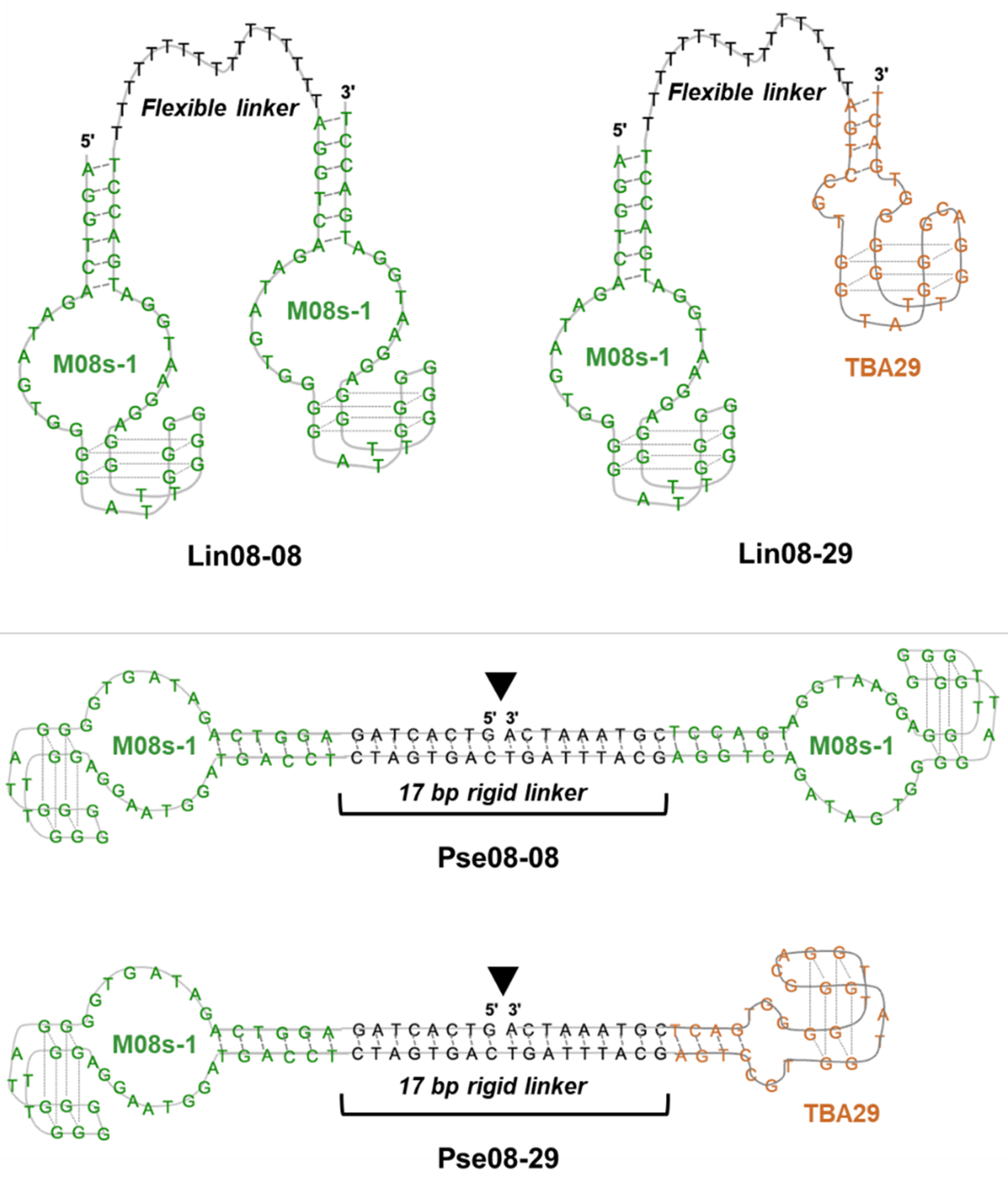
図3:本研究で新たに設計した M08s-1を含むバイスペシフィックアプタマー
トロンビン結合性アプタマーであるM08s-1とTBA29を使用して一本鎖DNAをリンカーとして連結した Lin 体(上)と二本鎖DNAをリンカーとして連結したPse体(下)のホモ・ヘテロのバイスペシフィックアプタマーの推定構造。全て一本鎖DNAからなり、Pse体の▼は末端部位であることを示している。
次に、動物実験前の予備検討として、マウス血漿に異なる濃度のアプタマーを添加した試料を用いて行った抗凝固活性試験では、現在 HIT 治療に使用されている薬剤アルガトロバンよりも単量体 M08s-1 が高い抗凝固活性を有すること、さらに設計した4種類のバイスペシフィックアプタマー全てがM08s-1 よりもさらに約10倍高い抗凝固活性を有することが明らかとなりました(図4)。アルガトロバンの抗凝固活性はaPTT値で75~80程度が限界に達していますが、全ての核酸アプタマーはこれを大きく凌駕する抗凝固活性を示していることから、核酸アプタマーの抗凝固薬としてのポテンシャルが極めて高いことがわかります。
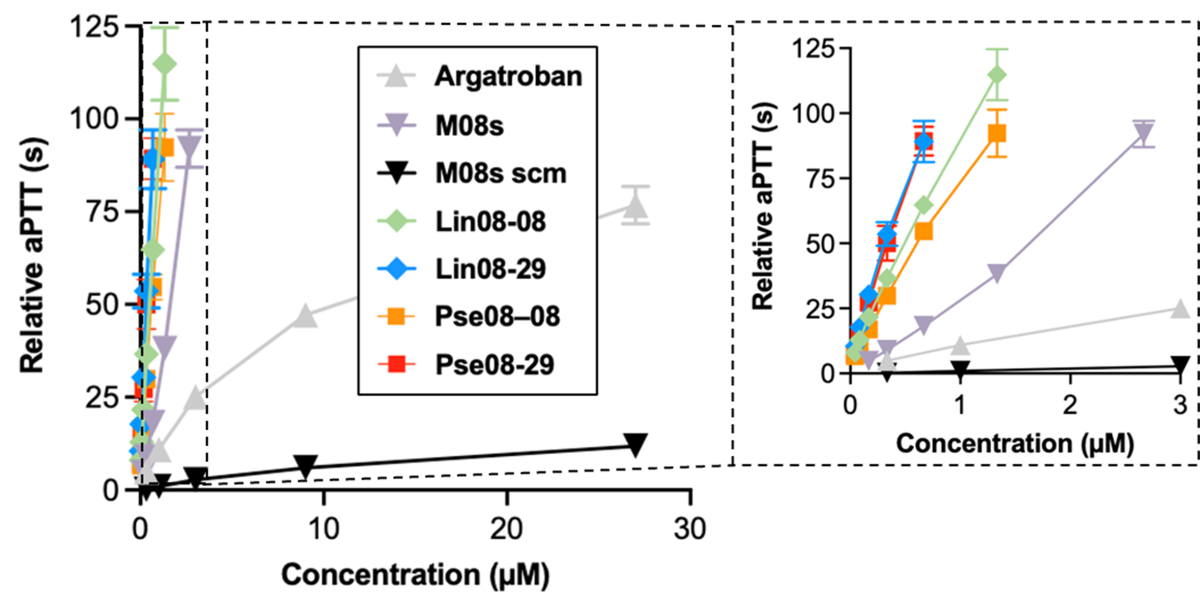
図4:各分子の抗凝固活性(aPTT値)と濃度依存性
マウス血漿を用いてin vitro aPTT値の測定を行った結果。現行薬であるアルガトロバンの抗凝固活性は75-80程度のaPTT値で限界に達しているが、バイスペシフィックアプタマーのLin体とPse体は極めて高い抗凝固活性を示すことがわかる。M08s scmは、M08sの核酸塩基の並びを意図的に変えて作製したコントロール配列であるため活性がない。
マウスを用いて行った動物実験の結果を図5に示します。HITの承認薬アルガトロバン、単量体アプタマー、バイスペシフィックアプタマーを等モル量マウスに静脈投与した後に回収した血漿を用いて抗凝固活性を比較したところ、バイスペシフィックアプタマーがアルガトロバンや既報の臨床候補アプタマーであるNU172の抗凝固活性を大幅に上回っていること、なかでもLin08-08とPse08-29はM08s-1の7倍から10倍高い活性をマウスの体内で発現していることが明らかとなりました(図5A)。興味深いのは、2つの単量体アプタマーNU172および M08s-1は、3分後の分布段階で血中濃度が急速に減少していますが、二量体では急速な減少は観測されていない点です(図5B)。最も高い抗凝固活性を示したのはPse08-29ですが、最も長い血中半減期を示したのは Lin08-08で、単量体アプタマーの血中半減期のおよそ5倍の値を示した点は特筆に値します(図5C)。Pse08-29 が他の3つのバイスペシフィックアプタマーよりも強力な抗凝固活性をマウス生体内で示す詳細なメカニズムは今のところ不明ですが、独自に発見したM08s-1を利用している事、二量体化によって大きく向上した標的分子に対する結合親和性が関与している可能性は高いです。
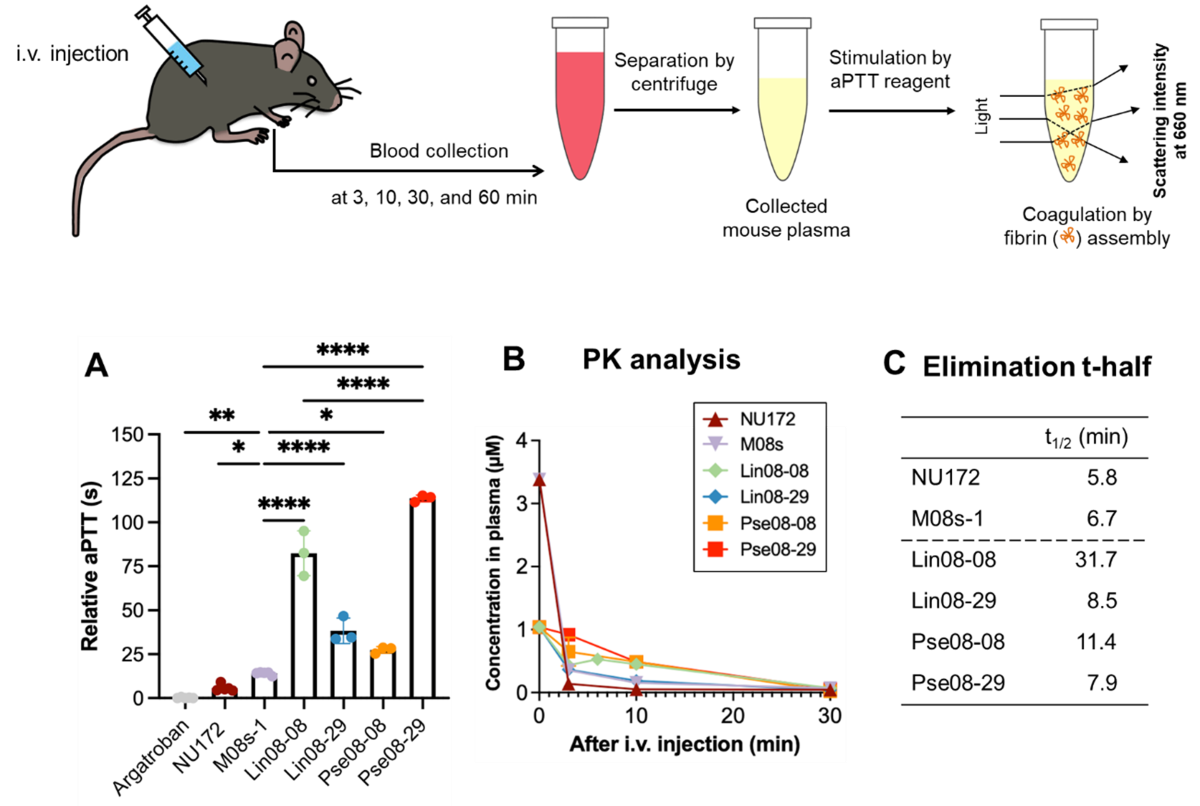
図5:マウスを用いる動物実験の概略図(上)と抗凝固活性評価の結果(下)
(A) 各分子を等モル量添加した際の抗凝固活性値の比較、(B)静脈注射後の各分子の血中濃度の変化、(C) 各分子の血中半減期。Pse08-29が最も高い抗凝固活性を示し、Pse08-08が最も長い血中半減期を示した。
HITの治療に使用されるアルガトロバンとビバリルジンには中和剤がなく、治療時の出血リスクが高まります。一方、核酸アプタマーは相補鎖の添加で高次構造を強制的に二重鎖に変化させることが可能となるため、相補鎖が薬効を停止させる中和剤として利用できます。
図6Aの紫色で示した短い相補鎖配列 [M08s G2]cを用いて、ヒト血漿中における中和剤としての機能評価を行ったところ、抗凝固効果を完全に中和することはできませんでしたが、目標であるaPTT値を30以下まで低下させることに成功しました(図6B)。さらに、既に臨床的に承認されている硫酸プロタミンを使用することで、Pse08-29の高い抗凝固活性をほぼ完全に抑制できることも明らかにしました(図6C)。
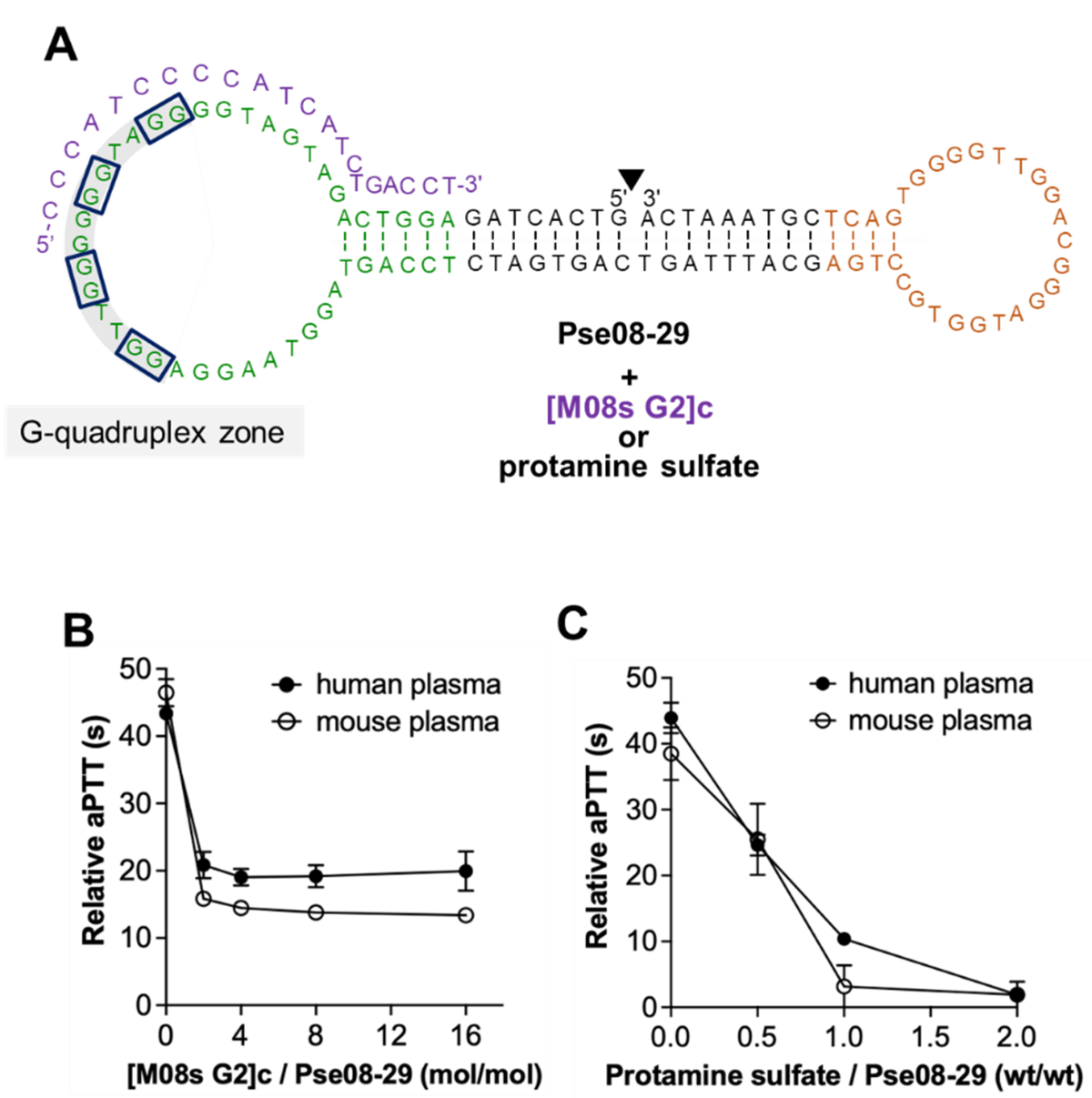
図6: Pse08-29に対する中和配列 [M08s G2]c の相補鎖形成の概略図(上)と中和効果(下)
(B) [M08s G2]s による中和効果、(C) 硫酸プロタミンによる中和効果。硫酸プロタミンを使用することで、抗凝固作用をほぼゼロまで抑えることが可能。
〈今後の展望〉
本研究では、既存の血栓症治療薬の薬効を大幅に上回り、相補鎖DNAなどの添加により薬効中和が可能な天然型の二重特異性DNAアプタマー(バイスペシフィックアプタマー)の開発に成功しました。今回得られた研究成果は、安全性の高いHIT治療や血栓症治療薬の開発に寄与するとともに、血液凝固因子を標的とする天然型核酸アプタマー治療薬の開発において、化学修飾や人工核酸を導入しないユニークな分子設計指針を提供します。
〈関連のURL〉
「東京大学 PRESS RELEASES:核酸アプタマー史上最高の抗血液凝固活性の要因解明 ――MACE®-SELEX法で獲得したDNAアプタマーの”分子内屈曲構造”の重要性――」(2023/8/1)
https://www.u-tokyo.ac.jp/focus/ja/press/z0109_00089.html
「東京大学大学院総合文化研究科:バイスペシフィックアプタマーを用いる抗体に依存しない抗がん剤検出法の開発」(2023/01/23)
https://www.c.u-tokyo.ac.jp/info/news/topics/20230123000000.html
「教養学部報645号:核酸アプタマーと事業化」(2023/5/8)
https://www.c.u-tokyo.ac.jp/info/about/booklet-gazette/bulletin/645/open/645-7-02.html
発表者
東京大学 大学院総合文化研究科
吉本 敬太郎(准教授)
長野 正展(研究当時:特任助教)<現:田辺三菱製薬 研究員>
窪田 和貴(研究当時:修士課程)
中村 玲(研究当時:修士課程)
吉冨 徹(研究当時:助教)<現:物質・材料研究機構 主任研究員>
和久井 幸二(学術専門職員)
奈良県立医科大学 血栓止血医薬生物学共同研究講座
坂田 飛鳥(特任助教)
論文情報
雑誌:Molecular Therapy – Nucleic Acids
題名:A neutralizable dimeric anti-thrombin aptamer with potent anticoagulant activity in mice
著者:Masanobu Nagano, Kazuki Kubota, Asuka Sakata, Rei Nakamura, Toru Yoshitomi, Koji Wakui, Keitaro Yoshimoto*
DOI:10.1016/j.omtn.2023.07.038
研究助成
本研究は、厚生労働省・国立研究開発法人日本医療研究開発機構(AMED)の令和2年度創薬基盤推進研究事業「血液凝固因子を標的とする中和可能な核酸アプタマー創薬基盤技術の開発」(課題番号22ak0101130h0003)、日本学術振興会・科研費・学術変革領域研究(B)「精密高分子による次世代医薬開拓」(課題番号:JP22H05049)、公益財団法人・先進医薬研究振興財団の支援により実施されました。
用語説明
(注1)核酸アプタマー:
標的分子に対して結合親和性をもつ核酸分子の総称。DNAからなるDNAアプタマー、RNAからなるRNAアプタマーなどがあります。
(注2)二重特異性:
二重特異性は、もともと抗体に利用される形容詞で、従来のモノクローナル抗体が1種類の2個の抗原に結合できるのに対し、二重特異性抗体は2つの異なる抗原に同時に結合することができます。本稿では、1種類の分子の異なる2つの結合サイトに相互作用する分子も二重特異性であると定義し、本用語を使用しています。図3にあるLin08-08とPse08-08は同じ結合サイトに相互作用するアプタマーを連結しているので、厳密には二重特異性という定義には含まれず、二価(bivalent)アプタマーなどと呼ばれます。
(注3)抗凝固薬利用時に懸念される出血リスク:
抗血液凝固薬は、血液の凝固過程に関与する血液凝固因子の働きを阻害することで、血液凝固を抑制します。この結果、血液が通常よりも長い時間で凝固せず、血管からの出血が持続しやすくなります。外傷や手術などがなくても、内臓や粘膜などの組織内で微小な損傷が生じることがあります。通常、血液凝固機構によってこれらの出血は迅速に止まりますが、抗血液凝固薬を使用していると、慢性的な出血がおこり、重篤な症状を引き起こす可能性が高まります。
(注4)SELEX法:
核酸アプタマー選抜法(Systematic Evolution of Ligands by Exponential enrichment, SELEX)は、特定のターゲット分子に高い結合親和性をもつ核酸(DNAまたはRNA)の配列を「選抜」するための分子進化工学的実験手法です。同手法は1990年代初頭にアメリカの化学者ラリー・ゴールドとジャック・ショスタクによって開発されました。
(注5)MACE®-SELEX法:
吉本准教授らが開発した、微粒子支援型キャピラリー電気泳動法(micro-beads assisted capillary electrophoresis: MACE)を導入した核酸アプタマー選抜法(systematic evolution of ligands by exponential enrichment)のことで、従来のSELEX法よりも効率よく複数の核酸アプタマーを獲得する分子進化工学的手法です。現在、米国、日本、中国、台湾、で特許が成立しており、株式会社リンクバイオで同手法を用いる核酸アプタマー探索サービスを提供しています(詳細:(株)リンクバイオウェブサイト、フナコシ(株)ウェブサイト)。参考文献は以下の通り。
参考文献 (1) Analytical Chemistry, 94 (49), 17255-17262 (2022).
参考文献 (2) ChemBioChem, 22, 3341-3347 (2021).
参考文献 (3) Analytical Sciences, 35, 585-588 (2019).
参考文献 (4) Molecular Therapy Nucleic Acids, 16, 348-359 (2019).