2019-1-15 慶應義塾大学,日本医療研究開発機構
慶應義塾大学医学部内科学(消化器)教室の金井隆典教授、中本伸宏専任講師、坂口光洋記念講座(オルガノイド医学)の佐藤俊朗教授らの研究グループは、肝移植以外に有効な治療法が少ない難治性自己免疫性疾患である原発性硬化性胆管炎(PSC)患者の便中に、肝臓内のTH17細胞(注1)の活性化を引き起こす3種類の腸内細菌が高確率で存在することを発見しました。この中の1つであるクレブシエラ菌は大腸の上皮に穴を開け腸管バリアを破壊し、腸管の外にあるリンパ節に移行し肝臓内の過剰な免疫応答を誘導することをマウスにおいて示すことに成功しました(図1)。さらに、同マウス肝臓で起こるTH17免疫反応は、抗菌薬によるクレブシエラ菌の排除により30%程度に減弱することが示されました。本成果は、腸内の3菌が肝臓の炎症を起こす原因である可能性とそのメカニズムを示したもので、腸内細菌を標的としたPSCに対する新たな治療薬や診断薬の開発につながることが期待されます。
本研究成果は、2019年1月14日(グリニッジ標準時)に国際学術雑誌『Nature Microbiology』のオンライン版に掲載されました。
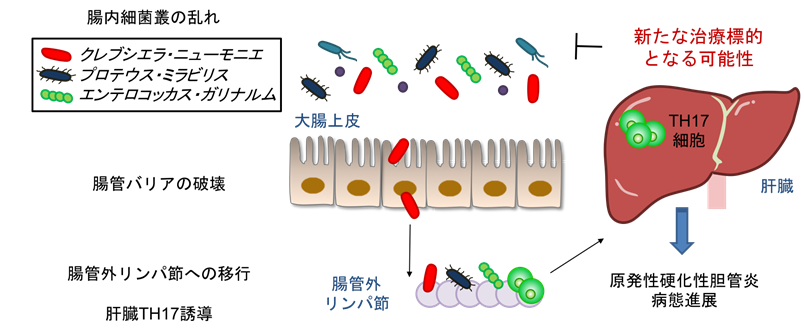
【図1】成果概要
研究の背景
原発性硬化性胆管炎(PSC)は、肝臓内外に存在する胆汁の流れ道である胆管に炎症が起こり、数年から数十年の経過により胆管狭窄とそれに伴う胆汁うっ滞を生じる原因不明の自己免疫性疾患です。最終的には肝硬変へ進展することが多く、国の指定難病(特定疾患)に認定されています。国内の推計患者数は約2,300名で(難治性の肝・胆道疾患に関する調査研究班の疫学調査2007年度、2015年度)、今後患者数の増加が予想されています。その病因として多くの遺伝的要因、環境的要因の関与が報告されていますが、病態の解明には至っておらず、肝移植以外に有効な治療法が存在しないのが現状です。
この疾患は炎症性腸疾患を合併することが多く、関連が示唆されてきました。腸管に炎症が起こると腸管バリアの機能が低下し、その結果、腸内細菌やその代謝産物が腸管を出て胆管や血管に侵入します。これが肝臓に到達することにより、本疾患の発症や病態の進展に至ると考えられてきました。しかし、その詳細は明らかになっていません。
そこで、研究グループは腸内細菌とこの病気の直接的な関係性を明らかにするために、患者から提供された糞便微生物サンプルを無菌マウス(注2)に投与し、患者の腸内環境を再現した「ヒトフローラ化マウス」を用いて研究を行いました。
研究の成果
まず、フローサイトメトリー(注3)により、PSC患者の便を無菌マウスに経口投与した「ヒトフローラ化マウス」の大腸や肝臓に存在する免疫細胞の種類を解析しました。これにより、腸内細菌が腸管外臓器である肝臓の免疫にどのような影響を与えるかを明らかにしました。解析の結果、肝臓において、インターロイキン17(IL-17)を産生するCD4 陽性ヘルパーT(TH17)細胞が顕著に増加していることが分かりました。この現象は無菌マウスや、健常人や炎症性腸疾患の一つである潰瘍性大腸炎患者の便を投与したマウスでは認められず、PSCに特有の現象であることが分かりました。
PSC患者の便中に腸管の外に移行し肝臓の免疫応答を誘導する腸内細菌があると考え、脾臓、肝臓、リンパ節などの臓器においてこの菌の分離培養を試みました。その結果、腸内細菌やその代謝産物の全身への移動の関所である腸間膜リンパ節においてクレブシエラ属のクレブシエラ・ニューモニエ(Klebsiella pneumoniae)(注4)、プロテウス属のプロテウス・ミラビリス(Proteus mirabilis)、エンテロコッカス属のエンテロコッカス・ガリナルム(Enterococcus gallinarum)の3つの菌を同定することに成功しました。興味深いことに、この3菌はいずれもPSC患者の便中に高い頻度で存在しており、特にクレブシエラ・ニューモニエは18名の患者のうち17名で検出され、健常者、潰瘍性大腸炎、他の自己免疫性肝疾患の患者と比べて非常に高率でした(図2)。この結果は海外の患者サンプルを用いた解析でも同様であり、人種を超えた普遍的な現象であると考えられました。
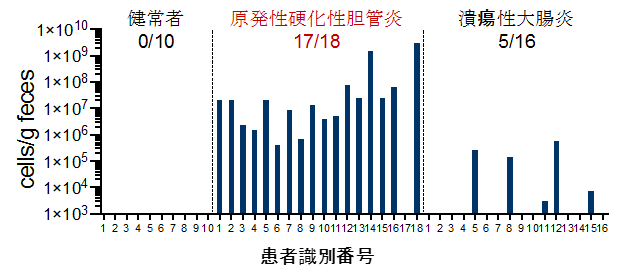
【図2】便サンプル1gあたりのクレブシエラ・ニューモニエの菌量
次に、これらの腸内細菌が肝臓内のTH17免疫応答を引き起こすメカニズムの解明を試みました。佐藤俊朗教授らの研究グループは、2011年にヒトの腸管上皮幹細胞を体外で三次元培養する技術(オルガノイド培養技術)(注5)を世界に先駆けて開発しました。この技術を用いて、PSC患者から分離した腸内細菌と健常人由来オルガノイド大腸上皮を一緒に培養したところ、PSC患者由来クレブシエラはアポトーシス(注6)の誘導を介して大腸上皮に穴を開ける(pore-forming)能力を有することが明らかになりました(図3)。PSC患者以外のサンプルから分離されたクレブシエラの多くはこのpore-forming能を有さず、pore-forming能を有さないクレブシエラを投与したマウスにおいて肝臓のTH17誘導は認められませんでした。このことから、大腸上皮に穴を開けることが、PSCにおいて特定の腸内細菌が腸管外に移行して肝臓の免疫応答を誘導する上で重要なメカニズムの1つであると考えられました。
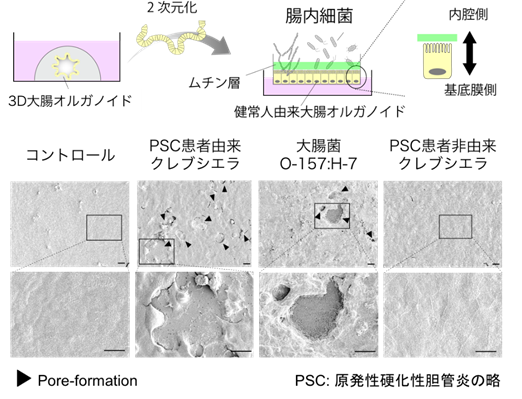
【図3】PSC患者由来のクレブシエラ菌は大腸上皮培養細胞に穴をあける
下:PSC患者由来のクレブシエラ菌の感染により大腸オルガノイドには穴が開いた(左から2番目)。この現象は病原性大腸菌(3番目)の感染と同様であり、PSC患者非由来クレブシエラ菌(4番目)の感染ではこの現象は起こらない。
さらに、今後の治療応用に向けた検証を行いました。TH17細胞の肝疾患への影響を検討するため、TH17細胞の分化を抑えることが知られているROR-γt(注7)阻害薬を、上記3菌によるヒトフローラ化マウスに肝硬変の病態を再現した肝臓線維化モデルマウスに対して投与しました。その結果、肝硬変の程度が50%以下に減弱したことから、腸内細菌により誘導されたTH17細胞は肝臓病態の増悪に深く関わることが実証されました。
また、PSC患者の便を投与したヒトフローラ化マウスに抗菌薬を投与し、人為的にクレブシエラ菌、エンテロコッカス菌を排除したところ、いずれも肝臓でTH17細胞の顕著な減少が認められました。これらのことから、3菌を排除する抗菌薬治療が、肝硬変やPSCなどの肝疾患に対して有効である可能性が示されました。
今後の展開
本研究では、PSCの病態にクレブシエラ属細菌をはじめとする3種類の腸内細菌が関与している可能性があることを示しました。現在世界中でこの病気に対して胆汁酸、核内受容体リガンド、抗線維化薬など様々な新薬の臨床試験が行われていますが、未だ長期的な改善効果を示す治療法は報告されていません。今後さらに大規模な患者サンプルを用いた検討と詳細なメカニズムの解析を行うとともに、上記腸内細菌を選択的に排除する薬剤の開発を行うことで、今回の成果が本疾患に対する新たな診断法や治療の開発につながることが期待されます。
特記事項
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「微生物叢と宿主の相互作用・共生の理解と、それに基づく疾患発症のメカニズム解明」(研究開発総括:笹川千尋)における研究開発課題「腸内細菌-上皮細胞相互作用から読み解く疾患発症メカニズムの解明」(研究開発代表者:金井隆典)、JSPS科研費 16K09374、15H02534に採択され行われました。
論文
- 英文タイトル:
- Gut pathobionts underlie intestinal barrier dysfunction and liver Th17 immune response in primary sclerosing cholangitis
- タイトル和訳:
- 原発性硬化性胆管炎において腸内細菌が腸管のバリア機能不全と肝臓のTh17応答を規定する
- 著者名:
- 中本伸宏、佐々木伸雄、青木亮、宮本健太郎、須田亙、寺谷俊昭、鈴木貴博、幸田裕造、褚柏松、谷木信仁、山口晃弘、金森光博、鎌田信彦、服部正平、芦田浩、坂元亨宇、新幸二、成島聖子、吉村昭彦、本田賢也、佐藤俊朗、金井隆典
- 掲載誌:
- Nature Microbiology
用語解説
- (注1)TH17細胞:
- CD4陽性のヘルパーT 細胞の一種で、主にインターロイキン(IL)-17を産生する。IL-17は病原体から身を守るための感染防御に重要なだけでなく、自己免疫疾患やアレルギー疾患で見られる過剰な免疫応答によって発症する疾病にも関わっていることが知られており、感染への防御機能を保ちつつ炎症を回避するにはTH17細胞の適切な制御が必要。
- (注2) 無菌マウス:
- 無菌状態を保つことが可能な特殊な環境(アイソレーター)内で飼育したマウスで、腸内細菌や皮膚などの常在細菌を含め、検出可能な微生物をまったく持たない。常在細菌を持たないため、生理学的、免疫学的にいくつかの異常がみられるが、健康な状態を維持している。
- (注3)フローサイトメトリー:
- 一つの細胞の複数の分子(主にタンパク質)を同時かつ高速に測定し、複数種類の細胞の分布を解析する装置。細胞表面または内部の分子を蛍光物質で標識した後、細胞一つずつに一定波長のレーザー光を当てた時に生じる蛍光波長を検出することにより、その細胞が何の分子を持っているかを分析する。ある部位に存在する細胞集団の増減や機能分子の発現量の増減を解析するために利用されている。
- (注4)クレブシエラ・ニューモニエ(Klebsiella pneumoniae):
- ヒトの口腔や腸内に常在しているが、通常は病的状態を引き起こすことはない。しかし、免疫系が弱っている人や高齢者、糖尿病患者などでは、肺炎や気管支炎、膀胱炎などの日和見感染症を引き起こすことがある。 肺炎桿菌とも呼ばれる。
- (注5)オルガノイド培養技術:
- 従来の細胞培養技術では、多くの細胞はシート状に培養されている。オルガノイドは細胞の増殖の足場となるジェルと増殖因子と呼ばれる栄養により、3次元構造として育てられた培養細胞を指す。1つの幹細胞から生体内の組織に似た構造を培養皿の中で作り出すことが可能であり、胃、小腸、大腸、膵臓、肝臓などの様々な組織の正常な細胞およびがん幹細胞を無限に増やすことが可能である。
- (注6)アポトーシス:
- 多細胞生物の体を構成する細胞の死に方の一種で、管理・調節された細胞のプログラムされた細胞死を指す。
- (注7)ROR-γt:
- TH17細胞への分化を誘導させる転写因子であり、IL-23受容体の発現を介してIL-17の産生を引き起こす。
お問い合わせ先
本発表資料のお問い合わせ先
慶應義塾大学医学部 内科学(消化器)教室
教授 金井 隆典(かない たかのり)
坂口光洋記念講座(オルガノイド医学)
教授 佐藤 俊朗(さとう としろう)
本リリースの発信元
慶應義塾大学
信濃町キャンパス総務課:鈴木・山崎
事業に関すること
(革新的先端研究開発支援事業)
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
関連リンク
- 革新的先端研究開発支援事業(AMED-CREST, PRIME, LEAP)
- 微生物叢と宿主の相互作用・共生の理解と、それに基づく疾患発症のメカニズム解