抗腫瘍・抗感染免疫活性化への新たな標的に
2019-02-06 理化学研究所
理化学研究所(理研)生命医科学研究センター免疫シグナル研究チームの斉藤隆チームリーダー、多根(橋本)彰子上級研究員らの国際共同研究グループ※は、シグナル伝達を担うアダプター分子[1]「CIN85」が、T細胞では活性化を抑制するシグナルを誘導することを明らかにしました。
感染症やがんに対する免疫による制御にはT細胞の活性化が必須であることから、本研究成果は、こうした疾患の治療法の開発への新たな標的になると期待されます。
ウイルス感染やがんなどから身体を守る免疫システムは、T細胞が中心的な役割を担っています。T細胞が特異的な抗原を認識して活性化し、感染やがんと戦います。T細胞の活性化は制御されていて、抑制系を阻害すればより活性化させることができます。
今回、国際共同研究グループは、アダプター分子CIN85を欠損したマウスのT細胞の機能について解析しました。その結果、T細胞はT細胞抗原受容体(TCR)[2]によって抗原を認識した後、TCRがミクロクラスター[3]を形成して活性化シグナルを誘導しますが、その下流でCIN85から脱リン酸化酵素「Sts-2」を介して活性化を抑制することが明らかになりました。
本研究成果は、米国の国際科学雑誌『Science Signaling』(2月5日号)に掲載されます。
※国際共同研究チーム
理化学研究所 生命医科学研究センター
免疫シグナル研究チーム
チームリーダー 斉藤 隆(さいとう たかし)
上級研究員 多根(橋本)彰子(たね(はしもと)あきこ)
上級研究員(研究当時)横須賀 忠(よこすか ただし)
研究員(研究当時)大西 玲子(おおにし れいこ)
研修生(研究当時)メイ・スエン・コング(MeiSuenKong)
テクニカルスタッフ 佐久間 待恵(さくま まちえ)
テクニカルスタッフ 米田 奈津美(よねだ なつみ)
分化制御研究チーム
チームリーダー 黒崎 知博(くろさき ともひろ)
研究員(研究当時)米谷 耕平(こめたに こうへい)
統合ゲノミクス研究チーム
チームリーダー 小原 収(おはら おさむ)
研究員(研究当時)川島 祐介(かわしま ゆうすけ)
ストニーブルック大学
教授ニコラス・カルピーノ(NickCarpino)
マレーシア科学大学
教授キア・キエン・プア(KiaKienPhua)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金 基盤研究S「T細胞活性化制御の時空間的構造的解析(研究代表者:斉藤隆)」による支援を受けて行われました。
背景
ウイルスなどの病原体やがん細胞などから身体を守る免疫システムの中心的担い手はT細胞です。T細胞は、こうした外敵の特異的抗原を認識して活性化し、機能的なエフェクターT細胞[4]となって外敵を攻撃し駆逐します。有効な免疫機能は、T細胞の活性化によって誘導されます。T細胞は、T細胞抗原受容体(TCR)によって抗原を認識した後、TCRがミクロクラスターを形成して、ここにキナーゼ(リン酸化酵素)やアダプター分子(シグナル伝達分子)などを集積することによって活性化のためのシグナルを誘導します注1)。
斉藤隆チームリーダーらは、これまでT細胞の活性化の場としてのミクロクラスターを解析するとともに、その下流の種々のシグナル分子の役割を解析してきました注1)。アダプター分子であるCIN85とCD2APは、相同性が高くファミリーを形成しますが、これらのT細胞における機能は分かっていませんでした。そこで、国際共同研究グループは、CIN85やCD2APを欠損したT細胞の機能解析を行いました。
注1)Yokosuka T. et al. Newly generated T cell receptor microclusters initiate and sustain T cell activation by recruitment of Zap 70 and SLP-76. Nat Immunol. 6: 1253-1262, 2005.
研究手法と成果
ニつのアダプター分子CIN85とCD2APは、免疫細胞以外では細胞膜受容体の細胞内への取り込みに働くこと、CD2APはT細胞でもTCRの取り込み・分解を誘導するという報告があります注2)。そこで、CIN85とCD2APのT細胞における機能を解析するために、T細胞特異的なそれぞれの欠損(KO)マウスを作り、T細胞機能を解析しました。それらのT細胞を抗原や抗TCR抗体で刺激(TCR刺激)したところ、CIN85-KO T細胞では、細胞増殖やサイトカイン[5]産生が亢進することが分かりました(図1)。これは、CIN85がT細胞の活性化を抑制していることを示しています。
実際、TCR刺激後のTCR下流シグナル分子のSLP76とErkの活性化(リン酸化)を調べた結果、CIN85-KO T細胞では、どちらも亢進していることが分かりました(図2)。一方、活性化経路の上流シグナル分子のCD3ξやLckには変化がなかったことから、CIN85はシグナル伝達経路のZAP70キナーゼ下流の活性化シグナルを抑制していることが示されました。
また、TCR下流シグナル分子の活性化が亢進していることと相まって、エフェクターT細胞への分化も、感染やがんへの免疫に重要なインターフェロンγ[6]を産生するTh1細胞[4]への分化が亢進していました。一方、CD2AP-KO T細胞は報告とは異なり注2)、T細胞の分化も、活性化によるサイトカイン産生や増殖なども、野性型マウス(WT)と何も違いはなく、CD2APはT細胞機能に特別な役割を持たないことが分かりました。
CIN85を介するT細胞の活性化の抑制のメカニズムを解明するために、CIN85のT細胞活性化の抑制に重要な領域(SH3 PR領域)を同定し、その領域に結合する分子を質量分析法[7]で解析しました。その結果、脱リン酸化酵素Sts-2がCIN85と会合することが分かりました。実際、TCR刺激による活性化に伴ってCIN85とSts-2は会合し、両者の欠損T細胞ではサイトカイン産生などの活性化がより強く亢進することが示されました。
また、T細胞は、TCRによる抗原認識に伴って、TCRミクロクラスターが形成されて、そこに種々のシグナル分子が集積して、活性化シグナルを伝達して活性化に至ります注1)。そこで、CIN85、およびSts-2のミクロクラスターへの集積を全反射照明蛍光顕微鏡[8]で観察したところ、抗原刺激によってCIN85はミクロクラスターに集積し、Sts-2も多くがCIN85によって集積することが分かりました(図3)。
さらに、CIN85と会合することが既に知られていたユビキチンリガーゼ[9]Cblも同様にミクロクラスターに集積することから、CIN85/Cbl/Sts-2が、活性化に伴ってTCRミクロクラスターに集積し、抑制クラスターを形成して、T細胞活性化を抑制していると考えられます(図4)。
注2) Lee K-H et al. The immunological synapse balances T cell receptor signaling and degradation. Science 14: 1218-1222, 2003.
今後の期待
今回の研究成果により、T細胞活性化に伴って、アダプター分子CIN85は脱リン酸化酵素Sts-2とともに活性化の抑制を担うことが明らかになりました。現在、免疫チェックポイント療法[10]でもT細胞の抑制系を阻害することで、T細胞を活性化させて、抗腫瘍免疫を亢進することが知られ有効な治療として使われています。
今回のCIN85-Sts-2は活性化によって作られる抑制系であることから、ここを標的にして阻害することで、KOマウスT細胞のように、活性化を亢進すると考えられます。今後、T細胞のCIN85-Sts-2を標的とした新しいがん免疫療法や感染症の治療法の開発に発展する可能性が期待できます。
原論文情報
Mei Suen Kong*, Akiko Hashimoto-Tane*, Yusuke Kawashima, Machie Sakuma, Tadashi Yokosuka, kohei Kometani, Reiko Onishi, Nick Carpino, Osamu Ohara, Tomohiro Kurosaki, Kia Kien Phua and Takashi Saito (* equally contributed), “Inhibition of T cell activation and function by the CIN85 adaptor protein”, Science Signaling, 10.1126/scisignal.aav4373
発表者
理化学研究所
生命医科学研究センター 免疫シグナル研究チーム
チームリーダー 齊藤 隆(さいとう たかし)
上級研究員 多根(橋本) 彰子(たね(はしもと) あきこ)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- アダプター分子
- キナーゼが酵素活性を持って基質を変化させるのに対して、酵素活性を持たないが、種々の分子と結合することで、シグナル伝達を担う分子。多くがタンパク質結合ドメイン、SH2、SH3、PHなどの領域を持つ。
-
- T細胞抗原受容体(TCR)
- T細胞の細胞膜上に発現していて、抗原を認識する受容体のこと。αβの2鎖からなる二量体で、それぞれ抗原認識を担う可変領域を持ち、遺伝子再構成によってその多様性を作り出している。
-
- ミクロクラスター
- T細胞が、TCRによって抗原認識すると、TCRが100個程集積したクラスターが形成されて、そこに種々のシグナル分子(キナーゼ、アダプター、エフェクター分子)が集積して、活性化シグナルを創り出して、T細胞活性化を誘導する。この活性化のための集積の場がTCRミクロクラスターである。
-
- エフェクターT細胞、Th1細胞
- 抗原提示細胞からの抗原刺激を受けることによりT細胞が活性化され、機能分化してエフェクター細胞となる。Th1、Th2、Th17細胞などが知られる。Th1細胞は、インターフェロンγを産生し、細胞内に寄生する細菌、ウイルスなどの病原体やがん細胞の排除を促すエフェクターT細胞である。
-
- サイトカイン
- 細胞同士の情報伝達に関わるさまざまな生理活性を持つ可溶性タンパク質の総称で、特にリンパ球間に働くものをインターロイキンと呼ぶ。
-
- インターフェロンγ
- 抗原刺激や微生物感染に応答してT細胞(ヘルパーT細胞:Th1細胞)などから分泌される。抗腫瘍作用、抗ウイルス能増強、マクロファージやNK細胞の活性化などさまざまな機能がある。
-
- 質量分析法
- 物質をイオン化し、そのイオンを検出することにより、原子や分子の質量を推定する分析法で、未知タンパク質などの同定に使われる。
-
- 全反射照明蛍光顕微鏡
- 極めて微弱な蛍光分子でも検出できる顕微鏡で、ガラスとの界面で光を全反射させることで、細胞表面から100ナノメートル程度の深さの領域(主に細胞膜)だけを検出できる。
-
- ユビキチンリガーゼ
- タンパク質を分解する一つの方法として、タンパク質にユビキチン分子を結合させると、タンパク分解酵素プロテアソームで分解されることが知られています。ユビキチンリガーゼは、このユビキチンをタンパク質に結合させる働きを持つ酵素である。
-
- 免疫チェックポイント療法
- T細胞の活性化を抑制する共刺激分子(PD-1、CTLA-4)およびそのリガンドに結合し、その作用を阻害する抗体の総称で、T細胞の免疫抑制を解除することにより、抗腫瘍免疫応答を増強する。
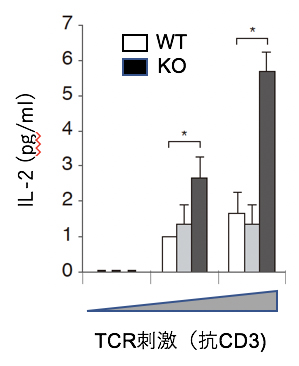
図1 CIN85欠損T細胞の抗原刺激による活性化の亢進
野生型マウス(WT、白)またはCIN85欠損(KO、黒)マウスのT細胞を抗TCR抗体の抗CD3で刺激して(TCR刺激)、産生されるサイトカインのインターロイキン-2(IL-2)を測定した。CIN85-KOマウスでは、IL-2の産生が亢進したことが分かった。一方CD2AP欠損T細胞(灰色)では変化がないことが分かった。
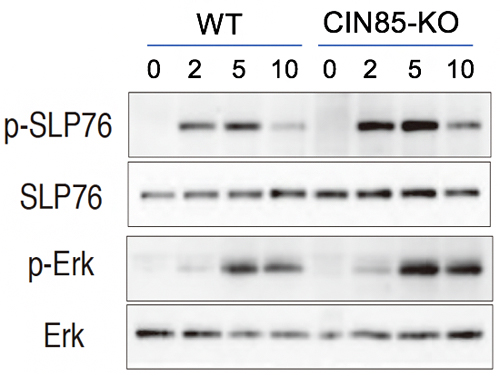
図2 CIN85欠損T細胞におけるTCR下流分子のリン酸化の亢進
WTまたはCIN85-KOマウスのT細胞を抗CD3抗体で刺激して、2、5、10分後の細胞内でのシグナル分子SLP76とErkのリン酸化をウェスタンブロットにて解析した。WTに比べて、CIN85-KOマウスのT細胞では、SLP76とErkのリン酸化(p-SLP76とp-Erk)が亢進することが分かった。
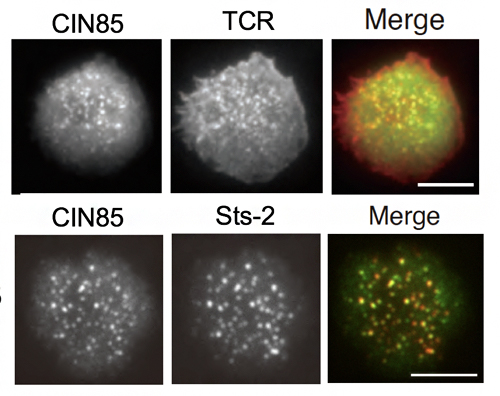
図3 活性化に伴うCIN85、Sts-2のTCRミクロクラスターへの集積
CIN85およびSts-2を緑色蛍光タンパク質(GFP)で標識したCIN85-GFP(緑)、Sts-2-GFP(緑)を発現させたT細胞を抗TCR抗体(赤)で染色し、人工脂質二重膜上で抗原刺激して活性化させ、TCRミクロクラスターとの共局在をTIRF(全反射照明蛍光顕微鏡)で観察した。右上の画像からCIN85がTCRに集積していること、右下の画像からCIN85とSts2が共局在(Merge)していることが分かる。図中のスケールバーは、2.5μm。
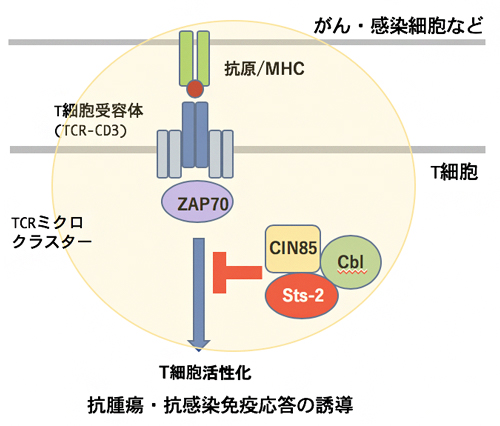
図4 CIN85によるT細胞活性化シグナルの抑制機構
T細胞ががん・感染細胞などを認識すると、TCRミクロクラスターを形成して、ZAP70キナーゼなどシグナル分子を集積し、活性化シグナルを誘導する。CIN85はSts-2、Cblと会合して抑制クラスターを形成し、ZAP70下流のシグナルを抑制する。