2019-03-27 京都大学
伊藤克彦 医学部附属病院准教授、近藤玄 ウイルス・再生医科学研究所教授、宮地均 同技術専門員、菅井学 福井大学教授、千葉大学らの研究グループは、精子の成熟にプロタミン分子の脱燐酸化が重要である事を見出しました。
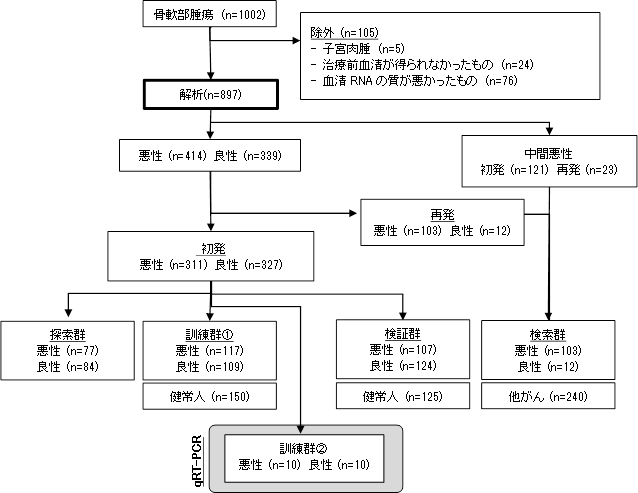
体細胞では、遺伝子の糸を巻き取る「糸車」であるヒストン蛋白が、燐酸化などの修飾を受けて機能します。一方、精子細胞では、形態変化の過程でヒストンがプロタミンに置き換わります。このプロタミンの燐酸化は知られていましたが、その意義は不明でした。
本研究グループは、細胞内の分子を折り畳むシャペロン(Hspa4l)を欠損したマウスが、脱燐酸化酵素(Ppp1cc)を欠損したマウスと同様、精子の形態異常・不妊を示す事に注目して、その機序の解明を目指しました。研究の結果、プロタミン(Protamine 2)の56番目のアミノ酸の脱燐酸化が、精子の成熟に重要であることを見出しました。
本研究成果は、修飾を受けたヒストンと同様に、プロタミンも修飾を受けて機能する事を示す一方で、このマウスに似たヒトの男性不妊症の原因を解明し、治療研究の進展につながるものと考えられます。
本研究成果は、2019年3月27日に、国際学術誌「Science Signaling」のオンライン版に掲載されました。
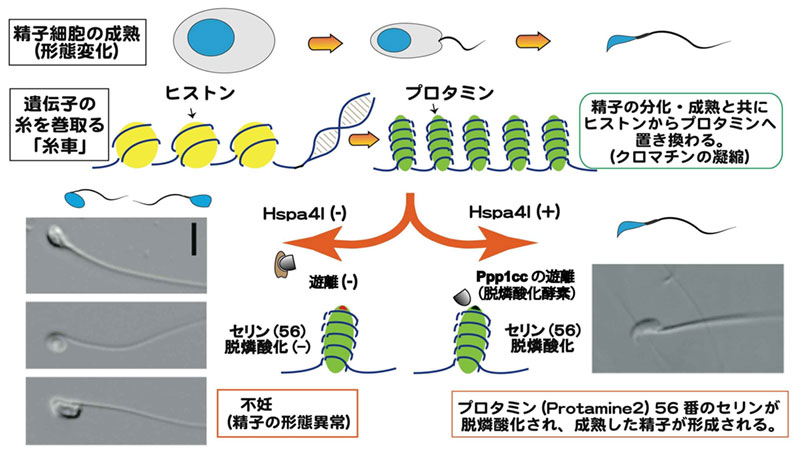
図:本研究の概要
書誌情報
【DOI】 https://doi.org/10.1126/scisignal.aao7232
Katsuhiko Itoh, Gen Kondoh, Hitoshi Miyachi, Manabu Sugai, Yoshiyuki Kaneko, Satsuki Kitano, Hitomi Watanabe, Ryota Maeda, Akihiro Imura, Yu Liu, Chizuru Ito, Shigeyoshi Itohara, Kiyotaka Toshimori, and Jun Fujita (2019). Dephosphorylation of protamine 2 at serine 56 is crucial for murine sperm maturation in vivo. Science Signaling, 12(574):eaao7232.
詳しい研究内容について
精子形態異常を伴う不妊マウスの原因を解明
―プロタミン分子の 56 番セリンの脱燐酸化は精子の成熟に重要―
概要
京都大学大学院医学研究科 伊藤克彦 准教授(研究当時、現:医学部附属病院准教授)、同ウイルス・再生 医科学研究所 近藤玄 教授、宮地均 同技術専門員、福井大学学術研究院 菅井学 教授、千葉大学らの共同研 究チームは、精子の成熟にプロタミン分子の脱燐酸化が重要である事を見出しました。
体細胞では、遺伝子の糸を巻き取る「糸車」であるヒストン蛋白が、燐酸化などの修飾を受けて機能します。 一方、精子細胞では、形態変化の過程でヒストンがプロタミンに置き換わります。このプロタミンの燐酸化は 知られていましたが、その意義は長く不明でした。本研究チームは、細胞内の分子を折り畳むシャペロン (Hspa4l)を欠損したマウスが、脱燐酸化酵素(Ppp1cc)を欠損したマウスと同様、精子の形態異常・不妊を示す 事に注目して、その機序の解明を目指しました。その結果、プロタミン(Protamine 2)の 56 番目のアミノ酸の 脱燐酸化が、精子の成熟に重要である事を突き止めました。本研究は、修飾を受けたヒストンと同様に、プロ タミンも修飾を受けて機能する事を示す一方、このマウスに似たヒトの男性不妊症の原因を解明し、治療研究 の進展につながるものです。
本研究成果は、2019 年 3 月 27 日に国際学術誌「Science Signaling」にオンライン掲載されました。
1.背景
体の大部分を占める体細胞では、ヒストン蛋白が遺伝子の糸を巻き取る「糸車」として働いています。ヒスト ンは、様々な修飾(燐酸化、メチル化など)を受けて様々な働きをする事が知られてきました。一方、精子細胞 は、成熟の過程で劇的な形態変化(クロマチンの凝集を伴うコンパクトな頭部、ミトコンドリアが移動して集ま る体部、鞭毛を伴う尾部など)を起こしますが、この過程でヒストンがプロタミンに置き換わります。マウスや ヒトでは、2種類のプロタミン(プロタミン1、プロタミン2)があり、プロタミンもヒストンと同様に燐酸化 や脱燐酸化される事は約30年前に報告されていました。しかし、その修飾の生物学的意義は、長く不明のままで した。
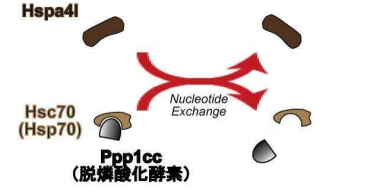
シャペロン分子(群)は、その大部分を熱ショック蛋白が占めています。これらのシャペロンは、熱によって 変性した細胞内の分子をホールディング(自然の状態へと折り畳む)する機能を持ちます。また、シャペロンは、 (細胞の)膜を越えた分子の輸送や、変性した分子の分解などにも関与します。私達は、哺乳動物の精子形成が 体腔より低い温度で進む事に注目し、精巣に多く発現するシャペロン分子Hspa4lを見出しました。この分子の仲 間(Hsp110 family)は、他のシャペロン(Hsp70やHsc70)と協調(Nucleotide Exchange)して、ホールディ ングや、ホールディングした分子の遊離に関わる事が分かっています。
2.研究手法・成果
私達の見出したシャペロン Hspa4l の、生物個体(マウス)での働きを知るために、この遺伝子を欠損した マウスを作成しました。このマウスは、精子の形態異常を起こして不妊である事が分かりました。
他のグループの報告を調べる中で、脱燐酸化酵素である Ppp1cc の遺伝子欠損マウスが、同じような精子の 形態異常を起こして不妊である事に注目しました。これらのシャペロンと脱燐酸化酵素との関係を解析した結 果、下図のような関係にあると考えられました。すなわち、脱燐酸化酵素 Ppp1cc は、Hsc70(または、Hsp70) にホールディングされて複合体となりますが、Hspa4l の協調作用(Nucleotide Exchange)によって、複合体 から遊離すると考えられました。また、試験管内で、脱燐酸化酵素 Ppp1cc が、組替えプロタミン2に付く事、 プロタミン2の 56 番目のアミノ酸(セリン)を脱燐酸化する事を示しました。これらの実験結果は、脱燐酸 化酵素 Ppp1cc がプロタミン2の 56 番セリンを脱燐酸化し得る事を示しています。Hspa4l 欠損マウスでは、 シャペロン間(Hspa4l と Hsc70)の協調作用が起こらないので、脱燐酸化酵素が遊離されず、プロタミン2 の 56 番セリンを脱燐酸化する事が出来ない為に精子の形態異常や不妊を起こしたと推測出来ます。
アミノ酸のセリン(S)は燐酸化・脱燐酸化の修飾を受けますが、アラニン(A)は燐酸化されません。セリ ンなどのアミノ酸をアラニンに置換える事で、置換え部位のアミノ酸が「常に脱燐酸化されている状態」を調 べる事が可能である事が分かっています。そこで、セリン脱燐酸化の意義を生物個体(マウス)で調べるため、 ゲノム編集技術を用いてプロタミン2(Prm2)の 56 番目のセリンをアラニンに置換えた(Prm2 S56A)マウ スを作成しました。これは、プロタミン2の 56 番のアミノ酸が「常に脱燐酸化されている状態」を模したマ ウスと言えます。更に、Hspa4l 欠損マウスとかけ合わせて、Hspa4l が欠損しているが、プロタミン2の 56 番 のアミノ酸が「常に脱燐酸化されている状態」を模したマウスを作成しました。下図に示されるように、この マウスの精子は正常(野生型)のマウスの形態を示し、マウスは不妊ではありませんでした。すなわち、Hspa4l 欠損マウスで見られた病態が消えました。この結果は、プロタミン2の 56 番目セリンの脱燐酸化が精子の成 熟に関与する重要なステップである事を示しています。
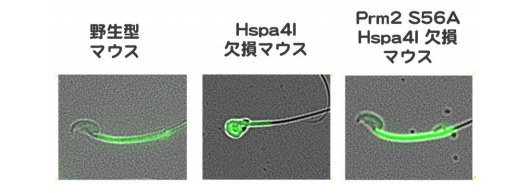
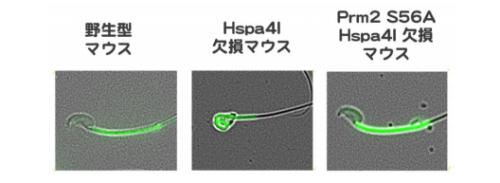
以上から、私達は、マウス精子の成熟にプロタミン2の 56 番セリンの脱燐酸化が重要である、と結論しま した。
3.波及効果、今後の予定
(1)プロタミンのエピジェネティックス
遺伝子の糸を巻き取る「糸車」として働くヒストンは、様々な修飾を受けて様々な働きをする事が明ら かにされてきました((エピジェネティックス)。一方、精子の成熟に重要な働きをするプロタミンは、ヒス トンと同様に修飾されることが分かっていましたが、精子の劇的な形態変化を試験管内で観察出来る方法 が開発出来ていない事もあり、プロタミンがどのように修飾され、どのような働きをするかが長く不明で した。ゲノム編集技法を用いた今回の成果が起点となり、プロタミンの修飾と精子の成熟との関連を解析 する研究が、広く進められる事に期待します。
(2)男性不妊症
ヒトの男性不妊症には、今回のマウスに似た精子の形態異常を伴うものも含まれますが、プロタミンの 修飾解析の進展と共に、様々な男性不妊症の原因解明や治療研究がなされて行く事に期待します。
(3)特異的な抗体
今回の研究過程で、私達は、「燐酸化された、プロタミン2の 56 番セリン」を特異的に認識する抗体の 作成を試みましたが、成功していません。この様な抗体作成などの試みは、より直接的にプロタミンの修 飾を観察出来る方法を生み出すと考えられます。また、マウスのプロタミン2の 56 番セリンは、ヒトのプ ロタミン2の 59 番セリンに相当すると思われます。ヒトに対する、この様な抗体の作成は、男性不妊症の 原因解明や診断に役立つと思われます。
(4)ゲノム編集技法
今回の結果は、ゲノム編集技法を用いてオスのマウスの不妊を「治癒」出来た事を示しています。しか し、私達は、世代を跨いで継承される精子の細胞を対象に、ゲノム編集技法を用いて変異導入する事をヒ トの治療に直接応用する事には反対です。詳細な原因解明と、粘り強い治療研究から、ゲノムへの変異導 入をしなくて良い治療方法が見出される事に期待します。
4.研究プロジェクトについて
この研究は、以下のグループの共同研究として行なわれました。
● 京都大学大学院医学研究科分子病診療学 准教授 伊藤克彦
(現:京都大学医学部附属病院准教授)
● 京都大学ウイルス・再生研究所統合生体プロセス分野 教授 近藤玄
● 京都大学ウイルス・再生研究所マウス作製支援チーム 技術専門員 宮地均
● 福井大学学術研究院医学系部門分子遺伝学分野 教授 菅井学
● 京都大学医学研究科血液腫瘍内科 特定病院助教 伊村明浩
●千葉大学未来医療教育研究センター 特任教授 年森清隆
● 千葉大学大学院医学研究院 生殖生物医学講座 講師 伊藤千鶴
●理化学研究所 脳神経科学研究センター 行動遺伝学研究チーム チームリーダー 糸原重美
また、この研究の一部は、科学研究費補助金によって成されました。
<研究者のコメント>
この研究は、新たな分子の探索に続いて、様々な遺伝子変異マウスを用いて、また、多くの人やグループ との討論を介して地道に成されたものです。この様な研究をこれからも支える社会であって欲しいと願って います。
<論文タイトルと著者>
タイトル:Dephosphorylation of protamine 2 at serine 56 is crucial for murine sperm maturation in vivo (マウス生体での精子の成熟に、プロタミン2の 56 番目のセリンの脱燐酸化が重要である)
著 者:Katsuhiko Itoh, Gen Kondoh, Hitoshi Miyachi, Manabu Sugai, Yoshiyuki Kaneko, Satsuki Kitano, Hitomi Watanabe, Ryota Maeda, Akihiro Imura, Yu Liu, Chizuru Ito, Shigeyoshi Itohara, Kiyotaka Toshimori, Jun Fujita
掲 載 誌: Science Signaling