要旨
理化学研究所(理研)岩崎RNAシステム生化学研究室の岩崎信太郎主任研究員、水戸麻理テクニカルスタッフらの共同研究グループ※は、エピジェネティクス[1]制御に必須な役割を果たすヒストン修飾[2]を細胞種特異的に解析する新手法を開発しました。
私たちの体の組織は、多種多様な細胞からできています。それぞれの細胞でどのような遺伝子が発現しているかを知ることは、疾患などのメカニズムを正しく理解するためにも重要です。細胞の多様性を支えるのは、ヒストンタンパク質の修飾などを介したエピジェネティクス制御です。現在の生物学では、細胞種ごとに起こっているエピジェネティクス制御を解明することが強く求められています。しかし、そのような解析は技術的な問題によりこれまで困難でした。
今回、共同研究グループは、この問題を解決する新しい手法「tChIP-Seq (tandem Chromatin Immuno-Precipitation Sequencing)」を開発しました。クロマチン[3]のコアとなるヒストンタンパク質H2Bに、アミノ酸のタグ配列を付与したものを、細胞種特異的なプロモーター[4]で発現誘導し、標的の細胞に存在するクロマチンをラベルします。このラベルによって、サンプルが複数の細胞種の混合物であっても、ラベルされた標的の細胞由来のクロマチンのみを回収することができます。その後、標的のヒストン修飾を持つクロマチンをさらに抗体によって回収し、得られたDNA配列を次世代シークエンサー[5]によって解読するChIP-Seq[6]解析によって、網羅的にヒストン修飾が生じているDNA領域を解析することができます。実際にこの手法を使って、マウスの脳組織の神経細胞でのみH3K4me3(ヒストンH3K4メチル化)修飾が生じているDNA領域を解析することによって、神経細胞でのみ特異的に転写されているRNAを多数発見しました。
本手法は汎用性が高いことから、生命科学の研究に広く利用されると期待できます。
背景
生命は、さまざまな種類の細胞によって成り立っています。多様な細胞を特徴づけるのは、細胞種特異的な遺伝子の発現制御です。それぞれの細胞で、どのような遺伝子が発現しているかを知ることは、疾患などのメカニズムを正しく理解するためにも重要です。
細胞種特異的な遺伝子発現を可能にするメカニズムとして、エピジェネティックなDNAの制御があります。特に、DNAが巻きついているヒストンタンパク質の修飾(ヒストン修飾)は、エピジェネティックな遺伝子発現を直接制御することが知られており、現在の生物学において最も精力的に研究されている分野の一つです。
エピジェネティックなヒストン修飾が複雑な細胞種を形成する基盤になっていることから、細胞の種類ごとにDNAのどの位置にヒストン修飾が生じているのかを知ることが非常に重要です。しかし、動物の組織はさまざまな種類の細胞から形成されているため、細胞種ごとのヒストン修飾を知ることはこれまで技術的に困難でした。そこで、共同研究グループは、この問題を解決できる新手法の開発を試みました。
研究手法と成果
共同研究グループは、複数の細胞種が混ざっている組織から、標的としている細胞由来のクロマチンのみを精製する戦略をとりました。DNAは、ヒストンに巻きつくことによって、クロマチンと呼ばれる構造体を形成します。5種類存在するヒストンの中で、中心的な構成要素として知られるH2Bにアミノ酸のタグ配列を付与したものを、細胞種特異的なプロモーターで発現誘導し、脳組織の神経細胞でのみ発現する組換えマウスを作製しました(図1A)。
このタグ配列のラベルによって、タグ配列を持つクロマチンとそうでないクロマチンを生化学的に分けることができます。脳組織は神経細胞だけでなく、多様なグリア細胞からも形成されていますが、タグ配列付きH2Bが発現する細胞は神経細胞だけなので、神経細胞由来のクロマチンのみを精製すれば、それ以外の細胞由来のクロマチンを取り除くことができます(図1B)。
次に、神経細胞由来のクロマチンを、特定のヒストン修飾H3K4me3(ヒストンH3K4メチル化)を持つクロマチンのみを回収できる抗体によってさらに精製し、クロマチンに結合しているDNA領域を次世代シークエンサーによってChIP-Seq解析しました(図1C)。このような二段階の精製(tandem ChIP)を行うことで、神経細胞で生じているエピジェネティクス制御を網羅的に解析することが可能になりました。共同研究グループは、この新手法を「tChIP-Seq」と名づけました。
H3K4me3は、通常RNAの転写が活発に起きているDNA領域によくみられるヒストン修飾です。実際にマウスを用いて、神経細胞でのみH3K4me3が生じているDNA領域を解析することによって、神経細胞でのみ特異的に転写されているRNAを多数発見することができました。
今後の期待
今回、マウスの脳組織由来の神経細胞をモデルケースとして新手法を開発しましたが、開発した手法は別の生物、多様な組織、細胞種にも応用することができます。また、本研究で用いたH3K4me3修飾に限らず、他のヒストン修飾にも応用できることから、汎用性が高い技術といえます。今後、本手法は生命科学のさまざまな研究に利用されると期待できます。
原論文情報
- Mari Mito, Mitsutaka Kadota, Kaori Tanaka, Yasuhide Furuta, Kuniya Abe, Shintaro Iwasaki, and Shinichi Nakagawa, “Cell Type-Specific Survey of Epigenetic Modifications by Tandem Chromatin Immunoprecipitation Sequencing”, Scientific Reports, doi: 10.1038/s41598-018-19494-9
発表者
理化学研究所
主任研究員研究室 岩崎RNAシステム生化学研究室
主任研究員 岩崎 信太郎 (いわさき しんたろう)
テクニカルスタッフ 水戸 麻理 (みと まり)
報道担当
理化学研究所 広報室 報道担当
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
補足説明
-
- エピジェネティクス
- DNA配列の変化によらず、遺伝子の発現を制御するメカニズムの総称。狭義ではDNAのメチル化やヒストン修飾による制御を指すことが多い。
-
- ヒストン修飾
- ヒストンタンパク質に付加される翻訳後修飾。メチル化、アセチル化、リン酸化、ユビキチン化などがある。
-
- クロマチン
- ゲノムDNAがヒストンタンパク質を代表としたタンパク質に巻き付き形成する複合体。
-
- プロモーター
- 遺伝子を発現させる機能を持つ塩基配列。プロモーターがないと遺伝子は発現しない。
-
- 次世代シークエンサー
- 数億のDNA配列を同時に解読できる装置の総称。
-
- ChIP-Seq
- ヒストン修飾が生じているゲノム領域を網羅的に解析する手法。目的のヒストン修飾があるクロマチンを、修飾特異的抗体によって生化学的に精製しDNAを回収する。その後、次世代シークエンサーによってそのDNAを解読する。
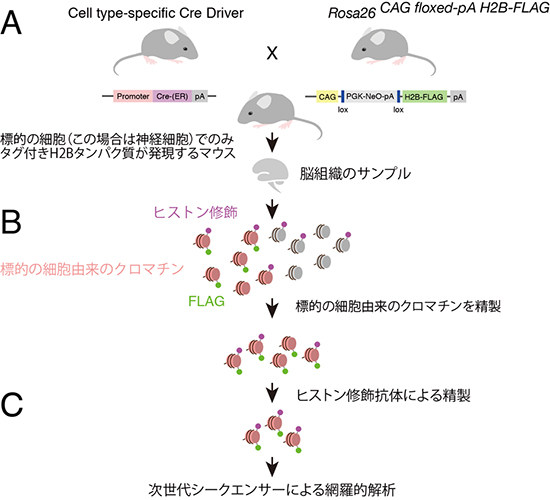
図1 細胞種特異的なChIP-Seq(tChIP-Seq)の概要
A)標的の細胞(本研究の場合は神経細胞)でのみ、アミノ酸のタグ付きH2Bタンパク質が発現するように細工した遺伝子組換えマウスを準備する。
B)脳組織全体からクロマチン画分を回収した後、タグ付きH2Bタンパク質が取り込まれているクロマチン(ピンク色)のみを精製する。これによって脳組織中に多様な細胞種があっても、神経細胞由来のクロマチンのみを回収することができる。
C)その後、解析をしたいヒストン修飾に対する抗体(本研究の場合はH3K4me3)で精製し、回収されたDNAを次世代シークエンサーによって網羅的に解析する。