2020-06-18 理化学研究所
理化学研究所(理研)生命機能科学研究センター生体モデル開発チームの阿部高也技師、清成寛チームリーダーらの研究チームは、ゲノム編集技術[1]の一つであるCRISPR-Cas9システム[2]による高効率なノックインマウスの作製法を開発しました。
本研究成果は、ゲノム編集技術によるノックインマウスの作製効率を大幅に改善するものであり、基礎研究から応用研究まで幅広い分野の進展に大きく貢献すると期待できます。
CRISPR-Cas9システムは、その簡便さと効率の良さから、遺伝子改変マウスの作製に利用される代表的なツールの一つです。しかし、単純に遺伝子を破壊するノックアウトマウスに比べると、外来遺伝子を挿入するノックインマウスの作製効率は極めて低く、その改善を目指した技術開発が世界中で行われています。
今回、研究チームは、受精卵を用いたノックインマウスの作製には、使用する受精卵の細胞周期[3]が大きな鍵を握ることを明らかにし、作製効率の飛躍的な改善に成功しました。具体的には、相同組換えによる修復機構が活性化される前の受精卵の前核に、ゲノム編集に必要な溶液を注入することが重要なことを見いだしました。
本研究は、オンライン科学雑誌『Cell Reports』(5月19日付)に掲載されました。
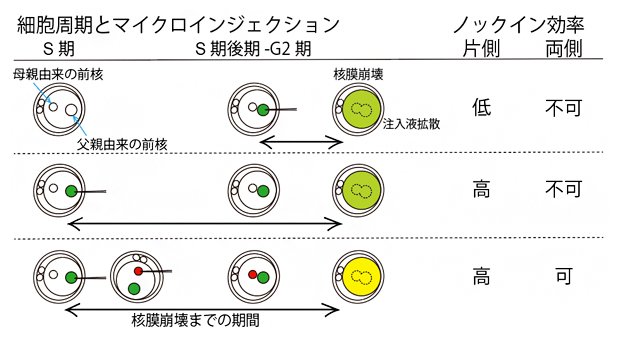
マイクロインジェクションから核膜崩壊までの期間の長さがノックイン効率に影響する
背景
ある特定の遺伝子を破壊(ノックアウト)したり、外来遺伝子を標的とするゲノム領域へ挿入(ノックイン)したりする遺伝子改変マウスは、1980年代にES細胞(胚性幹細胞)[4]を用いたジーンターゲティング法[5]の開発によって作製可能となり、現在では医学や基礎研究分野において必要不可欠な技術の一つとなっています。しかし、その作製には、高度な専門技術に加え、1~2年もの長い期間を要するため、新たな技術開発が切望されてきました。
しかし近年、ゲノム編集技術の台頭により、ES細胞を介さずに直接受精卵を使って遺伝子改変マウスを作製できるようになりました。なかでもCRISPR-Cas9システムは、1~2カ月程度の短期間で高効率にノックアウトマウスを作製できることから、世界中の研究者の間に急速に広まっていきました。しかし、ノックアウトマウスに比べノックインマウスの作製効率は非常に低く、その技術を向上させる研究が行われてきましたが、根本的な課題の解決には至っていませんでした。
研究手法と成果
外来遺伝子をノックインする方法は、細胞に備わっている傷ついたDNAを修復するメカニズムを利用しています。DNA修復法はいくつか知られており、それぞれ細胞周期に依存して活性化されることが分かっています。細胞周期は四つの期間に分かれ、受精後の卵はG1期’S期(DNAの複製)’G2期’M期(分裂)を経て、二細胞期胚となります。
研究チームは、細胞周期のS期後期からG2期に活性化される相同組換えによる修復機構[6]を利用したHR法(Homologous Recombination-based Method)を始めとする三つの方法に着目しました。まず、標的とするゲノムを切断するのに必要なCas9やgRNA、挿入する外来遺伝子を含むDNAなどを最適化するとともに、三つの方法におけるノックイン効率や正確性の比較検討を行いました。その結果、比較した全ての方法において、外来遺伝子(GFP:緑色蛍光タンパク質)をノックインすることに成功し、なかでもHR法は、他の方法に比べて高率かつ正確にノックインできることを見いだしました。
マウスの受精は、卵子に精子の核が侵入することで起こります。そのため、受精直後の受精卵には母親由来と父親由来の核(前核)が存在していますが、やがてこの二つの前核は徐々に近づき(S期)、核融合して一つになります(G2期後期)(図1)。一般的に、受精卵を用いたゲノム編集では、核融合が起こる前に顕微鏡下で極細のガラス管を用いてゲノム編集に必要な溶液(Cas9やgRNA)を片方の前核へ注入(マイクロインジェクション)します(図1の写真)。
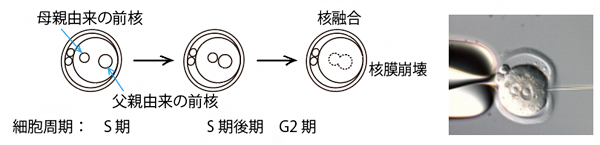
図1 受精後の発生とマイクロインジェクション
左側:受精から核融合までの流れ。受精直後の受精卵には、母親由来と父親由来の核(前核)が存在している。細胞周期のS期にこの二つの前核は徐々に近づき、G2期後期に核融合して一つになる。
右側:マイクロインジェクションの写真。
しかし、これまで受精卵の細胞周期とマイクロインジェクションのタイミングの関係については詳しく調べられていませんでした。そこで、受精から早い時期(S期)と遅い時期(S期後期からG2期)にマイクロインジェクションを行い、ノックインマウスの作製効率を比較しました。その結果、相同組換えによる修復機構の活性時期であるS期後期からG2期でのマイクロインジェクションでは、ノックインマウスは得られませんでしたが、それよりも早いS期においては70%もの効率でノックインマウスが得られました。
ところが、これほどまでに高効率にノックインマウスが得られるにもかかわらず、ノックインは常に片方の染色体でしか起きていないことが分かりました。これは、マイクロインジェクションの際、二つある前核の片方のみに溶液を注入していることに起因すると考えられたため、両方の前核に対して溶液を注入したところ、ノックイン効率が82%に上昇し、さらにそのうちの40%で両方の染色体でノックインが起きていることが分かりました(図2上段)。また、それぞれの前核へGFP遺伝子とRFP遺伝子(赤色蛍光タンパク質)をマイクロインジェクションすることにより、それぞれの染色体へ異なる遺伝子をノックインすることに成功しました(図2下段)。これらの結果から、ノックインのイベントは、核融合が起こるまでの間に起きていることが示唆されました。
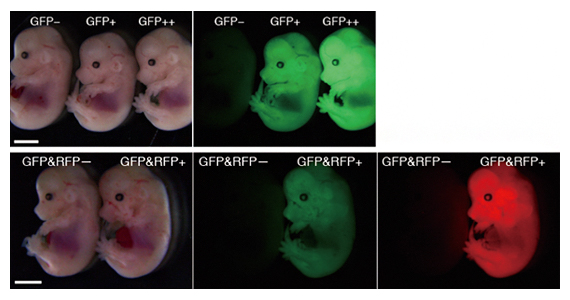
図2 受精後14.5日目のノックインマウスの写真
上段:片方の染色体でノックイン(GFP+)と両方の染色体でノックイン(GPF++)されたマウス。左は明視野で撮影、右はGFPを光らせて撮影した写真。
下段:GFP遺伝子とRFP遺伝子をそれぞれの染色体にノックインしたマウス。左は明視野で撮影、中はGFPを光らせて撮影、右はRFPを光らせて撮影した写真。
HR法は、S期後期からG2期に活性化される相同組換え修復を利用していますが、今回の結果から、受精卵にノックインする場合は、少し前のS期にマイクロインジェクションすることが重要であることが明らかになりました。受精卵では、核融合の際に核膜が一時的に消失します。今回、S期後期からG2期のノックイン効率が著しく下がったことは、マイクロインジェクション後の核膜崩壊により、前核へ注入した溶液が細胞質へと拡散したことが要因ではないかと推測されます。外来遺伝子がゲノムへ挿入されるためには、少なくとも数時間は前核内に外来遺伝子が高濃度で存在することが重要であると考えられます。
今後の期待
本研究では、CRISPR/Cas9システムを用いたノックインマウスの作製効率を飛躍的に向上させることに成功しました。ノックイン効率は、さまざまな要素に左右されますが、特に受精卵の細胞周期に大きく依存しており、マイクロインジェクションのタイミングが重要であることが示されました。
ゲノム編集技術は、世界中で多くの研究者に利用されていることから、本成果はさまざまな生命科学分野における研究を強力に推進するものと期待できます。また、本技術は、マウスだけでなく、他の遺伝子改変動物の作製にも適用できると考えられます。
補足説明
1.ゲノム編集技術
特定のDNA配列を切断できる人工ヌクレアーゼによりゲノムDNAを切断して、ノックアウトやノックインなどの遺伝子改変を行う技術。CRISPR/Cas9システムは人工ヌクレアーゼの一つである。
2.CRISPR/Cas9システム
ゲノム編集技術の一つで、標的ゲノム領域を認識する配列とCas9と複合体を形成する配列からなるgRNA(ガイドRNA)およびヌクレアーゼ活性によりDNAを切断するCas9タンパク質からなる。これらを細胞や受精卵に導入すると、複合体を形成して標的ゲノムを切断する。細胞がこれを修復する際の複製エラーにより、ゲノムに欠失や挿入が起きる。また、切断部位に相同組換えなどにより外来遺伝子をノックインできる。
3.細胞周期
一つの細胞が分裂して二つの娘細胞になるまでを細胞周期と呼び、受精後の卵(一細胞期胚)はG1期’S期(DNAの複製)’G2期’M期(分裂)を経て、二細胞期胚となる。
4.ES細胞(胚性幹細胞)
動物の初期胚が持つ、体を構成する全ての種類の体細胞へ分化する能力を多能性という。多能性を持ち、試験管内で培養して無限に増やすことができる細胞を多能性幹細胞という。ES細胞は、哺乳類の着床前胚(胚盤胞)に存在する内部細胞塊から作製された多能性幹細胞。
5.ジーンターゲッティング法
ここではマウス胚性幹細胞(ES細胞)を用いた遺伝子改変マウスの作製法を意味する。この方法で遺伝子改変に必要なDNA(ベクター)を構築して遺伝子改変を行う。このベクターは標的ゲノム領域周辺と同じ配列や薬剤耐性遺伝子などが含まれており、標的ゲノム領域でベクターが組換わる(相同組換え)ことで遺伝子を任意に改変できる。
6.相同組換えによる修復機構
相同組換えは、DNAの塩基配列がよく似た領域で組み換わる現象。細胞の中には、さまざまな化学物質や放射線によりDNA(染色体)が切断されると、もう片方の染色体の同じ(相同)配列を鋳型として修復する機構がある。本研究では、CRISPR/Cas9により切断された標的ゲノム領域が、似た配列を持つベクターと組換わることを利用して外来遺伝子をノックインした。
研究チーム
理化学研究所 生命機能科学研究センター 生体モデル開発チーム
チームリーダー 清成 寛(きよなり ひろし)
技師 阿部 高也(あべ たかや)
客員研究員 古田 泰秀(ふるた やすひで)
専門技術員 井上 健一(いのうえ けんいち)
原論文情報
Takaya Abe, Ken-ichi Inoue, Yasuhide Furuta, Hiroshi Kiyonari, “Pronuclear Microinjection during S-phase Increases the Efficiency of CRISPR-Cas9-Assisted Knockin of Large DNA Donors in Mouse Zygotes”, Cell Reports, 10.1016/j.celrep.2020.107653
発表者
理化学研究所
生命機能科学研究センター 生体モデル開発チーム
チームリーダー 清成 寛(きよなり ひろし)
技師 阿部 高也(あべ たかや)
報道担当
理化学研究所 広報室 報道担当