2020-09-01 国立がん研究センター,名古屋大学,日本医療研究開発機構
発表のポイント
- 免疫チェックポイント阻害薬(PD-1*1/PD-L1阻害薬)による治療効果を高精度に予測するバイオマーカー(腫瘍浸潤エフェクターT細胞と制御性T細胞上のPD-1発現バランス)を同定しました。治療効果の予測に基づく治療の層別化につながることが期待されます。
- これまで技術的に困難とされた腫瘍浸潤リンパ球の測定・検出方法を企業と共同開発し、本研究で開発されたバイオマーカーの測定を可能としました。この測定・検出方法は、診断キットなどの開発につながることが期待されます。
- 今後、本研究で開発されたバイオマーカーの臨床的有用性を検証する臨床試験へと展開し、がんの免疫療法における精密医療(プレシジョン・メディシン)の実現を目指します。
発表概要
国立研究開発法人国立がん研究センター(理事長:中釜斉、東京都中央区)研究所と名古屋大学などの研究チームは、免疫チェックポイント阻害薬の治療効果を予測するバイオマーカーを同定し、さらにその測定・検出方法を開発しました。今後、臨床での実用化に向けて臨床試験に展開していくことを目指します。
免疫チェックポイント阻害薬を用いた免疫療法は、日本においては2014年に悪性黒色腫で保険適用されて以降、様々ながん種の治療に用いられていますが、治療効果の認められる患者さんが2~3割と少ないことや、一部の患者さんでは重篤な副作用が認められること、さらに医療費が高額であることなどの課題があり、事前に治療効果を予測し効果の見込める患者さんに投与することが求められています。
本研究は、免疫チェックポイント阻害薬(ニボルマブ、ペムブロリズマブもしくはアテゾリズマブ)による治療を受けた悪性黒色腫、肺がん、胃がん患者の治療前の組織標本を用いて、腫瘍浸潤リンパ球に関する詳細な免疫学的解析を行いました。その結果、PD-1発現のバランスがPD-1/PD-L1阻害剤治療効果と相関があること発見し、高い精度で治療効果を予測できることを見出しました。
研究成果は2020年8月31日付(英国時間)米国科学雑誌「Nature Immunology」電子版に掲載されます。
またPD-1発現バランスの測定法の実用化においては、これまで技術的に困難とされた腫瘍浸潤リンパ球の測定・検出方法を企業と共同開発し、大規模な検証が可能となったことから、今後、臨床試験において検証していきます。
本研究は、国立がん研究センター 研究所 腫瘍免疫研究分野、先端医療開発センター 免疫TR分野 西川博嘉 分野長(名古屋大学大学院医学系研究科 微生物・免疫学講座 分子細胞免疫学 教授併任)と、同研究所 細胞情報学分野 間野博行 分野長、同東病院 土井俊彦 副院長、名古屋大学大学院医学系研究科 臨床医薬学講座 生物統計学 松井茂之 教授、株式会社日立製作所らの研究チームで行いました。また、バイオマーカー同定は、小野薬品工業株式会社との共同研究として実施し、同定したバイオマーカーの測定方法は日本べクトン・ディッキンソン株式会社(以下「日本BD」)と共同開発しました。
背景
PD-1/PD-L1阻害剤によるがん治療は、悪性黒色腫、肺がん、胃がんをはじめとした様々ながん種に奏効することが報告された後、臨床現場にがん治療の新たな柱として導入され、がん治療にパラダイムシフトをもたらしました。しかしながら、治療を受けた患者の半数以上がPD-1/PD-L1阻害剤治療に反応しないため、治療効果を精度高く予測するバイオマーカーの同定が必要とされてきました。腫瘍組織におけるPD-L1の発現や腫瘍細胞の体細胞変異*2が有用な効果予測バイオマーカーの候補とされていますが、必ずしも、治療効果と相関するわけではなく、効果予測性能の高い新規バイオマーカーの同定が待たれていました。
PD-1/PD-L1阻害剤治療では、エフェクターT細胞*3(CD8陽性T細胞)に発現するPD-1にPD-L1が結合し、エフェクターT細胞の活性を妨げることで抗腫瘍免疫応答が阻害されます。このことから、PD-1/PD-L1経路(結合)を遮断することで抗腫瘍免疫応答が回復し、腫瘍は小さくなると考えられます。最近の研究からPD-1/PD-L1阻害剤による治療が奏効するためには腫瘍微小環境中にがん抗原を認識して活性化するPD-1陽性エフェクターT細胞が必要である可能性が示唆されています。しかしながら、実臨床でPD-1陽性エフェクターT細胞の量を測定するのに必要な大きさの腫瘍組織を収集することは困難である場合も多く、腫瘍浸潤リンパ球を効果予測バイオマーカーとすることは困難でした。
研究方法・成果
2016年から2019年までに国立がん研究センター中央病院もしくは東病院で進行固形がんと診断されPD-1/PD-L1阻害剤(ニボルマブ、ペムブロリズマブもしくはアテゾリズマブ)で治療を実施された悪性黒色腫(12例)、肺がん(27例)、胃がん(48例)患者を対象として、探索コホート(39例)と検証コホート(48例)の2コホートを設定しました。探索コホートでPD-1/PD-L1阻害剤治療効果予測バイオマーカーを探索しました。また、検証コホートとして当該バイオマーカーを検証しました。これらの患者の中で、PD-1/PD-L1阻害剤治療の最良治療効果判定が、完全奏効、部分奏効もしくは6か月以上の病勢安定であるものを治療奏効例、それ以外の6か月以内の病勢安定もしくは病勢進行を治療不応例と定義しました。腫瘍組織に発現するPD-L1は免疫染色、腫瘍ゲノムにおける体細胞変異数は次世代シークエンサーを用いて解析しました。
また腫瘍浸潤リンパ球の免疫学的な特徴を評価するために、日本BDと共同開発した手法を用いて、治療開始2週間前以内に腫瘍組織生検検体を採取し、腫瘍浸潤リンパ球を抽出し、フローサイトメトリー*4で解析しました。本開発手法により、解析に必要な十分量の腫瘍浸潤リンパ球を腫瘍組織生検検体から効率的に調製することが可能となり、検証を進めました。
探索コホートで腫瘍細胞のPD-L1陽性とPD-1治療奏効の相関を検討したところ、PD-L1陽性患者の中でも治療不応例も認められ、逆にPD-L1陰性患者の中にも治療奏効例が認められたことから、PD-L1は十分なバイオマーカーとは結論できないことが示されました。
そこで、フローサイトメトリーを用いて腫瘍浸潤リンパ球を免疫学的に解析したところ、治療奏効例で腫瘍浸潤エフェクターT細胞上のPD-1発現が有意に高く(図1)、また、腫瘍浸潤エフェクターT細胞上のPD-1発現が高い群では低い群と比較して無増悪生存期間*5は有意に長い結果となりました(図2)。
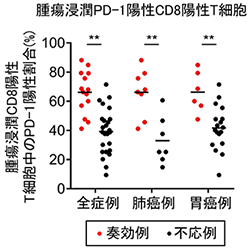
図1.PD-1阻害剤治療奏効例と不応例における腫瘍浸潤エフェクターT細胞(CD8陽性T細胞)上のPD-1発現率の比較検討
フローサイトメトリーを用いて、PD-1/PD-L1阻害剤治療奏効例と不応例における腫瘍浸潤エフェクターT細胞中のPD-1陽性細胞の割合を比較検討しました。PD-1/PD-L1阻害剤治療奏効例(赤点)、不応例(黒点)腫瘍浸潤エフェクターT細胞中のPD-1陽性割合を示しています。全症例、肺がん例、胃がん例ともに統計学的に有意に腫瘍浸潤エフェクターT細胞中のPD-1陽性割合が高いことが判明しました。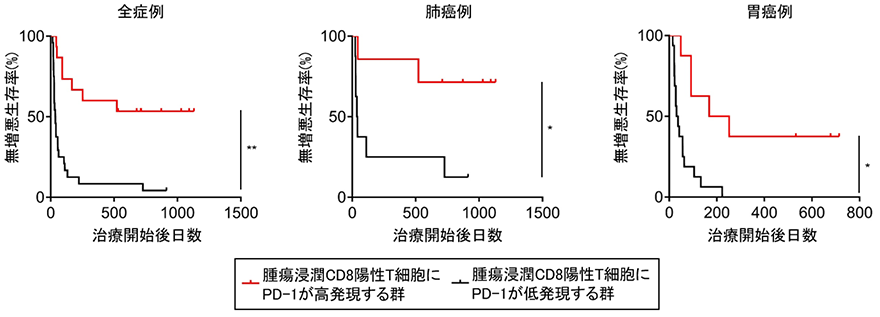 図2.腫瘍浸潤エフェクターT細胞(CD8陽性T細胞)上のPD-1高発現群と低発現群におけるPD-1阻害剤治療後の無増悪生存の比較検討
図2.腫瘍浸潤エフェクターT細胞(CD8陽性T細胞)上のPD-1高発現群と低発現群におけるPD-1阻害剤治療後の無増悪生存の比較検討
腫瘍浸潤エフェクターT細胞上のPD-1高発現群と低発現群の間でPD-1/PD-L1阻害剤治療後の無増悪生存を比較検討しました。全症例、肺がん例、胃がん例において、腫瘍浸潤エフェクターT細胞上のPD-1高発現群(赤線)は統計学的に有意に無増悪生存率が良いことが判明しました。
治療奏効例で腫瘍浸潤エフェクターT細胞上のPD-1発現が有意に高かったものの、一部の症例では腫瘍浸潤エフェクターT細胞上のPD-1発現が高いにもかかわらずPD-1/PD-L1阻害剤治療が奏功しなかったことから、さらなるバイオマーカー探索を続けました。以前に本研究グループは、抗腫瘍免疫応答を抑制する制御性T細胞が腫瘍環境下でPD-1を高発現していることがPD-1阻害剤治療後の急激な増悪に関わることを報告しました(Kamada T et al. PNAS 2019)。そこで、腫瘍浸潤制御性T細胞上のPD-1発現に焦点を当て、PD-1/PD-L1阻害剤治療奏効の関連を検討しました。その結果、エフェクターT細胞とは反対に、治療不応例で腫瘍浸潤制御性T細胞上のPD-1発現が有意に高く(図3)、また、腫瘍浸潤制御性T細胞上のPD-1発現が高い群では低い群と比較して無増悪生存期間は有意に短い結果となりました(図4)。
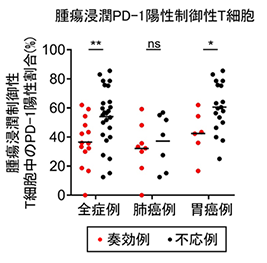
図3.PD-1阻害剤治療奏効例と不応例における腫瘍浸潤制御性T細胞上のPD-1発現率の比較検討フローサイトメトリーを用いて、PD-1/PD-L1阻害剤治療奏効例と不応例における腫瘍浸潤制御性T細胞中のPD-1陽性細胞の割合を比較検討しました。PD-1/PD-L1阻害剤治療奏効例(赤点)、不応例(黒点)腫瘍浸潤制御性T細胞中のPD-1陽性割合を示しています。胃がん例において統計学的に有意に腫瘍浸潤制御性T細胞中のPD-1陽性割合が低いことが判明しました。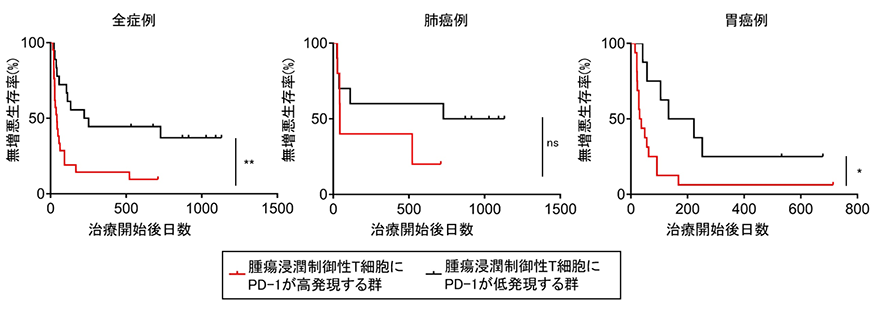 図4.腫瘍浸潤制御性T細胞上のPD-1高発現群と低発現群におけるPD-1阻害剤治療後の無増悪生存の比較検討腫瘍浸潤制御性T細胞上のPD-1高発現群と低発現群の間でPD-1/PD-L1阻害剤治療後の無増悪生存を比較検討しました。胃がん例において、腫瘍浸潤制御性T細胞上のPD-1高発現群(赤線)は統計学的に有意に無増悪生存率が悪いことが判明しました。
図4.腫瘍浸潤制御性T細胞上のPD-1高発現群と低発現群におけるPD-1阻害剤治療後の無増悪生存の比較検討腫瘍浸潤制御性T細胞上のPD-1高発現群と低発現群の間でPD-1/PD-L1阻害剤治療後の無増悪生存を比較検討しました。胃がん例において、腫瘍浸潤制御性T細胞上のPD-1高発現群(赤線)は統計学的に有意に無増悪生存率が悪いことが判明しました。
エフェクターT細胞と制御性T細胞上のPD-1発現がPD-1/PD-L1阻害剤の治療効果と相関することが示されましたが、他の免疫細胞および分子の治療効果との相関も検討するため、114項目のパラメーターについてディープラーニングを用いて治療効果の判定に関連する重要因子を特定しました。その中で、PD-1陽性エフェクターT細胞(PD-1陽性CD8陽性T細胞)とPD-1陽性制御性T細胞のペアが上位1位にランキングされました(表1)。以上のことからこれらの2つの因子がPD-1/PD-L1阻害剤の治療効果予測に極めて重要であることが明らかになりました。
表1.ディープラーニング(deep learning)を用いた免疫細胞および分子のPD-1/PD-L1阻害剤治療効果との相関についての検討
| 順位 | 項目1 | 項目2 | AUC | |
|---|---|---|---|---|
| 探索コホート | 検証コホート | |||
| 1 | 制御性T細胞中のPD-1陽性割合 | CD8陽性T細胞中のPD-1陽性割合 | 0.933 | 0.954 |
| 2 | PD-1陽性CD4陽性T細胞中のCCR7陽性割合 | CD8陽性T細胞中のPD-1陽性割合 | 0.918 | 0.854 |
| 3 | PD-1陽性CD3陽性T細胞中のEomes陽性割合 | CD8陽性T細胞中のPD-1陽性割合 | 0.892 | 0.911 |
| 4 | CD4陽性T細胞中のPD-1陽性割合 | CD8陽性T細胞中のPD-1陽性割合 | 0.889 | 0.914 |
| 5 | CD3陽性T細胞中のセントラルメモリーの割合 | CD8陽性T細胞中のPD-1陽性割合 | 0.887 | 0.889 |
AUC(area under curve):予測精度を表す統計指標(0:低精度~1:高精度)
免疫細胞および分子とPD-1/PD-L1阻害剤治療効果との相関を評価するため、フローサイトメトリーを用いて評価した114項目のパラメーターについてディープラーニングにより検討し、高い相関を示したペア上位5組を示しました。
PD-1/PD-L1阻害剤の治療効果阻害剤治療の効果予測バイオマーカーをより詳細に探索するために、腫瘍浸潤リンパ球をフローサイトメトリーで解析した結果得られた114項目のパラメーターを基にしてAIによる機械学習をさらに実施したところ、腫瘍浸潤エフェクターT細胞に発現するPD-1陽性率と制御性T細胞に発現するPD-1陽性率の比率が最もPD-1/PD-L1阻害剤の治療効果阻害剤治療の治療効果を予測するバイオマーカーとして同定されました。AIによる機械学習により同定されたバイオマーカーを基にして、腫瘍浸潤エフェクターT細胞上にPD-1が40%以上発現し、かつ、腫瘍浸潤制御性T細胞よりエフェクターT細胞優位にPD-1が発現するグループをGroup Rと定義しました(図5)。
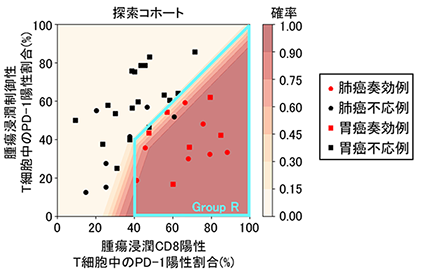
図5.PD-1/PD-L1阻害剤治療奏効例と不応例における腫瘍浸潤エフェクターT細胞(CD8陽性T細胞)と制御性T細胞上のPD-1発現率の検討
探索コホート内、フローサイトメトリーを用いて、PD-1/PD-L1阻害剤治療奏効例と不応例における腫瘍浸潤エフェクターT細胞と制御性T細胞中のPD-1陽性細胞の割合を評価し、縦軸に腫瘍浸潤制御性T細胞中のPD-1陽性割合、横軸に腫瘍浸潤エフェクターT細胞中のPD-1陽性割合を取り、プロットしました。Deep learningが導き出した奏効を予想する確率の分布を基に腫瘍浸潤エフェクターT細胞上にPD-1が40%以上発現し、かつ、腫瘍浸潤制御性T細胞よりエフェクターT細胞優位にPD-1が発現するグループをGroup R(水色の線で囲んだ部分)と定義しました。
探索コホートのGroup Rでは無増悪生存期間は有意に長い結果となりました(図6)。また、この結果は検証コホートでも検証され、非常に有用なバイオマーカーとなる可能性が示唆されました(図7)。
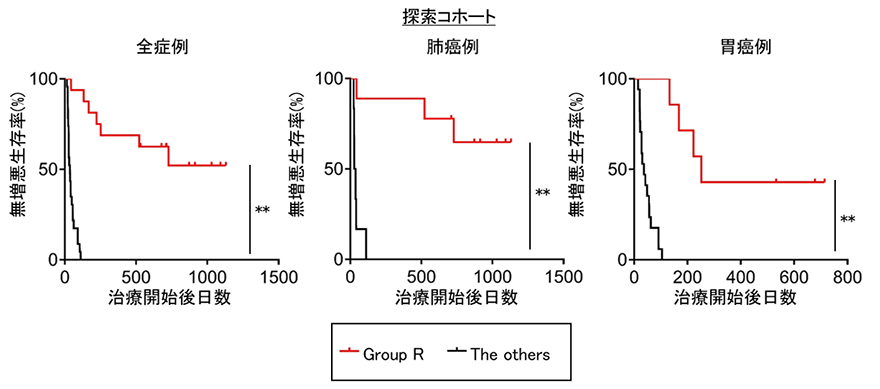 図6.探索コホートにおけるGroup RのPD-1/PD-L1阻害剤治療後の無増悪生存の検討探索コホート内、Group RのPD-1/PD-L1阻害剤治療後の無増悪生存を検討しました。全症例、肺がん例、胃がん例において、統計学的に有意にGroup Rの無増悪生存率が良いことが判明しました。
図6.探索コホートにおけるGroup RのPD-1/PD-L1阻害剤治療後の無増悪生存の検討探索コホート内、Group RのPD-1/PD-L1阻害剤治療後の無増悪生存を検討しました。全症例、肺がん例、胃がん例において、統計学的に有意にGroup Rの無増悪生存率が良いことが判明しました。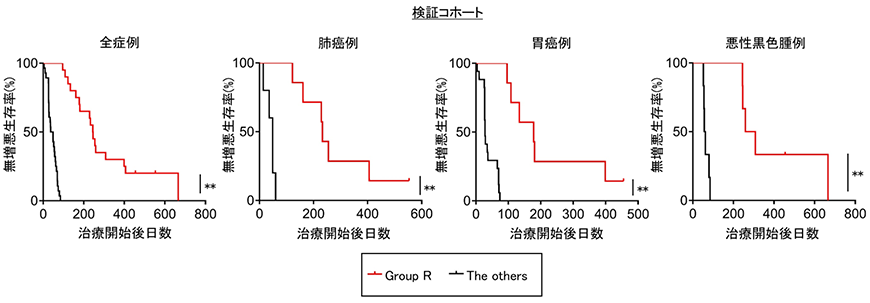 図7.検証コホートにおけるGroup RのPD-1/PD-L1阻害剤治療後の無増悪生存の検討検証コホート内、Group RのPD-1/PD-L1阻害剤治療後の無増悪生存を検討しました。全症例、肺がん例、胃がん例、悪性黒色腫例において、統計学的に有意にGroup Rの無増悪生存率が良いことが判明しました。
図7.検証コホートにおけるGroup RのPD-1/PD-L1阻害剤治療後の無増悪生存の検討検証コホート内、Group RのPD-1/PD-L1阻害剤治療後の無増悪生存を検討しました。全症例、肺がん例、胃がん例、悪性黒色腫例において、統計学的に有意にGroup Rの無増悪生存率が良いことが判明しました。
以上の結果から、今回本研究グループが同定したバイオマーカーは、腫瘍組織のPD-L1発現や腫瘍細胞の体細胞変異数などこれまで報告された治療効果予測バイオマーカーと比較して、より高精度にPD-1/PD-L1阻害剤治療の効果を予測できる可能性が示唆されました。
研究結果のまとめ
本研究により、腫瘍浸潤エフェクターT細胞と制御性T細胞上のPD-1発現バランスがPD-1/PD-L1阻害剤治療の治療効果と相関しており、これらを測定することで高い精度で治療効果を予測できることがわかりました。本バイオマーカーは、PD-1/PD-L1阻害剤治療を実施した肺がん及び胃がん以外の進行固形悪性腫瘍患者サンプルの解析においても、エフェクターT細胞上のPD-1発現がより高く、制御性T細胞上のPD-1発現がより低い症例でPD-1/PD-L1阻害剤治療が奏効することが確認されました。
また、日本BDと共同開発した腫瘍組織生検検体から腫瘍浸潤リンパ球を調製する手法が実用化可能であることも示されました。
展望
これまで、PD-1/PD-L1阻害剤治療は様々ながん種において、治療効果が証明されてきました。その一方で、これまでの臨床試験の結果、がん種によってはPD-1/PD-L1阻害剤治療の有用性を証明されなかった例もあります。この一因として、有用な治療効果予測バイオマーカーがなかったことが挙げられます。さらに肺がんなどの治療においては、PD-1/PD-L1阻害剤単剤で治療効果が見られる可能性がある患者も適切なバイオマーカーが存在しないため、有害事象の発生頻度が高くなるがん免疫併用療法が実施されています。
今後、本研究グループが同定した治療効果予測バイオマーカーを使用することで、PD-1/PD-L1阻害剤治療の効果が期待できる症例を高精度に予測し、より精密な個別化医療の実現が期待できます。国立がん研究センターでは、新たに開発した測定方法を用い、臨床での検証を進めます。
発表論文
- 雑誌名
- Nature Immunology
- タイトル
- The PD-1 expression balance between effector and regulatory T cells predicts the clinical efficacy of PD-1 blockade therapies
- 著者
- Shogo Kumagai1,2,11, Yosuke Togashi1,11, Takahiro Kamada1,2,11, Eri Sugiyama1,2, Hitomi Nishinakamura1, Yoshiko Takeuchi1, Kochin Vitaly2, Kota Itahashi1,Yuka Maeda1, Shigeyuki Matsui3, Takuma Shibahara4, Yasuho Yamashita4, Takuma Irie1, Ayaka Tsuge1,2, Shota Fukuoka1, Akihito Kawazoe5, Hibiki Udagawa6, Keisuke Kirita6, Keiju Aokage7, Genichiro Ishii8, Takeshi Kuwata8, Kenta Nakama9, Masahito Kawazu10, Toshihide Ueno10, Naoya Yamazaki9, Koichi Goto6, Masahiro Tsuboi7, Hiroyuki Mano10, Toshihiko Doi5, Kohei Shitara5 and Hiroyoshi Nishikawa1,2*
- 所属
- 1Division of Cancer Immunology, Research Institute/Exploratory Oncology Research & Clinical Trial Center (EPOC), National Cancer Center, Tokyo 104-0045/Chiba 277-8577, Japan, 2Department of Immunology, 3Department of Biostatics, Nagoya University Graduate School of Medicine, Nagoya 466–8550, Japan, 4Research and Development Group Hitachi Limited, Tokyo 185-8601, Japan. 5Department of Gastroenterology and Gastrointestinal Oncology, 6Department of Thoracic Oncology, 7Department of Thoracic Surgery and 8Pathology and Clinical Laboratories, National Cancer Center Hospital East, Chiba 277-8577, Japan, 9Department of Dermatologic Oncology, National Cancer Center Hospital, Tokyo 104-0045, Japan, 10Division of Cellular Signaling, National Cancer Center Research Institute, Tokyo 104-0045, Japan.11These authors contributed equally to this study.
- DOI:
- 10.1038/s41590-020-0769-3
- 掲載日:
- 2020年8月31日付(英国時間)
- URL
- https://www.nature.com/articles/s41590-020-0769-3
主な公的研究費
国立研究開発法人日本医療研究開発機構
研究事業名:次世代がん医療創生研究事業
研究課題名:がん細胞および免疫応答解析に基づくがん免疫療法効果予測診断法の確立
用語解説
- *1 PD-1
- PD-1は免疫細胞上に発現する免疫チェックポイント分子であり、樹状細胞やがん細胞に発現するPD-L1やPD-L2と結合することで、免疫細胞の働きを抑制します。PD-1/PD-L1阻害剤治療によりPD-1がPD-L1と結合しなくなることで、免疫細胞が本来の働きを取り戻し、がん細胞を攻撃するようになると考えられています。
- *2 腫瘍体細胞変異
- 腫瘍体細胞変異は遺伝的なDNAの変異とは違い、腫瘍が分化、成長する中で、後天的に獲得したDNA変異のことを指します。がんを引き起こす働きのある体細胞変異(ドライバー遺伝子変異)を特定することもできます。腫瘍体細胞変異が多いとT細胞から非自己と認識されやすくなり、攻撃を受けやすくなるのではないかと考えられています。
- *3 エフェクターT細胞と制御性T細胞
- エフェクターT細胞:体内の免疫細胞の内、サイトカイン等を産生して標的細胞の排除に関わる細胞。特に抗腫瘍免疫応答ではCD8陽性のT細胞集団が、標的抗原を発現する細胞を殺傷します。抗腫瘍免疫応答においては、がん細胞に発現するがん抗原を認識してがん細胞を殺傷すると考えられています。
- 制御性T細胞:体内のCD4陽性細胞の中でFoxP3を強く発現するT細胞集団で、抗腫瘍免疫応答を含めたエフェクターT細胞による免疫応答を抑制する働きがあります。抗腫瘍免疫応答以外にも体内で起こる様々な免疫応答を抑制して免疫系の恒常性を維持しています。
- *4 フローサイトメトリー
- フローサイトメトリーは主に細胞一つ一つのタイプを評価するために用いられるシステムであり免疫学の分野では古くから用いられてきました。細胞に発現する分子に抗体で蛍光物質を標識し、一定波長のレーザー光を細胞に当てます。その際にレーザー光によって生じた蛍光を検出器で検出し、細胞に発現する20種類以上の分子の発現の強さを同時に評価することができます。
- *5 無増悪生存期間
- 無増悪生存期間は、ある薬剤の治療を始めた日から、がんの病勢が悪化するか、患者さんが亡くなった日までの期間と定義されます。特にがんに対する薬剤の効果を評価するための指標で、無増悪生存期間が長いほど薬剤の効果があると考えられます。
お問い合わせ先
研究に関する問い合わせ
国立研究開発法人国立がん研究センター
研究所 腫瘍免疫研究分野・先端医療開発センター 免疫TR分野
担当者名:西川博嘉
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課