2020-12-18 名古屋大学,日本医療研究開発機構
名古屋大学医学部附属病院先端医療開発部/同大医学系研究科精神医学の有岡祐子特任講師、同大医学系研究科精神医学の尾崎紀夫教授らの研究グループは、iPS細胞※1を用いた解析から、指定難病の一つである22q11.2欠失症候群(22q11.2DS)※2の脳内分子病態として、「中脳ドパミン神経細胞※3におけるPRKR-Like Endoplasmic Reticulum Kinase(PERK)※4依存的な脆弱性」を見出しました。
22q11.2DS患者は、各ライフステージに応じて、知的能力障害、自閉スペクトラム症、注意欠如・多動症、統合失調症、若年型パーキンソン病など多様な精神・神経疾患を発症します。しかしながら、患者の脳の中で何が起きているのかを、直接分子・細胞レベルで調べる方法がないことから、22q11.2DSの脳内病態は不明な点が多く残されています。
これまでの22q11.2DSの脳内病態解明を目指した研究の多くは、精神疾患との関連だけに着目しているものでした。今回、精神疾患だけではなく、神経疾患であるパーキンソン病との関連にも着目して検討するため、両疾患に深く関連する中脳ドパミン神経細胞を解析対象としました。22q11.2DS患者と健常者に協力を得て、樹立したiPS細胞からドパミン神経細胞を作製し、健常者と患者の違いを調べました。健常者と患者のタンパク質発現を網羅的に比較したところ、患者では、小胞体※5の機能に関わるタンパク質群の発現が低下しており、特にPERKというタンパク質の顕著な機能不全が生じていました。このPERKの機能不全を回復させることで、患者で認められた様々な細胞脆弱性の一部が改善できることがわかりました。
22q11.2DS患者は、生涯にわたり多様な精神・神経疾患の発症リスクを抱え続けます。当事者・ご家族から「22q11.2欠失が同定され、発症の可能性が分かっているのであれば、進展を止める方法の開発を」との想いを伺っています。本研究成果は、22q11.2DS患者の精神・神経疾患に対する治療薬開発や将来的な発症予防、即ち当事者・ご家族の想いに応えること、さらに多様な精神・神経疾患の病態解明と根本的治療法開発へ貢献することが期待されます。
この研究成果は、The LancetとCell pressが共同発行している雑誌「EBioMedicine」(2020年12月17日付け)の電子版に掲載されます。本研究結果は、革新的技術による脳機能ネットワークの全容解明プロジェクト(革新脳)、脳科学研究戦略推進プログラム(発達障害・統合失調症等の克服に関する研究)の支援を受けて行われました。
ポイント
- 22q11.2欠失症候群(22q11.2DS)患者は、各ライフステージに応じて多様な精神・神経疾患を発症します。しかし、患者の脳の中で何が起きているのかを、直接分子・細胞レベルで調べる方法がないことから、22q11.2DSによって脳内に何が起こり、発症に繫がるのかは未だ不明な点が多く残されています。
- 22q11.2DS患者と健常者に協力を得て、樹立したiPS細胞を用いて中脳に多いドパミン神経細胞を作製し、健常者と患者の違いを調べました。
- 22q11.2DS患者のドパミン神経細胞では、PRKR-Like Endoplasmic Reticulum Kinase(PERK)の機能不全によって様々な脆弱性が生じていることが明らかになりました。
- 本研究成果は、22q11.2DS患者の精神・神経疾患の病態解明だけではなく、将来的な発症予防や根本的治療法開発に繫がることが期待されます。
背景
22q11.2欠失症候群(22q11.2DS)は、脳をはじめ心循環系、免疫系、内分泌系など複数の臓器に影響を及ぼします。その結果、22q11.DS患者は各ライフステージに応じて、多臓器疾患とともに知的能力障害、自閉スペクトラム症、注意欠如・多動症、統合失調症、若年型パーキンソン病など多様な精神・神経疾患を発症します。しかし、患者の脳の中で何が起きているのかを、直接分子・細胞レベルで調べる方法がないことから、22q11.2DSの脳内病態は未だ不明な点が多く残されています。そのため、22q11.2DS患者は精神・神経疾患を発症する可能性が分かっているにもかかわらず、今後起こり得る疾患発症の予防や、疾患の進行を止める方法がないのが現状です。
研究成果
これまでの22q11.2DSの脳病態解明に向けた研究では、精神疾患との関連のみに焦点づけられていることが多く、そのため脳領域として大脳皮質※6や海馬※7を対象とした研究が大半でした。今回、精神疾患だけではなく、パーキンソン病との関連も検討するため、両疾患に深く関連する中脳ドパミン神経細胞を解析対象とし、健常者と22q11.2DS患者から樹立したiPS細胞を用いてドパミン神経細胞を作製し、健常者と患者の違いを調べました。
患者と健常者のiPS細胞由来のドパミン神経細胞について、タンパク質発現を網羅的に比較したところ、患者では、小胞体の機能に関わるタンパク質群の発現が低下していました。小胞体には様々な生理的ストレス(=小胞体ストレス※8)を受けた場合でも、恒常性を維持するためのシステムが備わっていますが、患者ではこれらのシステムに異常があることが予想されました。そこで、小胞体ストレス応答に関わるタンパク質やその関連シグナルを詳細に解析したところ、特にPERKというタンパク質の発現低下とともにその下流シグナルの活性化が低下しており、PERKの顕著な機能不全が生じていることがわかりました。これに一致するように、患者のドパミン神経細胞では、小胞体ストレスへの耐性が低下していました。さらに、F-アクチン※9動態の異常や小胞体―ミトコンドリアの接触※10低下、タンパク質合成低下といった、精神・神経疾患の病態を反映するような表現型異常が認められました。これらの一部は、PERKの機能不全を回復させる(PERK活性剤であるSalubrinalの添加)ことで改善できることがわかりました(図1)。
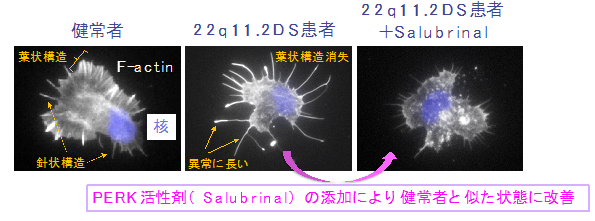
図1 患者におけるF-アクチン動態異常とPERK活性化による改善
- 患者では健常者に比べてF-アクチン動態異常(葉状構造が消失して針状構造が長い)を示した。
- PERKの活性化によって改善が認められた。
次に、どうして22q11.2DSではPERKの発現が低下するかを調べました。22q11.2DSでは、40以上の遺伝子がヘテロ欠失※11になっています。これら遺伝子のうち、DGCR14と呼ばれる遺伝子が低下すると、PERKの発現が低くなることがわかりました。DGCR14遺伝子のヘテロ欠失が、PERKの機能不全に関与している可能性が示唆されました(図2)。
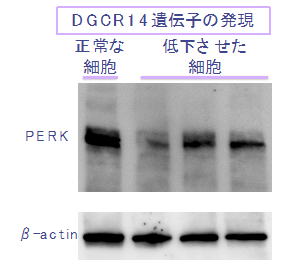
図2 DGCR14遺伝子とPERKタンパク質
DGCR14遺伝子の発現を低下させた細胞ではPERKタンパク質の発現が低下していた。
今後の展開
本研究成果は、22q11.2DS患者で生じる精神・神経疾患の脳内分子病態として「ドパミン神経細胞におけるPERK依存的な脆弱性」の存在を示したものです(図3)。22q11.2DS患者の精神・神経疾患に対する病態に基づく治療薬の開発や、将来に生じ得る精神・神経疾患の発症予防法の開発につながる一歩と考えております。さらには多様な精神・神経疾患の病態解明と根本的治療法開発へ貢献することが期待されます。
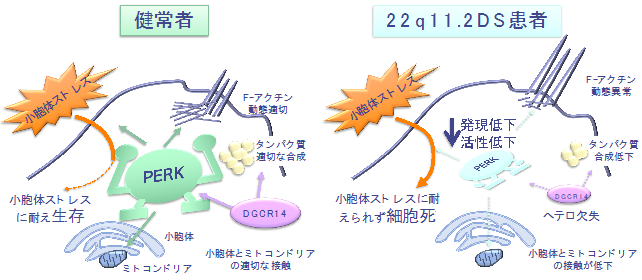
図3 ドパミン神経細胞におけるPERK依存的な脆弱性
用語説明
- ※1 iPS細胞
- 様々な組織や臓器の細胞に分化する能力とほぼ無限に増殖する能力をもつ細胞。血液などの体細胞からつくることができる。
- ※2 22q11.2欠失症候群
- 染色体微細欠失症候群に含まれる指定難病で、4000人の1人の割合で同定される。多臓器に及ぶ幅広い臨床像を示す。半数以上が先天性心疾患を合併し、幼少期に手術的治療を必要とする場合が多い。同患者は心臓手術により生存し得ても、約90%が知的能力障害、更に自閉スペクトラム症や統合失調症などの精神疾患に加えて、若年型パーキンソン病などの神経変性疾患、といった多様な精神・神経疾患発症の高いリスクを有する。
- ※3 中脳ドパミン神経細胞
- 脳を構成する神経細胞の一種。中脳でつくられる。成熟すると神経伝達物質であるドパミンを分泌する。中脳のドパミン神経細胞が失われ、ドパミン産生量が減少するとパーキンソン病が発症する。中脳ドパミン神経系の機能(意欲や感情)障害は多くの精神疾患にも深く関わっている。
- ※4 PRKR-Like Endoplasmic Reticulum Kinase(PERK)
- 小胞体のストレスセンサータンパク質のひとつ。小胞体が生理的ストレスを受けると、恒常性を維持しようとして、PERKのシグナルが活性化する。近年では、PERKは認知や記憶、回路形成などの神経機能にも関与していることが報告されている。
- ※5 小胞体
- 細胞小器官のひとつ。タンパク質の様々なプロセシングに関与している。
- ※6 大脳皮質
- 脳領域のひとつ。認知・判断・言語などといったヒトの高度な精神機能を担う領域と考えられている。
- ※7 海馬
- 脳領域のひとつ。記憶や学習能力を担う領域と考えられている。
- ※8 小胞体ストレス
- 変性したタンパク質が小胞体に蓄積するなどの小胞体への刺激のこと。正常な細胞では小胞体ストレスを回避するシステムが備わっている。そのシステムのひとつをPERKは担っている。
- ※9 F-アクチン
- 細胞骨格のひとつ。シナプス形成や神経回路構築に関与する。
- ※10 小胞体―ミトコンドリアの接触
- 小胞体とミトコンドリアは、接触することでカルシウムなど様々な物質の受け渡しやコミュニケーションを行っている。この接触に関わる異常が精神・神経疾患の発症に関与するといわれている。
- ※11 ヘテロ欠失
- 我々は両親から1セットずつの遺伝情報を受け継いでいる。そのうちの片方が欠けている状態をヘテロ欠失という。
発表雑誌
- 掲載誌名
- EBioMedicine
- 論文タイトル
- Chromosome 22q11.2 deletion causes PERK-dependent vulnerability in dopaminergic neurons
- 著者
- Yuko Arioka1, 2, 3, Emiko Shishido1, 4, Itaru Kushima1, 5, Toshiaki Suzuki1, Ryo Saito6, Atsu Aiba6, Daisuke Mori1, 7, Norio Ozaki1
- 所属
-
- Department of Psychiatry, Nagoya University Graduate School of Medicine, Nagoya, Japan
- Center for Advanced Medicine and Clinical Research, Nagoya University Hospital, Nagoya, Japan
- Institute for Advanced Research, Nagoya University, Nagoya, Japan
- National Institute for Physiological Sciences, Okazaki, Japan
- Medical Genomics Center, Nagoya University Hospital, Nagoya, Japan
- Laboratory of Animal Resources, Center for Disease Biology and Integrative Medicine, Graduate School of Medicine, The University of Tokyo, Tokyo, Japan
- Brain and Mind Research Center, Nagoya University, Nagoya, Japan
- DOI
- 10.1016/j.ebiom.2020.103138
当リリースに関してこれまでに報告した国際科学論文
「22q11.2欠失」
- ゲノム解析:
- Kushima I, Aleksic B, Nakatochi M, Shimamura T, Okada T, Uno Y, Morikawa M, Ishizuka K, Shiino T, Kimura H, Arioka Y, Yoshimi A, Takasaki Y, Yu Y, Nakamura Y, Yamamoto M, Iidaka T, Iritani S, Inada T, Ogawa N, Shishido E, Torii Y, Kawano N, Omura Y, Yoshikawa T, Uchiyama T, Yamamoto T, Ikeda M, Hashimoto R, Yamamori H, Yasuda Y, Someya T, Watanabe Y, Egawa J, Nunokawa A, Itokawa M, Arai M, Miyashita M, Kobori A, Suzuki M, Takahashi T, Usami M, Kodaira M, Watanabe K, Sasaki T, Kuwabara H, Tochigi M, Nishimura F, Yamasue H, Eriguchi Y, Benner S, Kojima M, Yassin W, Munesue T, Yokoyama S, Kimura R, Funabiki Y, Kosaka H, Ishitobi M, Ohmori T, Numata S, Yoshikawa T, Toyota T, Yamakawa K, Suzuki T, Inoue Y, Nakaoka K, Goto YI, Inagaki M, Hashimoto N, Kusumi I, Son S, Murai T, Ikegame T, Okada N, Kasai K, Kunimoto S, Mori D, Iwata N, *Ozaki N, Comparative Analyses of Copy-Number Variation in Autism Spectrum Disorder and Schizophrenia Reveal Etiological Overlap and Biological Insights, Cell Rep 24 (11):2838-2856 (2018)
- モデルマウス:
- Saito R, Koebis M, Nagai T, Shimizu K, Liao J, Wulaer B, Sugaya Y, Nagahama K, Uesaka N, Kushima I, Mori D, Maruyama K, Nakao K, Kurihara H, Yamada K, Kano M, Fukada Y, Ozaki N, Aiba A, Comprehensive analysis of a novel mouse model of the 22q11.2 deletion syndrome: a model with the most common 3.0-Mb deletion at the human 22q11.2 locus, Transl Psychiatry 10 (1):35 (2020)
- 死後脳:
- Torii Y, Iritani S, Marui T, Sekiguchi H, Habuchi C, Fujishiro H, Kushima I, Oshima K, Niizato K, Hayashida S, Masaki K, Kira JI, Yoshida M, Ozaki N, Morphological alteration of myelin-oligodendrocytes in a schizophrenic patient with 22q11.2 deletion syndrome: An autopsy study, Schizophr Res (in press)
「精神疾患発症リスクゲノム変異を有する患者iPS細胞の解析」
- RELN:
- Arioka Y, Shishido E, Kubo H, Kushima I, Yoshimi A, Kimura H, Ishizuka K, Aleksic B, Maeda T, Ishikawa M, Kuzumaki N, Okano H, Mori D, Ozaki N, Single-cell trajectory analysis of human homogenous neurons carrying a rare RELN variant, Transl Psychiatry 8 (1):129 (2018)
Arioka Y, Shishido E, Kushima I, Mori D, Ozaki N, Cell body shape and directional movement stability in human-induced pluripotent stem cell-derived dopaminergic neurons, Sci Rep 10 (1):5820 (2020) - ARHGAP10:
- Sekiguchi M, Sobue A, Kushima I, Wang C, Arioka Y, Kato H, Kodama A, Kubo H, Ito N, Sawahata M, Hada K, Ikeda R, Shinno M, Mizukoshi C, Tsujimura K, Yoshimi A, Ishizuka K, Takasaki Y, Kimura H, Xing J, Yu Y, Yamamoto M, Okada T, Shishido E, Inada T, Nakatochi M, Takano T, Kuroda K, Amano M, Aleksic B, Yamomoto T, Sakuma T, Aida T, Tanaka K, Hashimoto R, Arai M, Ikeda M, Iwata N, Shimamura T, Nagai T, Nabeshima T, Kaibuchi K, *Yamada K, *Mori D, Ozaki N, ARHGAP10, which encodes Rho GTPase-activating protein 10, is a novel gene for schizophrenia risk, Transl Psychiatry 10 (1):247 (2020)
- PCDH15:
- Ishii T, Ishikawa M, Fujimori K, Maeda T, Kushima I, Arioka Y, Mori D, Nakatake Y, Yamagata B, Nio S, Kato TA, Yang N, Wernig M, Kanba S, Mimura M, Ozaki N, Okano H, In Vitro Modeling of the Bipolar Disorder and Schizophrenia Using Patient-Derived Induced Pluripotent Stem Cells with Copy Number Variations of PCDH15 and RELN, eNeuro 6 (5):(2019)
お問い合わせ先
研究について
名古屋大学医学部・医学系研究科
精神医学 教授 尾崎紀夫
広報担当
名古屋大学医学部・医学系研究科総務課総務係
AMED事業について
国立研究開発法人日本医療研究開発機構
疾患基礎研究事業部疾患基礎研究課
革新的技術による脳機能ネットワークの全容解明プロジェクト
脳科学研究戦略推進プログラム