2021-06-04 基礎生物学研究所.生命創成探究センター,中央大学,京都大学,理化学研究所
生き物の形が正しく作られるには、細胞が自らの位置を正しく認識する必要があります。このとき、細胞同士がコミュニケーションを取る必要があり、このためにある種の蛋白質を分泌して、細胞外での濃度の違いにより位置の情報を決めていることが知られています。しかし、どのように場所による濃度の違いが作られるかはよく分かっていませんでした。
自然科学研究機構 基礎生物学研究所/生命創成探究センターの三井優輔助教と高田慎治教授、中央大学の平良眞規博士らは、位置情報を担う蛋白質の一つであるWnt8の細胞外での動きを、生きたカエル胚の中で詳細に解析しました。理化学研究所の佐甲靖志主任研究員らとの共同研究による定量的解析から、Wnt8蛋白質のうち、動いている分子は少数で、大部分は細胞表面に結合して動かないことが示唆されました。これらの動く分子と動かない分子は動的な平衡状態(つまり絶えず入れ替わっている)にあることが実験から推察されました。これをもとに、京都大学の望月敦史教授らとの共同研究として、他の多くの分泌性の蛋白質の分布にも適用できるシンプルな数理モデルを構築し、挙動を体系的に理解する枠組みを提案しました。これにより、少数の動く分子と多数の動かない分子によって、Wnt8蛋白質の分布が素早く、安定的に作られうることが示されました。この分布ができる時の速さと安定性のジレンマは、拡散現象が関わることから、以前からどのように両立しているのか議論があったところですが、今回の研究はその仕組みの一端を明らかにしました。この成果はeLife誌に掲載されました。
【研究の背景】
多細胞生物が秩序だった形をつくるためには、細胞の位置情報が必要だと考えられます。この為に、細胞外に分泌され、細胞にシグナルを送る分泌性の蛋白質が働いていることが知られています。このような蛋白質は「モルフォゲン」(形をつくるもと)と呼ばれ、初期胚のなかでも場所によって濃度が異なる(濃度勾配と呼ばれる)と考えられています。本研究チームは以前の研究で、モルフォゲンの一つであるWnt8蛋白質がアフリカツメガエル胚の中でどのように分布しているかを可視化することに成功し、実際に濃度勾配が存在することを明らかにしました。しかしながらWnt8を含めて、モルフォゲン全般がどのように初期胚の中で広がっていくのか、その仕組みの理解は未だ十分ではありません。Wnt8のような分泌性蛋白質は細胞外で拡散することが以前から想定されてきました。一方、三井らによる以前の研究では糖鎖分子の一つ、ヘパラン硫酸鎖が細胞表面でクラスター構造を作り、そこにWnt8が結合することで、細胞表面に点状に分布することを発見していましたが、このような局所的に集積し、連続していない分布が、これまで想定されてきた拡散現象からどのように作られるか、という新たな問題が見いだされました。
【研究の成果】
本研究では、アフリカツメガエル胚を生きたまま観察する「ライブイメージング」を中心に、定量的な解析法や顕微鏡法を駆使してWnt8蛋白質がどのように振る舞うのかを明らかにしました。
①分泌性蛋白質の分布が「見える」のは細胞表面に結合しているから。自由に拡散する分子は見えないことを定性的実験で示した。
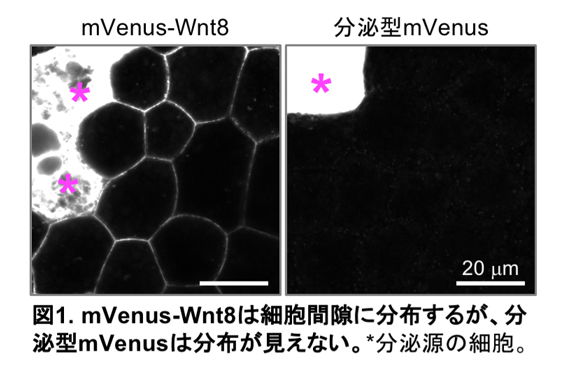
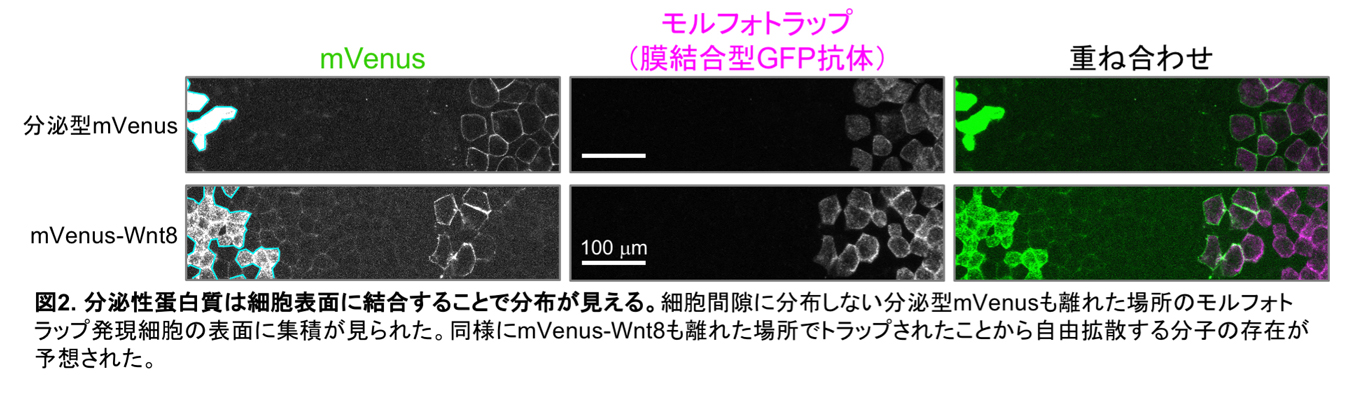
ライブイメージングで、Wnt8蛋白質を可視化する為、蛍光蛋白質をWnt8に融合したもの(mVenus-Wnt8)を作成し、ツメガエル胚で発現させたところ、分泌源の近くでは細胞間隙に分布が見られました(図1左)。一方、蛍光蛋白質(mVenus)のみを分泌させたところ、分泌源の近くでも細胞間隙の分布は見られませんでした(図1右)。この結果から分泌型のmVenusは細胞表面への結合能がないから分布できないのではないかと予想し、それを検証する為に人為的にmVenusを細胞表面にトラップさせる分子「モルフォトラップ」を用いました。これはGFPやmVenusに結合できる抗体を細胞膜から外側に向かって突き出した分子で、周囲に拡散している分子が存在すればそれをトラップすることができます。このモルフォトラップを分泌源から15細胞程度(およそ200µm)離れたところで発現させたところ、予想通り分泌型mVenusがモルフォトラップ発現細胞上に集積するのが観察されました(図2上)。このことから、細胞間隙での分布には細胞表面への結合が必要かつ十分であることが定性的実験から示されました。一方、mVenus-Wnt8はやはり分泌源近傍の細胞間隙で分布が見られましたが、離れた場所のモルフォトラップはmVenus-Wnt8も集積させることが分かりました(図2下)。ここから、mVenus-Wnt8の少なくとも一部の分子は離れたところまで移動しうることが示され、それが自由拡散によるのではないかと推測しました。
 ②定量的解析によって、mVenus-Wnt8の一部が自由拡散することを示した。一方、残りの大部分は細胞表面に結合しているが、自由拡散成分と細胞表面結合成分は入れ替わっていることが示唆された。
②定量的解析によって、mVenus-Wnt8の一部が自由拡散することを示した。一方、残りの大部分は細胞表面に結合しているが、自由拡散成分と細胞表面結合成分は入れ替わっていることが示唆された。
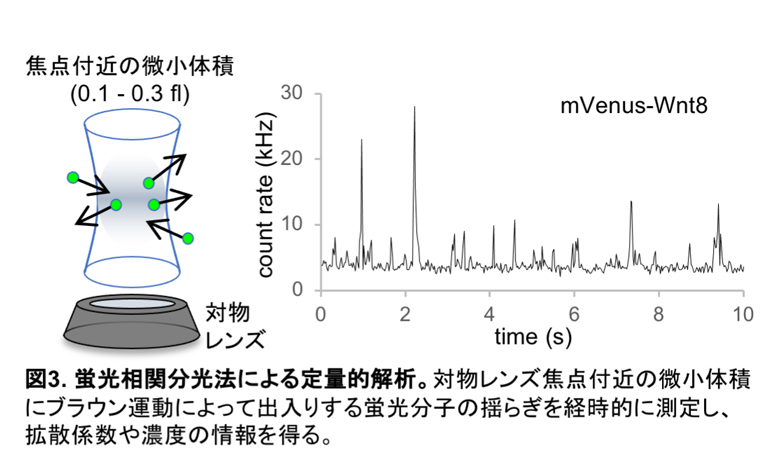
mVenus-Wnt8に自由拡散する成分が存在するか否かを直接的に検討するため、蛍光相関分光法(FCS)を用いてツメガエル胚でのmVenus-Wnt8分子の動きを解析しました。FCSは蛍光分子のブラウン運動による蛍光の経時変化を定量的に分析する手法で、どの程度の速さで拡散しているか、や分子の濃度を測定することができます(図3)。この結果、mVenus-Wnt8は自由拡散と考えられる速さで拡散していることが分かりました。同様に分泌型mVenusの測定も行い、想定される通り自由拡散する分子が検出されました。mVenus-Wnt8と分泌型mVenusの拡散する分子の濃度を比較したところ、ほぼ同等でした。しかし先に述べた通り、細胞間隙に分布するそれぞれの蛋白質の量には大きな差があります。このことから拡散状態にあるmVenus-Wnt8蛋白質は量が少ないため、ほとんど分布に寄与しないと考えられ、拡散する分子は見えないという定性的解析の結論が定量的解析からも支持されました。
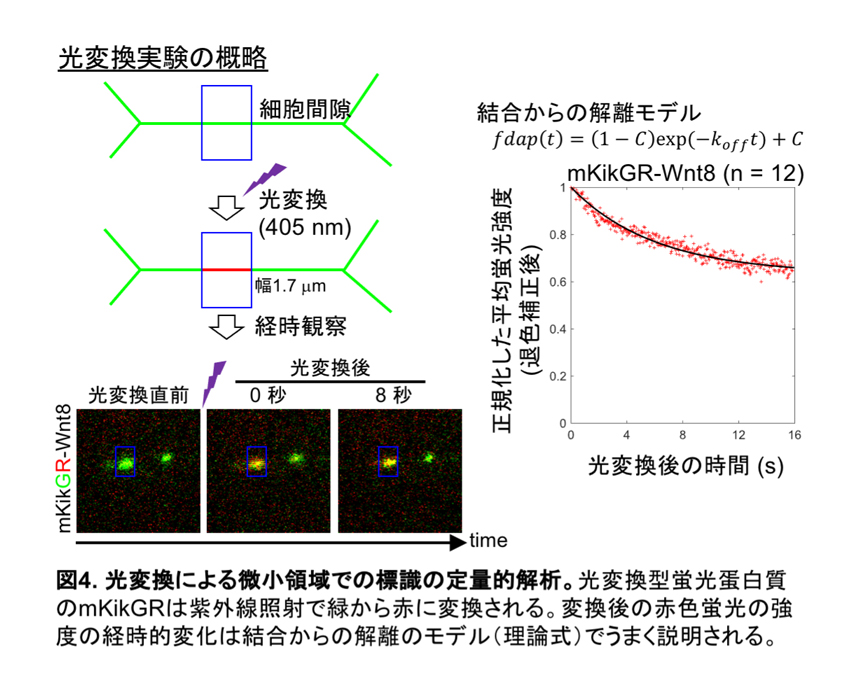
さらにWnt8にmKikGRという光変換型蛍光蛋白質を融合したものを作成しました。mKikGRは発現させると緑色の蛍光を示しますが、紫外線を照射すると赤色蛍光に変換することができます。これを利用して、細胞間隙に分布するmKikGR-Wnt8のごく一部(幅1.7 µmの微小領域)を瞬間的に標識して、赤色蛍光の時間変化を解析しました。その結果、16秒程度の比較的短い時間で2-3割程度の分子が細胞表面への結合状態から解離していることが示唆されました(図4)。細胞間隙の分布は通常の蛍光観察では数十分程度の比較的長い時間安定に存在することから自由拡散成分と細胞表面に結合している成分は常に入れ替わりがあり、一種の平衡状態にあることが考えられます。
③自由拡散成分と細胞表面に結合した成分を考慮したシンプルな数理モデルを構築し、分泌性蛋白質の分布や動態を理解する枠組みを提案した。
ここまでの定性的および定量的解析から、少数の自由拡散する分子と多数の細胞表面に結合する分子の存在が見えてきました。また以前の研究(Mii et al., Nat. Commun. 2017)で、Wnt8が細胞表面に結合する際の足場構造はヘパラン硫酸のクラスター構造であることを見いだしてきました。これらを総合して、シンプルな数理モデルを構築しました(図5)。これまで、自由拡散する分子による濃度勾配は速く形成されうる一方、不安定であるのに対し、ゆっくりと拡散する分子による濃度勾配は安定的であるが形成に時間がかかるという問題が考えられてきました。つまりスピードと安定性はジレンマの関係にあると考えられてきました。しかしこのモデルによるシミュレーションから、少数の自由拡散する分子がスピードに、多数の細胞表面に結合する分子は安定性に寄与することで、安定的な濃度勾配が素早く形成されうることが示されました。
 【今後の展望】
【今後の展望】
今回の研究から、いまだ十分理解されていないモルフォゲンの振る舞いの一端が明らかになりました。特に少数の自由拡散成分と、多数の細胞表面結合成分を考慮したシンプルな数理モデルはWnt8に限らず、他のモルフォゲンの振る舞いを理解するための基本的な枠組みを提供しうるものであり、これを発展させることで他の分泌因子による現象の理解にも資すると考えています。
【発表雑誌】
雑誌名 eLife
掲載日 2021年4月27日
論文タイトル: Quantitative analyses reveal extracellular dynamics of Wnt ligands in Xenopus embryos.(和訳)定量的解析により明らかになった細胞外でのWnt分子の動的振る舞い
著者:Yusuke Mii(三井 優輔), Kenichi Nakazato(中里 研一), Chan-Gi Pack, Takafumi Ikeda(池田 貴史), Yasushi Sako(佐甲 靖志), Atsushi Mochizuki(望月 敦史), Masanori Taira(平良 眞規), Shinji Takada(高田 慎治)
DOI: https://doi.org/10.7554/eLife.55108
【研究グループ】
基礎生物学研究所および生命創成探究センター(三井、高田)、東京大学(池田)、理研(中里、佐甲)、京都大学(望月)、中央大学(平良)、Asan Medical Center(Pack)からなる研究グループによる研究成果。
【研究サポート】
本研究は、以下をはじめとする研究費の支援を受けて行われました。
科研費(24870031, 15K14532, 18K14720, 19H05670, 24657147, 18H02447, 25251026, 17K19418, 18H02454, 19H04797)、自然科学研究機構若手研究者による分野間連携研究プロジェクト (1311608, 01311801)、JSTさきがけ(JPMJPR194B)、JST CREST (JPMJCR13W6, JPMJCR1922)。
【本研究に関するお問い合わせ先】
基礎生物学研究所 分子発生学研究部門/生命創成探究センター
助教 三井 優輔
教授 高田 慎治
中央大学理工学部生命科学科
兼任講師 平良 眞規
京都大学 ウイルス・再生医科学研究所
教授 望月敦史
【報道担当】
基礎生物学研究所 広報室
生命創成探究センター 広報担当
中央大学 広報室
京都大学 総務部広報課国際広報室
理化学研究所 広報室