2022-08-01 京都大学
概要
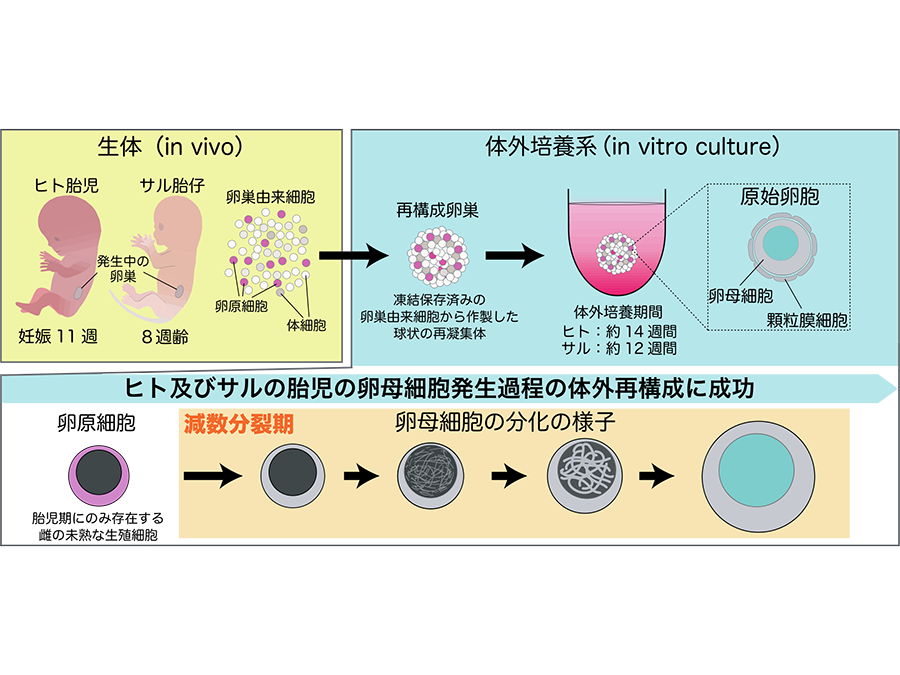
京都大学高等研究院 ヒト生物学高等研究拠点(WPI-ASHBi)の斎藤通紀 拠点長/主任研究者/教授(兼:同大学院医学研究科 教授)、 同大学院医学研究科の水田賢 助教らは、ヒト及びカニクイザル注1を対象とした研究により、胎児の卵巣由来細胞から卵子の元となる原始卵胞注2を作出する体外培養法の開発に成功しました。
これまでに本研究グループでは、ヒト多能性幹細胞注3から卵原細胞注4を作出することに成功していましたが、卵原細胞をさらに分化させ、ヒトの卵胞を作出するための体外培養法は存在せず、その技術開発が望まれてきました。
本研究では、ヒトのモデルとしてカニクイザル胎児の卵母細胞注5発生機構を詳細に解析し、サル胎児の卵巣由来細胞の体外培養条件を検討した結果、約3ヶ月間の長期培養により、サル胎児の卵巣細胞から卵胞を誘導する培養技術を確立しました。そこで、ヒト胎児の卵巣由来細胞に対しこの体外培養を実施したところ、ヒトにおいても同様に卵胞の誘導に成功し、その卵胞は成人卵巣中の原始卵胞に近い性質を有していることが明らかとなりました。また、当培養法により得られた卵母細胞の解析により、ヒトとサルに共通して存在する霊長類特異的な卵母細胞発生機構の解明にも成功しました。この研究成果は、ヒトの雌性生殖細胞の正常発生機構の解明のみならず、不妊症などの生殖細胞関連疾患の病因解明・治療開発など、生殖医療の発展に役立つことが期待されます。
本成果は、2022年8月1日 日本時間 午後7時(中央ヨーロッパ時間(夏時間)午後0時)に国際学術誌『The EMBO Journal』のオンライン速報版で公開されます。
1.背景
生殖細胞は、卵子もしくは精子に分化し、それらの融合により次世代の個体を生み出すことのできる唯一の細胞であり、種の保存や進化において極めて重要な役割を担っています。メスの場合、全ての生殖細胞が胎児期に減数分裂注6を開始し卵母細胞を形成するという、非常に特徴的な分化様式を示します。その後、卵母細胞は原始卵胞を形成した後に減数分裂過程で一旦とどまります。ヒトでは思春期以降に減数分裂を再開し、最終的な卵子形成過程に入ることが知られています。
これまで本研究グループでは、マウス多能性幹細胞を試験管内で始原生殖細胞様細胞注7へと誘導し、正常な産仔能をもつ精子や卵子へと分化させることに成功してきました。一方で、ヒト多能性幹細胞を起点とした分化誘導については、始原生殖細胞様細胞への分化、さらに卵原細胞の作出に成功してきましたが、その後の卵母細胞への分化過程、並びに卵胞の形成過程は再現できていませんでした。原始卵胞は成人卵巣において卵子形成の源となる構造体であり、その体外再構成はヒトの雌性生殖細胞の発生機構の理解を促進する上で必須の技術と考えられていました。
2.研究方法・成果
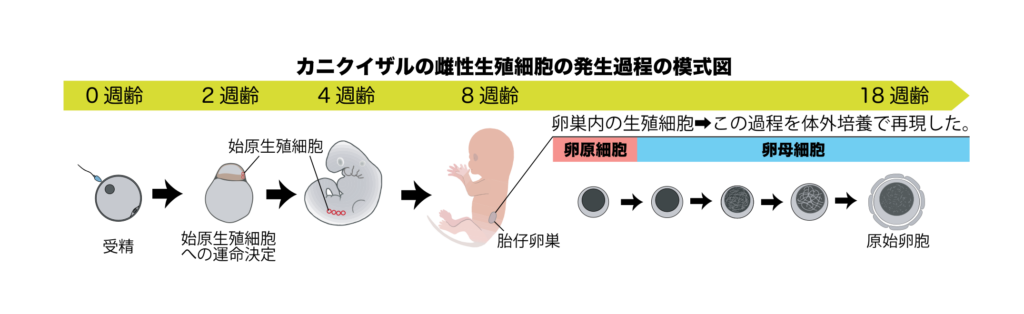
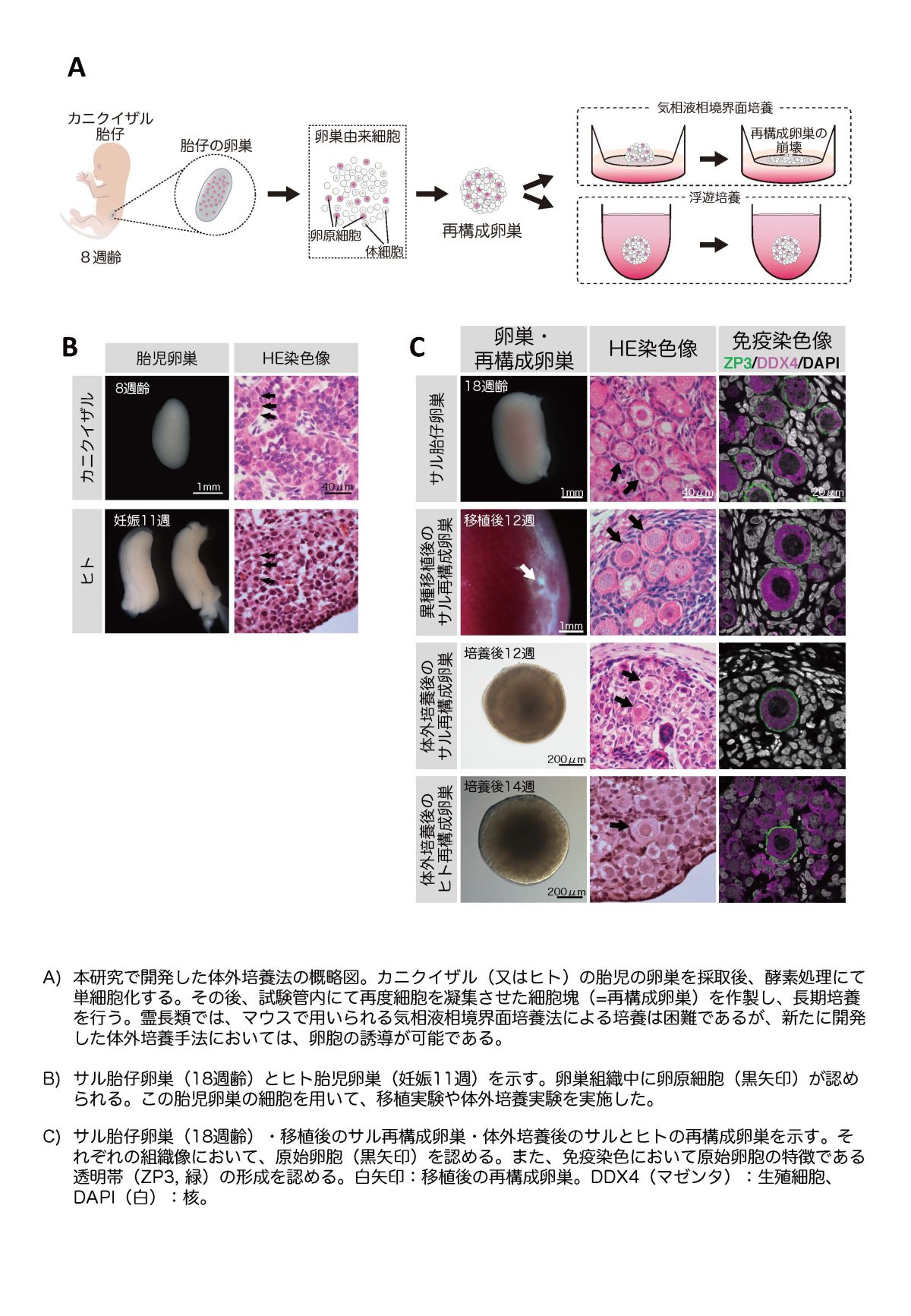
本研究ではまず、ヒトのモデル動物として霊長類のカニクイザルを対象とした実験を行い、サル胎児の卵巣由来細胞から卵胞を作製する技術の開発を目指しました。サルの胎児卵巣に対する解析の結果、8週齢の胎児の生殖細胞は全てが卵原細胞でしたが、その後徐々に減数分裂を開始し、8〜10週間で卵母細胞への分化を進め、18週齢の時点では約半数の生殖細胞が原始卵胞を形成していることが明らかとなりました。次に、8週齢の胎児卵巣の細胞を用いて細胞凝集体(再構成卵巣注8)を作製し、免疫不全マウスの腎臓被膜下に移植したところ、約12週間後に再構成卵巣内に多数の卵胞形成を認めました。この結果より、サルの再構成卵巣は、適切な条件下であれば、サルの体外においても卵母細胞への分化を進め、卵胞形成に至ることが証明されました。
次に、サルの卵胞を体外培養により誘導するための条件検討を実施しました。先ず、マウスでの培養法である気相液相境界面培養注9を行ったところ、サルの再構成卵巣はその形態を維持することができず、6週間後には平坦化し、卵胞形成に至らないことが示されました。そこで、浮遊培養注10法に切り替え、液体培地の比較検討等により最適な培養条件を見出した結果、長期間に渡りサルの再構成卵巣を維持でき、12週間後には卵胞を誘導可能であることも明らかとなりました。組織学的解析・単一細胞遺伝子発現解析注11の結果、体外培養環境下でもサルの再構成卵巣内で生体と同様の卵母細胞への分化が進み、卵胞形成に至っていることが証明されました。また、驚くべきことに、得られた卵母細胞は、カニクイザルの成獣の卵巣に存在する卵母細胞に近い遺伝子発現状態を有していました。
さらに、8週齢のサル胎児に相当する、妊娠11週のヒト胎児の卵巣由来細胞に対し、本培養法による卵胞の誘導を試みました。その結果、14週間の培養期間を経ることで、ヒト再構成卵巣内に卵胞の形成(全生殖細胞中3%程度)が認められました。種々の解析により、この卵胞は生体と同等の卵母細胞分化過程を経ており、得られた卵母細胞は、成人の卵巣に存在する卵母細胞に近い遺伝子発現状態を有していました。これにより、世界で初めて、ヒトを含む霊長類の胎児の卵原細胞から卵胞を作出する体外培養法の確立に成功しました。
加えて、この新規体外培養法により得られたヒトとサルの卵母細胞に対して、組織学的解析・単一細胞遺伝子発現解析を実施したところ、マウスには認められない霊長類にのみ存在する卵母細胞の発生機構の同定に至りました。一方で、マウス・サル・ヒトの全ての種で保存されている制御機構、特に卵母細胞発生過程におけるX染色体の制御機構に関する解析も実施し報告しています。
3.波及効果、今後の予定
本研究により、ヒト・サルの卵原細胞を卵母細胞へ分化させ、卵胞形成に至るまでを体外で再構成することに初めて成功しました。本成果により、卵子における遺伝情報継承機構の追究や、不妊症の原因究明および遺伝病の発症機構解明が促進されることが期待されます。今後は、ヒト始原生殖細胞様細胞から卵母細胞そして卵子へと分化誘導する技術の開発を推進します。
4.研究プロジェクトについて
本成果は、以下の事業・研究領域・研究課題によって得られました。
- JSPS 特別研究員奨励費「霊長類始原生殖細胞を卵母細胞に誘導する体外培養系の確立」
研究代表者:水田 賢(京都大学 大学院医学研究科 特別研究員)
研究期間:平成31年度~令和2年度 - JSPS 研究活動スタート支援「霊長類始原生殖細胞を高効率に卵母細胞へ誘導する体外培養系の確立」
研究代表者:水田 賢(京都大学 大学院医学研究科 助教)
研究期間:令和3年度~令和4年度 - JST 戦略的創造研究推進事業 総括実施型研究(ERATO)「斎藤全能性エピゲノムプロジェクト」
研究総括:斎藤 通紀(京都大学 大学院医学研究科 教授)
研究期間:平成23年度~平成28年度 - JSPS 特別推進研究「ヒト生殖細胞発生機構の解明とその試験管内再構成」
研究代表者:斎藤 通紀(京都大学 大学院医学研究科 教授)
研究期間:平成29年度~令和3年度 - JSPS 特別推進研究「試験管内再構成系に基づくヒト卵母細胞発生機構の解明とその応用」
研究代表者:斎藤 通紀(京都大学 大学院医学研究科 教授)
研究期間:令和4年度~令和9年度
用語解説
注1 カニクイザル(学名:Macaca fascicularis):哺乳綱霊長目オナガザル科マカク属に分類される旧世界サルの一種で、主に東南アジアに生息している。同属にはアカゲザルやニホンザルが含まれ、ヒトやチンパンジー、オランウータンといったヒト科の霊長類とは約2500~3000万年前に分離したと考えられている。ヒトを含む霊長類のモデル生物として使用され、マウスを用いた研究では得られない、霊長類特有の知見が得られると期待される。
注2 原始卵胞:卵子の元である卵母細胞を含む構造体で、成体の卵巣中に蓄えられている。胎児期に形成されて以降は増殖することなく、減少し続ける。思春期以降にごく一部の原始卵胞が発育を開始し、卵子形成・排卵へと至る。
注3 多能性幹細胞:自己複製能力と、体を構成するほぼ全ての細胞に分化する能力を持つ細胞のこと。胚性幹細胞(Embryonic stem cells: ESCs)や人工多能性幹細胞(induced Pluripotent stem cells: iPSCs)の総称。
注4 卵原細胞:胎児期のごく初期の卵巣に存在する生殖細胞であり、減数分裂を開始する前の状態の雌性生殖細胞。減数分裂へと進行することで卵母細胞となる。
注5 卵母細胞:胎児期に卵原細胞から分化し、減数分裂中にある雌性生殖細胞のこと。卵母細胞が成熟し、減数分裂を完了すると卵子になる。
注6 減数分裂:精子や卵子を形成する際に行われる細胞分裂。生じた細胞では、染色体の数が分裂前の半分となる。減数分裂過程の組換えにより新たな遺伝情報の組み合わせを持つ染色体が形成され遺伝的多様性を創り出す。
注7 始原生殖細胞様細胞:始原生殖細胞とは、卵子もしくは精子の起源となる細胞。始原生殖細胞には雌雄の区別がなく、先行して性決定を受けた生殖巣から生成される因子の影響で、雄では前精原細胞に、雌では卵母細胞に分化する。始原生殖細胞様細胞は、多能性幹細胞から試験管内で誘導した、始原生殖細胞に非常によく似た性質を持つ細胞。
注8 再構成卵巣:胎児卵巣から採取した細胞(約5万個)を試験管内で凝集して作製した、球状の細胞塊。胎児卵巣の細胞は単細胞化した状態で凍結保存しており、任意のタイミングで使用可能である。
注9 気相液相境界面培養:マウスの卵胞誘導に使用される培養手法。サンプルをポリエステル製の膜上にのせ、細胞の上面は空気、下面は培養液に触れさせて培養する方法。気相からの酸素供給と、液相からの栄養分の供給が同時に可能となる。
注10 浮遊培養:サンプルを培養皿や膜上に接着させることなく、浮遊した状態を維持して行う培養。
注11 単一細胞遺伝子発現解析:1個の細胞由来の転写産物を増幅し、発現している全遺伝子を次世代シークエンサーにより網羅的に解析する手法。従来の全遺伝子発現解析では数十万個以上の細胞数が必要であったが、近年の目覚ましい技術発展により、単一細胞においても全遺伝子レベルで解析可能になった。
参考図表
論文書誌情報
タイトル
Ex vivo reconstitution of fetal oocyte development in humans and cynomolgus monkeys
(ヒト及びカニクイザル胎児卵母細胞発生過程の体外再構成)
著者
水田 賢、加藤 嘉崇、中北 麦、岸根 葵葉、野阪 善昭、齋藤 咲貴、岩谷 千鶴、土屋 英明、河本育士、中家 雅隆、築山 智之、長野 眞大、小島 洋児、中村 友紀 、藪田 幸宏、堀江 昭史、万代 昌紀、大田 浩、斎藤 通紀
掲載誌 The EMBO Journal