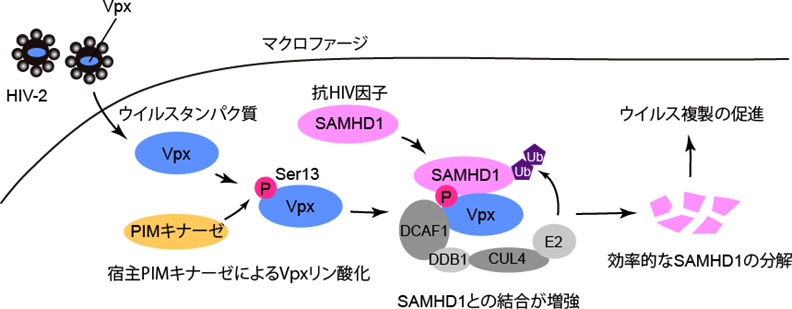
2019-04-24 東北大学,奈良先端科学技術大学院大学,大阪大学,京都産業大学,日本医療研究開発機構
発表のポイント
- 細胞中のカルシウムの恒常性維持に重要な小胞体膜局在カルシウムポンプSERCA2bの結晶構造を世界で初めて明らかにした。
- SERCA2bに特徴的な11番目の膜貫通ヘリックスが、他の膜貫通へリックス領域と分子内相互作用することで活性を制御するという、カルシウムポンプの新しい活性制御機構モデルを提唱した。
概要
東北大学多元物質科学研究所の井上道雄助教、渡部聡助教、稲葉謙次教授(生命科学研究科、理学研究科化学専攻 兼担)、および奈良先端科学技術大学院大学の塚崎智也教授、大阪大学の高木淳一教授、東北大学未来科学技術共同研究センター/東北大学大学院医学系研究科の加藤幸成教授、京都産業大学の永田和宏教授らを中心とした共同研究グループは、JST戦略的創造研究推進事業において、筋収縮の制御やアポトーシスの誘導など、様々な生命現象において重要な役割をもつカルシウムイオンの恒常性を保つ上で必須のカルシウムポンプSERCA2bの高分解能構造を世界で初めて明らかにしました。
細胞小器官の一つである小胞体は、細胞内での適切なカルシウムイオン濃度を維持するために、カルシウムを取り込み、蓄える働きがあります。SERCA2bはこのカルシウムの取込みを担い、全組織に広く発現している膜たんぱく質です。骨格筋や心筋に特異的に発現するSERCA1a(SERCA2bのアイソフォーム注1)やSERCA2a(SERCA2bのスプライシングバリアント注2)とは異なり、SERCA2bには11番目の膜貫通ヘリックス(TM11)を含む特徴的なC末端領域があります。このC末端領域によってSERCA2bの活性が制御されることは過去に報告されていますが、その詳しいメカニズムは分かっていませんでした。
我々は、SERCA2bの立体構造をX線結晶構造解析注3によって決定し、TM11がこれまでの予想とは全く異なる位置に存在することを明らかにしました。TM11は、SERCA2b分子内でL8/9ループとTM10の一部と相互作用することが構造から分かり、アミノ酸の変異体解析によって、これら分子内相互作用がSERCA2bの活性制御に重要であることが明らかとなりました。また、同じ手法で決定したSERCA2aの立体構造と比較したところ、SERCA2bのTM11によって膜貫通へリックス領域の動きが抑えられることが示され、この動きの抑制がSERCA2bの活性を制御することを考察しました。これらの成果によって、SERCA2bの他のカルシウムポンプとは異なる活性制御のメカニズムが原子レベルで明らかとなりました。
本研究成果は、2019年4月23日11時(アメリカ東部時間)に米国科学誌Cell Reportsに掲載されます。
研究の背景
小胞体は膜たんぱく質や分泌たんぱく質の生合成やカルシウムの貯蔵を行う細胞内小器官です。小胞体膜局在のATP駆動型カルシウムポンプであるSERCA2bは、細胞質から小胞体内へカルシウムを取り込むことで、カルシウムの制御や細胞内のカルシウム濃度の恒常性維持において重要な役割をもつことが知られています。ハウスキーピングたんぱく質注4であるSERCA2bは、組織特異的に発現するアイソフォームのSERCA1aやスプライシングバリアントのSERCA2aとは異なり、C末端に11番目の膜貫通へリックス(TM11)が存在します。そのため、SERCA2bだけが、C末端が小胞体内腔側に位置した特徴的な構造を持っています(図1)。このTM11を含むC末端領域によってSERCA2bの活性が制御されることやカルシウムに対する結合能が強まることが報告されていますが、その詳しい機構については分かっていませんでした。
SERCA2bのアイソフォームであるSERCA1aについては、様々な中間状態で構造が決定されていますが、SERCA2bの構造についてはこれまでに報告はありませんでした。そこで、全組織において細胞内のカルシウムイオン恒常性維持に関わるSERCA2bの活性制御メカニズムを原子レベルで理解するため、SERCA2bの構造を決定することを試みました。
研究の内容と成果
本研究ではまず、SERCA2bの構造をX線結晶構造解析により明らかにするために、脂質キュービックフェーズ法注5を用いて結晶を作製しました。構造を安定化させるために、カルシウムとATPが結合した状態を模したE1-AMPPCP状態の結晶を用いて、SPring-8 BL32XUにてX線回折実験を行い、SERCA2bの結晶構造を3.45 Å分解能で決定しました。得られた構造から、SERCA2bはAドメイン(駆動ドメイン)、Nドメイン(ATP結合ドメイン)、Pドメイン(リン酸化ドメイン)の三つの細胞質ドメインと、11個の膜貫通ヘリックス(N末端からTM1~TM11と呼ぶ)からなっており、AMPPCPとマグネシウムイオン、二つのカルシウムイオンの位置と結合様式を同定しました(図2)。SERCA2bに特徴的なTM11は、従来の研究で予想されていた位置とは大きく異なり、TM10の横に離れて存在していました。また、TM11の分子内相互作用を調べたところ、TM11がTM8とTM9を結ぶL8/9ループとTM10のN末端と部分的に結合することが示されました(図3)。この相互作用に関わるTM11中のアミノ酸(1018番目のフェニルアラニンと1029番目のバリン)に変異を導入し、それら変異体の活性評価を行ったところ、野生型に比べて活性が大きく上昇することが分かりました。このことから、TM11はL8/9ループとTM10との相互作用によってSERCA2bの活性を制御することが示されました。
同様に、スプライシングバリアントであるSERCA2aについても3.2 Å分解能での結晶構造の決定に成功しました。SERCA2bとSERCA2aの細胞質ドメインの構造を重ね合わせたところ、SERCA2aのTM10がSERCA2bのTM11と立体障害を起こすことが分かりました。この結果から、TM11によって膜貫通へリックス領域(TM1-10)の動きが制限されることが示唆されました。以上の結果から、SERCA2bのTM11が、TM1-10の動きを抑制することで、SERCA2bの活性を制御するという新たなメカニズムを提唱しました(図4)。
今後の展開
本研究成果として、SERCA2bの反応サイクルにおいてカルシウムとATPが結合した状態の構造解析に世界で初めて成功しました。その結果、TM11を介した分子内相互作用による活性制御メカニズムを提唱することができました。今後は、他の複数の中間状態でのSERCA2bの構造解析を行うことで、反応サイクル全体におけるSERCA2bのC末端領域を介した活性制御機構の全容を解明したいと考えています。小胞体へのカルシウムの取り込みの阻害が強い小胞体ストレスを誘導することが知られており、またそのことが神経変性疾患、糖尿病などの疾患を引き起こすことも報告されています。さらに、SERCA2bの遺伝子変異による機能不全が、ダリエ病という皮膚病を引き起こすことも広く知られています。したがって、本研究で得られた知見は、細胞内カルシウムが関わる種々の生命現象の解明のみならず、細胞のカルシウム恒常性維持機構の破綻が引き起こす様々な疾病の原因解明および治療戦略の開発につながることが期待されます。
特記事項
本成果は、以下の事業・研究領域・研究課題によって得られました。
- 科学技術振興機構(JST)戦略的創造研究推進事業 チーム型研究(CREST)
-
- 研究領域:「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術(研究総括:田中 啓二 東京都医学総合研究所 理事長兼所長)
- 研究課題名:「小胞体恒常性維持機構:Redox, Ca2+, たんぱく質品質管理のクロストーク」
- 研究代表者:永田和宏(京都産業大学タンパク質動態研究所 所長 兼 生命科学部 教授)
- 研究期間:2013年4月~2019年3月
JSTは本領域で、先端的ライフサイエンス領域と構造生物学との融合により、ライスサイエンスの革新に繋がる「構造生命科学」と先端基盤技術の創出を目指します。上記研究課題では、ERdj5を中心として、たんぱく質恒常性(ホメオスタシス)・レドックス(酸化還元)恒常性・カルシウム恒常性の3つの主要な恒常性のクロストーク分子基盤を、静的(X線結晶構造解析)および動的(FRET解析)な構造解析によって解明します。
また、本研究は、日本医療研究開発機構(AMED)の創薬等先端技術支援基盤プラットフォーム(BINDS)の以下の課題によっても、カルシウムポンプSERCA2bの生産に関する支援が行われました。
- 創薬等ライフサイエンス研究支援基盤事業
-
- 研究課題名・研究代表者:
①「抗体関連高度開発支援と糖鎖細胞工学による高度化」加藤幸成(東北大学 大学院医学系研究科 教授)
②「Structure-based protein designを駆使した抗体代替物の創成と高難度組換え蛋白質生産の支援」高木淳一(大阪大学 蛋白質研究所 教授) - 研究期間:2017年4月~2022年3月(予定)
- 研究課題名・研究代表者:
発表論文
- 著者:
- Michio Inoue, Nanami Sakuta, Satoshi Watanabe, Yuxia Zhang, Kunihito Yoshikaie, Yoshiki Tanaka, Ryo Ushioda, Yukinari Kato, Junichi Takagi, Tomoya Tsukazaki, Kazuhiro Nagata, Kenji Inaba
- タイトル:
- Structural basis of sarco/endoplasmic reticulum Ca2+-ATPase 2b regulation via transmembrane helix interplay
- 雑誌名:
- Cell Reports
- DOI:
- 10.1016/j.celrep.2019.03.106
用語解説
- 注1)アイソフォーム
- 基本的な機能に関する構造またはアミノ酸配列は同じだが、一部が異なっているたんぱく質。異なる遺伝子から発現する。
- 注2)スプライシングバリアント
- 同一の遺伝子から転写過程においてエキソンの組み合わせを変えることで生じる多様なmRNAをもしくはたんぱく質をスプライシングバリアントと呼ぶ。
- 注3)X線結晶構造解析
- 分子の構造を高分解能で決定する手法の1つ。分子が規則正しく並んだ結晶に強いX線を照射すると回折という現象が起こり、回折データを解析することで、結晶を構成する分子の構造を原子レベルで決定することができる。
- 注4)ハウスキーピングたんぱく質
- 細胞の生存に必須で、組織によらず全ての細胞で発現しているたんぱく質の総称。
- 注5)脂質キュービックフェーズ法
- 精製した膜たんぱく質とモノオレインなどの脂質を混合し、脂質二重層に膜たんぱく質を再構成してから結晶化を行う方法。
参考図
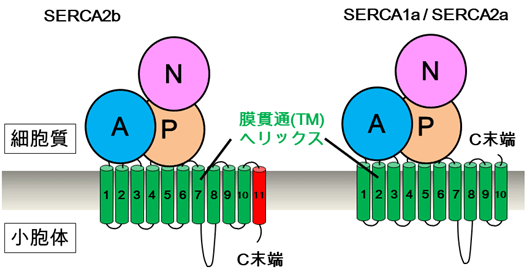
図1 SERCA2bとそのアイソフォームSERCA1a/SERCA2aの簡略図
SERCA2bは11個の膜貫通ヘリックス(TM1~TM11)を有しており、C末端は小胞体内腔側に位置する。一方、アイソフォームのSERCA1aやスプライシングバリアントのSERCA2aは、10個のTMヘリックス(TM1~TM10)を有するため、C末端は細胞質側に存在する。11番目のTMヘリックス(TM11)とそれに続くC末端テール領域が、SERCA2bの活性制御において重要な役割をもつと考えられてきた。
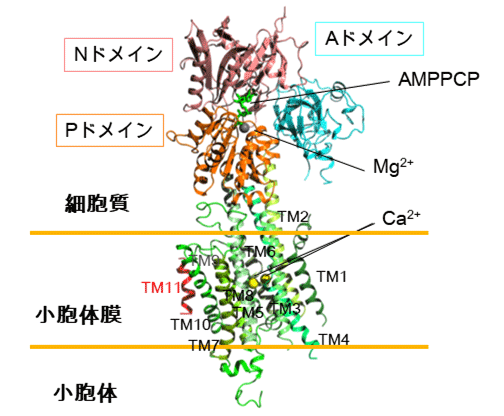
図2 SERCA2bのX線結晶構造
SERCA2bはドメイン間の動きを調節するAドメイン、ヌクレオチド結合ポケットを持つNドメイン、リン酸化部位を含むPドメインの三つの細胞質ドメインと11個の膜貫通ヘリックス(TM1~TM11)で構成される。Nドメインには加水分解されないATPの類似化合物であるAMPPCPが結合し、またその近くにマグネシウムイオンが配位することを明らかにした。また、膜貫通ヘリックス領域にはカルシウムイオンが二つ結合することが明らかとなった。
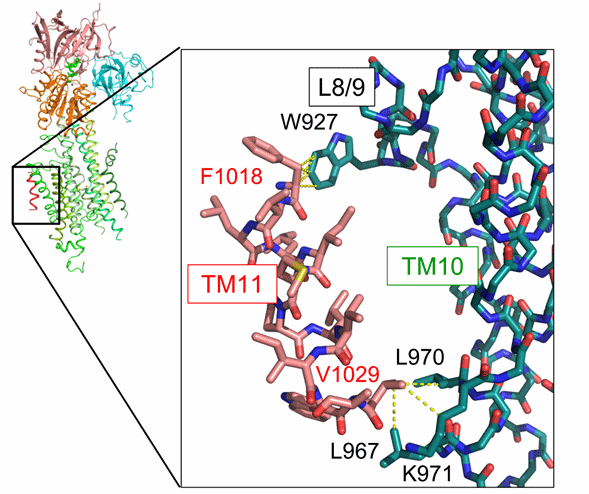
図3 TM11の相互作用様式
TM11周辺において、L8/9ループ中の927番目のトリプトファン(W927)とTM11中の1018番目のフェニルアラニン(F1018)が、TM10中の三つのアミノ酸(L967、L970、K971)とTM11中の1029番目のバリン(V1029)が、それぞれ相互作用することが明らかとなった。黄色の破線は、4 Å以内の距離に位置する原子ペアを表し、それら原子の間で相互作用がはたらくと考察される。
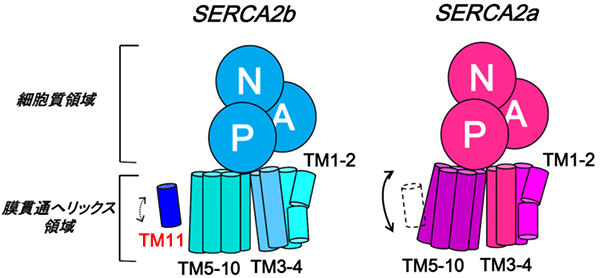
図4 TM11によるSERCA2bの膜貫通へリックス領域の動きの抑制
図3に示したTM11とその周りのアミノ酸間の相互作用のため、さらにはTM11とTM10間の予想される立体障害を避けるため、SERCA2bの膜貫通へリックスの動きはSERCA2aのそれと比べ、抑制されることが明らかとなった。その結果、SERCA2bの活性はSERCA2aよりも低いと考察される。
お問い合わせ先
研究に関すること
東北大学 多元物質科学研究所 教授
稲葉 謙次(いなば けんじ)
報道担当に関すること
東北大学 多元物質科学研究所 広報情報室
伊藤 智恵(いとう ともえ)
東北大学大学院医学系研究科・医学部広報室
奈良先端科学技術大学院大学
企画・教育部企画総務課広報渉外係
福本 好秀(ふくもと よしひで)
大阪大学蛋白質研究所 庶務係
和田 由美(わだ ゆみ)
京都産業大学 広報部
増村 尚人(ますむら なおと)
AMED事業に関すること
日本医療研究開発機構(AMED)
創薬戦略部 医薬品研究課