2018-04-18 理化学研究所,大阪大学
理化学研究所(理研)生命医科学研究センター分化制御研究チームの黒崎知博チームリーダー(大阪大学免疫学フロンティア研究センター特任教授(常勤))、大阪大学免疫学フロンティア研究センターの伊勢渉特任准教授(常勤)らの共同研究グループは、病原体からの感染防御に必須の抗体[1]が作られる経路を明らかにしました。
本研究成果は、効果的な抗体の産生を標的にした新しいワクチン開発に大きく貢献すると期待できます。
今回、共同研究グループは、マウスを用いた解析を行い、ウイルスなどの病原体を生体内から除去するために必要な抗体分子の中でも、病原体との親和性の高い良質な抗体がどのような仕組みで作られるのかを明らかにしました。ウイルスなどの外来異物が体内に侵入すると、活性化したB細胞[2]が、胚中心[3]という微小構造の中で、高親和性の抗体を産生する「プラズマ細胞[4]」へと分化します。本研究では、胚中心に存在するB細胞を詳しく解析した結果、プラズマ細胞へ分化することが運命づけられた前駆細胞を同定することに初めて成功しました。また、この前駆細胞は、胚中心B細胞と濾胞性ヘルパーT細胞(Tfh細胞)[5]との安定的な相互作用によって誕生することを明らかにしました。このプラズマ細胞の前駆細胞を効率良く誘導することが、新たなワクチン開発の指標になると考えられます。
本研究成果は国際科学雑誌「Immunity」に掲載されるのに先立ち、オンライン版(4月17日付:日本時間4月18日)に掲載されます。
※共同研究グループ
理化学研究所 生命医科学研究センター
分化制御研究チーム
チームリーダー 黒崎 知博(くろさき ともひろ)
(大阪大学 免疫学フロンティア研究センター 分化制御研究室 特任教授(常勤))
研究員(研究当時) 米谷 耕平(こめたに こうへい)
(現 京都大学 iPS細胞研究所 特定拠点助教)
組織動態研究チーム
チームリーダー 岡田 峰陽(おかだ たかはる)
医科学イノベーションハブ推進プログラム
健康医療データAI予測推論開発ユニット
ユニットリーダー 川上 英良(かわかみ えいりょう)
生命機能科学研究センター
細胞システム動態予測研究ユニット
ユニットリーダー 城口 克之(しろぐち かつゆき)
(科学技術振興機構(JST)さきがけ研究者)
大阪大学 免疫学フロンティア研究センター
分化制御研究室
特任准教授(常勤) 伊勢 渉(いせ わたる)
特任技術職員 伊藤 綾子(いとう あやこ)
大学院生 藤井 健太郎(ふじい けんたろう)
免疫応答ダイナミクス研究室
教授 鈴木 一博(すずき かずひろ)
粘膜免疫学
教授 竹田 潔(たけだ きよし)
(大阪大学大学院 医学系研究科 免疫制御学 教授)
KOTAIバイオテクノロジーズ株式会社
代表取締役 山下 和男(やました かずお)
※研究支援
本研究は、JST戦略的創造研究推進事業CREST「液性免疫制御による新しい治療法の開発(研究代表者:黒崎知博)」、さきがけ「生体システム理解・医科学応用を実現する1細胞核酸計測技術の開発(研究者:城口克之)」、文部科学省科学研究費補助金「液性免疫記憶の生成・維持・活性化機序(研究代表者:黒崎知博)」、「メモリーB細胞の形成と維持を支える内的・外的メカニズム(研究代表者:黒崎知博)」、「高親和性プラズマ細胞の選択および生存維持を担う分子機構の解析(研究代表者:伊勢渉)」、先進医薬研究振興財団研究助成「高親和性抗体を産生するプラズマ細胞の誘導・選択に関する分子機構の解明(研究者:伊勢渉)」の支援を受けて行われました。
背景
近年、インフルエンザウイルスの感染により、日本国内だけでも年間1,000人以上もの死者が出ています注1)。そのため、ウイルス・細菌感染に対する生体防御メカニズムを解明し、効果的なワクチンを開発することが、社会的に重要な課題となっています。
ウイルスや細菌などの外来異物が私たちの生体に侵入すると、免疫系の細胞が活性化し、異物を排除するための物質を産生します。その中でも、とりわけ重要なのが抗体です。抗体は、B細胞から分化した「プラズマ細胞」という細胞によって作られますが、プラズマ細胞には大きく分けて2種類のタイプが存在します。一つは異物によって速やかに誘導されるタイプで、病原体との親和性の低い抗体を迅速に産生します。もう一つは胚中心という場所で作られるタイプで、親和性の高い良質な抗体を産生します。胚中心に存在するB細胞(胚中心B細胞)は、自らの抗体遺伝子に変異を繰り返し導入することで、自らの抗体の性能を高めていきます。そして、細菌やウイルスを攻撃するための高親和性抗体を持つようになった胚中心B細胞が、プラズマ細胞へと分化すると考えられてきました。
したがって、感染防御に効果的な、高親和性の良質抗体を産生するタイプのプラズマ細胞がどのようなメカニズムで誕生するのかを明らかにすることが非常に重要です。しかし、生体内におけるプラズマ細胞の数が非常に少ないため解析が難しいこと、またこれまで、胚中心を経て誕生したプラズマ細胞を他のタイプのプラズマ細胞と識別する方法がなかったことから、分化の経路は明らかにされていませんでした。
注1)厚生労働省 人口動態調査人口動態統計平成28年第7表
研究手法と成果
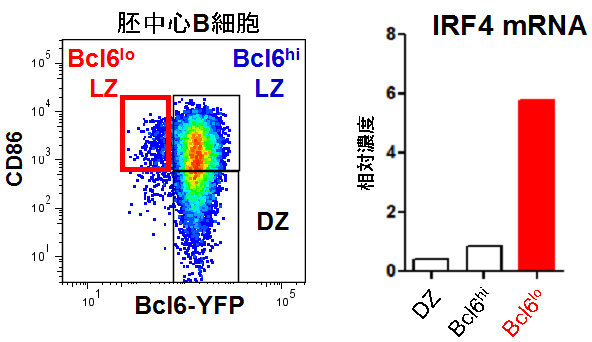
共同研究グループはまず、胚中心B細胞の中には、プラズマ細胞への分化が既に始まっているものが存在するのではないかと考えました。胚中心B細胞は、転写因子[6]Bcl6[7]を発現していますが、プラズマ細胞へ分化するとBcl6の発現を失います。そこで、Bcl6の発現を蛍光色素で追跡できるレポーターマウス[8]を用いて解析しました。すると、胚中心B細胞の一部でBcl6の発現が低下していることが分かりました(図1)。また、このBcl6の発現が低下している胚中心B細胞は、他の胚中心B細胞と異なり、プラズマ細胞への分化に必須の転写因子IRF4[9]を強く発現していること、また細胞表面にCD69という分子マーカーを持つことを見いだしました。そこで、Bcl6の発現が低下、CD69を発現していることから、この胚中心B細胞を「Bcl6loCD69hi細胞」と呼ぶことにしました。
続いて、Bcl6loCD69hi細胞が、本当にプラズマ細胞の前駆細胞であるかどうかを検証しました。まず、黒崎チームリーダーらが以前報告した胚中心B細胞の運命追跡システム[10] 注2)を使用して、胚中心由来のプラズマ細胞を分離し、胚中心B細胞と抗体遺伝子の配列を比較しました。その結果、Bcl6loCD69hi細胞と胚中心由来プラズマ細胞の抗体遺伝子の配列が似ていたことから、Bcl6loCD69hi細胞がプラズマ細胞へ分化したと考えられました。
また、Bcl6loCD69hi細胞は、病原体との親和性の高い良質な抗体を生み出す遺伝子変異を多く持つことも明らかとなりました。さらに、Bcl6loCD69hi細胞は胚中心B細胞に特徴的な遺伝子の発現を失っていること、逆にプラズマ細胞に特徴的な遺伝子を発現し始めていることが明らかとなりました。これらの結果から、胚中心B細胞の中でもBcl6loCD69hi細胞は、プラズマ細胞への分化が運命づけられた前駆細胞であると考えられます。
胚中心B細胞がプラズマ細胞へと分化するには、濾胞性ヘルパーT細胞(Tfh細胞)からのシグナルが必要であることが知られています。実際に、Bcl6loCD69hi細胞では、Tfh細胞からのシグナルが、CD40[11]という受容体を介して、他の胚中心B細胞よりも強く入っていることが分かりました。そこで、胚中心B細胞上でCD40タンパク質の発現を減少させたところ、プラズマ細胞への分化が半分程度に減少しました(図2)。このことから、Tfh細胞を介したヘルプシグナル[12]の量がプラズマ細胞への分化を制御していることが分かりました。
では、なぜプラズマ細胞の前駆細胞は、Tfh細胞から強いヘルプシグナルを受けられるのでしょうか。Bcl6loCD69hi細胞は、接着分子であるICAM-13[13]やSLAM[14]を他の胚中心B細胞よりも多く発現し、実際にTfh細胞とより効率良く結合できることが明らかになりました(図3)。このTfh細胞との結合を阻害するとIRF4の発現量が低下し、Bcl6loCD69hi細胞数も減少しました。以上の結果から、Tfh細胞とBcl6loCD69hi細胞の安定的な相互作用が、胚中心B細胞をプラズマ細胞の前駆細胞へと誘導するのに重要であることが示されました(図4)。
注2)Shinnakasu R et al. Regulated selection of germinal-center cells into the memory B cell compartment. Nat. Immunol.17 (2), 861-9, 2016
今後の期待
ワクチン療法の目的は、細菌・ウイルス感染に最も有効な抗体を誘導することです。本研究は高親和性の“良質”な抗体を産生するプラズマ細胞が誘導される経路を明らかにしました。したがって、今回の成果を応用し、高親和性の抗体をつくるプラズマ細胞を効率良く誘導する方法を開発することが、新しいワクチン戦略の一つの鍵になると期待できます。
原論文情報
Wataru Ise, Kentaro Fujii, Katsuyuki Shiroguchi, Ayako Ito, Kohei Kometani, Kiyoshi Takeda, Eiryo Kawakami, Kazuo Yamashita, Kazuhiro Suzuki, Takaharu Okada and Tomohiro Kurosaki; “T follicular helper cell-germinal center B cell interaction strength regulates entry into plasma cell or recycling GC cell fate”, Immunity, DOI:10.1016/j.immuni.2018.03.027
発表者
理化学研究所
生命医科学研究センター 分化制御研究チーム
チームリーダー 黒崎 知博(くろさき ともひろ)
大阪大学 免疫学フロンティア研究センター 分化制御研究室
特任准教授(常勤) 伊勢 渉(いせ わたる)
報道担当
理化学研究所 広報室 報道担当
大阪大学 免疫学フロンティア研究センター (IFReC) 企画室
補足説明
-
- 抗体
- プラズマ細胞が産生するタンパク質。特定のタンパク質など抗原を認識して結合し、無毒化(中和)する働きを持つ。
-
- B細胞
- 免疫細胞の一種。細胞表面にあるB細胞抗原受容体と呼ばれるタンパク質で、病原体などの抗原を認識し、抗体を産生する。B細胞は、抗原の刺激に応じて胚中心B細胞、記憶B細胞、プラズマ細胞へと分化する。
-
- 胚中心
- 免疫応答の際に、リンパ節や脾臓などの免疫組織において誘導される微小構造。胚中心では、B細胞が活発に増殖するとともに、抗体遺伝子に変異が起こり、より親和性の高い抗体ができる。
-
- プラズマ細胞
- B細胞が終末分化した細胞。形質細胞とも呼ばれる。抗体(免疫グロブリン)の合成と分泌に特化した細胞。
-
- 濾胞性ヘルパーT細胞(Tfh細胞)
- ヘルパーT細胞の一種。T細胞領域から濾胞へ移動して、B細胞の働きを補助できるように変化したT細胞。細胞表面分子を介した相互作用や、サイトカインと呼ばれる液性因子を分泌してB細胞の働きを調節する。胚中心の誘導と胚中心B細胞の選択に必須。
-
- 転写因子
- 遺伝子の発現を調節するタンパク質。多くはDNAとの結合部位を持つ。標的遺伝子の調節領域(プロモーターなど)に結合し、標的遺伝子の発現を活性化、あるいは抑制する。
-
- Bcl6
- Bcl6は転写因子として機能すると考えられ、多くの遺伝子の発現制御に関与している。特に、Bcl6は胚中心B細胞の分化に必須である。胚中心B細胞はBcl6を高発現するが、記憶B細胞やプラズマ細胞はBcl6を発現しない。Bcl6はB-cell lymphoma 6の略。
-
- レポーターマウス
- 各種のイメージング手法などを用いて遺伝子発現をモニターできるマウス。
-
- IRF4
- IRF4は多くの遺伝子の発現制御に関与する転写因子。B細胞からプラズマ細胞への分化に必須の因子であり、プラズマ細胞で高発現している。IRF4はInterferon regulatory factor 4の略。
-
- 胚中心B細胞の運命追跡システム
- 胚中心B細胞はスフィンゴシン1リン酸受容体(S1pr2)を発現するが、ナイーヴB細胞、記憶B細胞、プラズマ細胞はS1pr2を発現しない。S1pr2-ERT2creトランスジェニックマウスにタモキシフェンを投与することで、胚中心B細胞およびそこから分化した記憶B細胞やプラズマ細胞を不可逆的にラベルすることが可能となり、胚中心B細胞の運命を追跡することができる。
-
- CD40
- 腫瘍壊死因子レセプター(TNFR)スーパーファミリーの一つで、全ての成熟B細胞に発現する分子。CD40はT細胞のCD154(CD40リガンド)と結合し、B細胞に増植や分化を誘導するシグナルを伝達する。
-
- ヘルプシグナル
- T細胞がB細胞を活性化するために伝達するシグナル。T細胞上のCD154(CD40リガンド)やT細胞から産生される種々のサイトカイン(インターロイキン4やインターロイキン21など)がB細胞上のリガンドやレセプターに結合することによって伝達される。
-
- ICAM-1
- 免疫グロブリンスーパーファミリーに属する接着分子。CD54とも呼ばれる。リンパ球、内皮細胞など多くの細胞に恒常的に発現している。ICAM-1は細胞接着分子LFA-1(リンパ球機能関連抗原1)と結合し、炎症や免疫応答での細胞間相互作用に重要な役割を果たす。ICAM-1はIntercellular adhesion molecule 1の略。
-
- SLAM
- 免疫グロブリンスーパーファミリーに属する。CD150とも呼ばれる。相手の細胞上のSLAMに対するリガンドとして作用する。SLAMの発現はB細胞、樹状細胞、活性化T細胞にみられ、B細胞の刺激、増植誘導、アポトーシスの阻害などの機能に関与している。SLAM はSignaling lymphocyte activation moleculeの略。
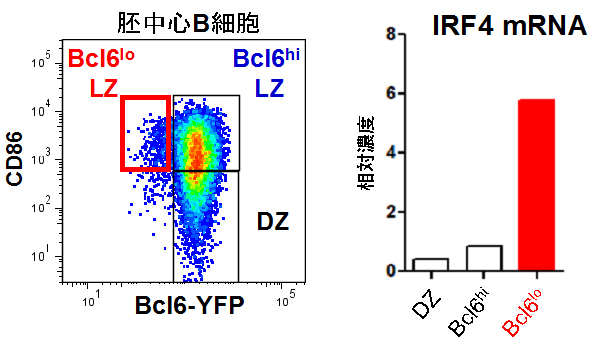
図1 胚中心B細胞に存在するBcl6の発現が低下している細胞
Bcl6を黄色蛍光色素(YFP)で標識したBcl6-YFPレポーターマウスを抗原で免疫した後に解析したところ、胚中心の明領域(Light zone, LZ)に、Bcl6-YFPの発現が低いB細胞(Bcl6lo細胞)が存在した(左の赤枠内)。CD86はLZ B細胞が高発現する細胞表面分子。このBcl6lo細胞を分離して遺伝子発現を解析したところ、他の胚中心B細胞と比較してIRF4を強く発現することが判明した(右の赤棒)。
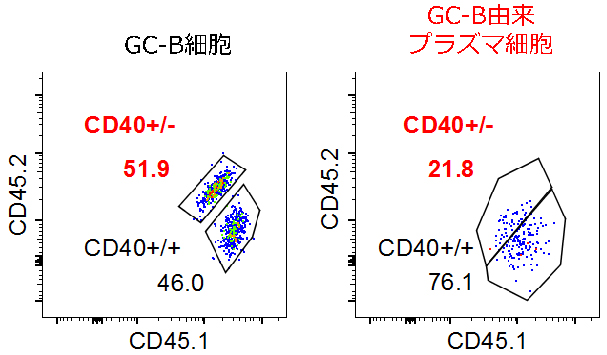
図2 胚中心(GC)B細胞のCD40発現量とプラズマ細胞分化
CD40を正常に発現するB細胞(CD40+/+)とCD40の発現を減少させたB細胞(CD40+/-)を1:1の比率でマウスに移入し、抗原刺激後、プラズマ細胞への分化能を比較した。CD40の発現が減少したCD40+/-胚中心B細胞は正常に生存することができたが(左)、プラズマ細胞への分化能は約半分に低下していた(右)。CD45.1(X軸)とCD45.2(Y軸)は細胞表面分子で、CD40+/+細胞(CD45.1+CD45.2-)とCD40+/-細胞(CD45.1+CD45.2+)を識別するために検出した。
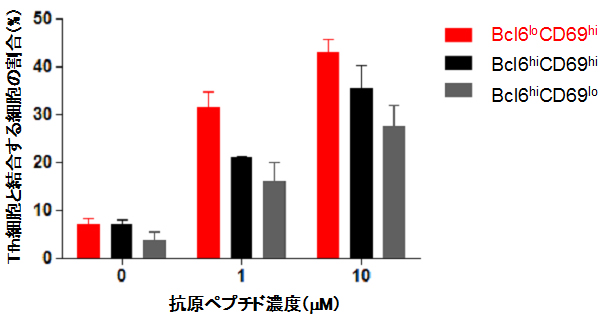
図3 胚中心B細胞とTfh細胞の結合効率
胚中心B細胞を分離し、抗原ペプチドの存在下、B細胞とTfh細胞の結合を比較した。他の胚中心B細胞と比較して、Bcl6loCD69hi細胞(赤棒)はTfh細胞とより効率よく結合することが分かった。
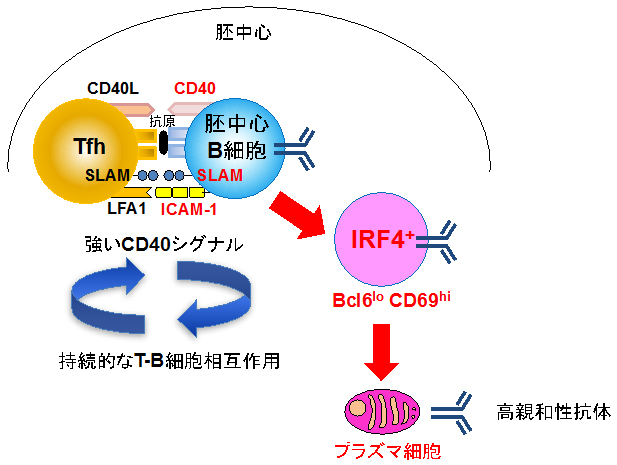
図4 良質な抗体を作るプラズマ細胞が誕生する経路
胚中心B細胞(青)のうちTfh細胞(黄)と持続的に相互作用したものがBcl6loCD69hiIRF4+細胞(ピンク)となり、その後良質な高親和性抗体を作る「プラズマ細胞」に分化する。