2023-07-03 東北大学
学際科学フロンティア研究所 新領域創成研究部
准教授 奥村 正樹
【発表のポイント】
- タンパク質が活性を示す上で必要不可欠な3次元構造を形成するフォールディングを、高い効率で促進する初めての人工ジスルフィド分子pMePySSを開発しました。
- pMePySS は酵素に準ずる機能を保有し、タンパク質の立体構造形成に重要となるジスルフィド結合の形成を促進することが分かりました。また添加量も、に対して、1当量(理論上要する最小量)で十分な効果を発揮することを確かめました。
- 構造異常タンパク質が引き起こすパーキンソン病やアルツハイマー病、2型糖尿病などのミスフォールディング病に対し、酵素代替による新たな治療薬の開発だけでなく、インスリンや抗体医薬などのタンパク質製剤の合成効率向上に貢献することが期待されます。
【概要】
東京農工大学大学院工学府の岡田隼輔(博士後期課程修了)、松本陽佑(博士前期課程修了)、大学院工学研究院の村岡貴博教授、東北大学学際科学フロンティア研究所の奥村正樹准教授、東海大学理学部の高橋莉奏(博士前期課程学生)、荒井堅太講師、関西学院大学理学部の金村進吾助教の研究グループは、変性状態注1)のタンパク質に対して、1当量添加でフォールディングを効率的に進める合成化合物pMePySS の開発に成功しました。ピリジニウム基とチオール/ジスルフィド基の2連結構造が、ジスルフィド結合連結構造が、ジスルフィド結合注2)形成を伴う酸化的タンパク質フォールディング形成を伴う酸化的タンパク質フォールディング注3)を促を促進する進する効果的な分子構造であることを見出しました。効果的な分子構造であることを見出しました。
アミノ酸が連結して作られるポリペプチドは、天然構造注1)と呼ばれる特定の三次元構造を形成して、タンパク質としての機能を獲得します。この天然構造を形成する過程をポリペプチド鎖の折りたたみ、フォールディング、と呼びます。タンパク質は、インスリンや抗体医薬などバイオ医薬品としても広く利用され、その社会的重要性は近年急速に高まっています。フォールディングを効率よく進める材料や技術開発は、タンパク質製剤の生産効率の向上に直結する重要な課題です。
医薬品として用いられるものも含め、タンパク質の多くは、システイン残基注4)間でのジスルフィド結合形成を伴いながらフォールディングを行います。ジスルフィド結合形成は酸化反応であるため、その形成を伴うフォールディングは酸化的タンパク質フォールディングと呼ばれます。酸化的タンパク質フォールディングを促進する人工化合物として、チオール/ジスルフィド構造を中心にこれまでも開発が行われてきました。しかし、従来のチオール/ジスルフィド化合物は、いずれもタンパク質に対して過剰に添加し、フォールディング促進が行われてきました 。過剰量添加を要する点で、従来の化合物の効率は十分に高いものと言えない現状にありました。
本研究では、生体内で広く見られるメチル化反応に注目し、チオール/ジスルフィド化合物に対するメチル化による酸化的タンパク質フォールディングの促進効率向上を検討しました。その中で開発した化合物 pMePySSが、還元変性タンパク質(ウシ膵臓トリプシンインヒビター、BPTI)に対して、ジスルフィド結合当り1当量添加で最大74%の収率で天然構造体を与えました。これは、従来の人工フォールディング促進化合物を過剰量用いた場合と比べても同等の収率であり、pMePySSが従来化合物と比べて、添加量基準で10倍以上高い効率でフォールディングを進めることが示されました。pMePySSは、インスリンのフォールディングに対しても1当量添加で促進効果を示しました。酸化型グルタチオンGSSG注5)を用いる従来法と比べて、pMePySSは、4.2倍高い効率でインスリン天然構造体の形成を進めました。
この成果は、構造異常タンパク質が引き起こすパーキンソン病やアルツハイマー病、2型糖尿病などのミスフォールディング病に対する治療薬の開発や、インスリンや抗体医薬などのタンパク質製剤の合成効率の向上に貢献すると期待されます。
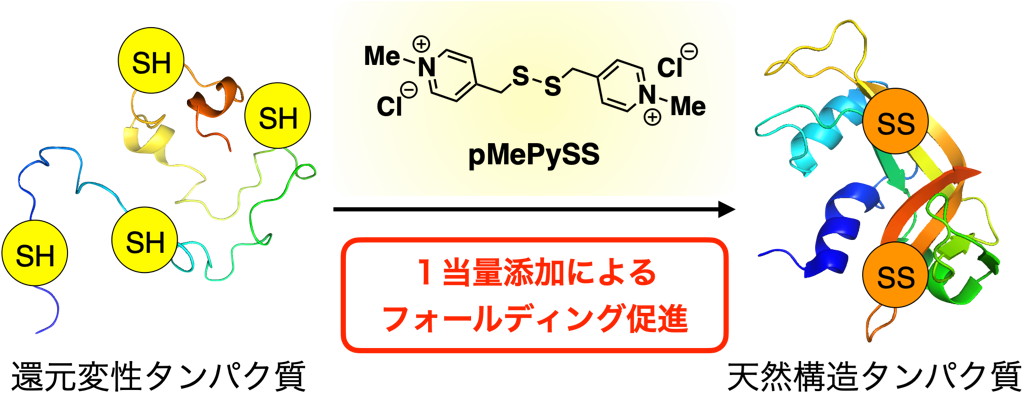
図1 酸化的タンパク質フォールディングの概要と本研究で開発したpMePySS
左に示す還元変性タンパク質は、システイン残基の側鎖がチオール基(SH)の状態にあり、分子全体として構造がほどけている。還元変性タンパク質に対してpMePySSが反応することでフォールディングが進行し、右に示す天然構造タンパク質が作られる。天然構造タンパク質は、システイン残基の側鎖がジスルフィド結合(SS)を形成し、分子全体が折り畳まれた状態にある。
【用語解説】
注1 変性状態・天然構造
タンパク質は、それ自身が持つアミノ酸配列に応じて特定の立体構造を形成する。タンパク質が生理的条件下において形成する機能的な立体構造を天然構造と呼ぶ。それに対して、温度やpH、酸化還元や塩濃度などの外部環境の変化により、タンパク質が天然構造を失うことを変性と呼ぶ。
注2 ジスルフィド結合
ポリペプチド鎖中のシステイン残基の側鎖に含まれるチオール基(SH )が酸化され、硫黄原子間で形成される共有結合。タンパク質の立体構造を安定化する役割や機能調節に関わる。
注3 酸化的タンパク質フォールディング
ジスルフィド結合形成と共役してポリペプチド鎖が折り畳み、タンパク質の立体構造が形成される反応。インスリンや免疫グロブリンなどの医学的に重要なタンパク質の多くも、この反応を経て活性な立体構造を形成し、生理機能を獲得する。
注4 システイン残基
側鎖にチオール基を持つアミノ酸残基。チオール基が酸化され、ジスルフィド結合を形成する。
注5 酸化型グルタチオン
GSSGグルタチオンは、グルタミン酸、システイン、グリシン の3つのアミノ酸残基から成るペプチドである。システイン残基のチオール基が酸化され、グルタチオン2分子の間でジスルフィド結合を形成したものを酸化型グルタチオンと呼ぶ。
問い合わせ先
(研究に関すること)
東北大学学際科学フロンティア研究所
准教授 奥村正樹(おくむら まさき)
(報道に関すること)
東北大学学際科学フロンティア研究所
特任准教授 藤原英明(ふじわら ひであき)