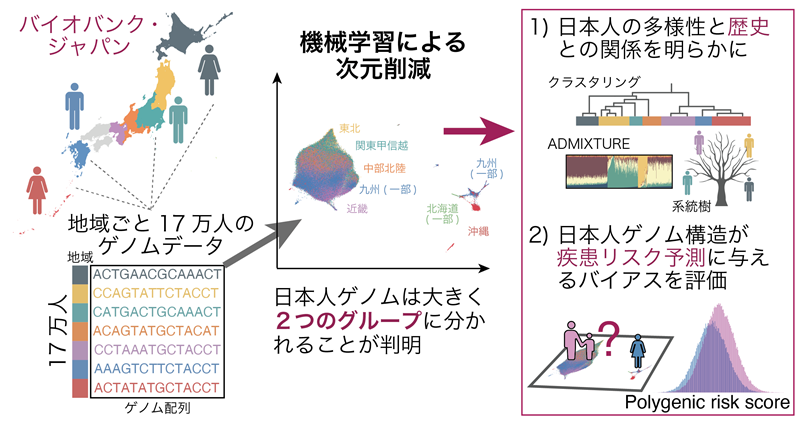
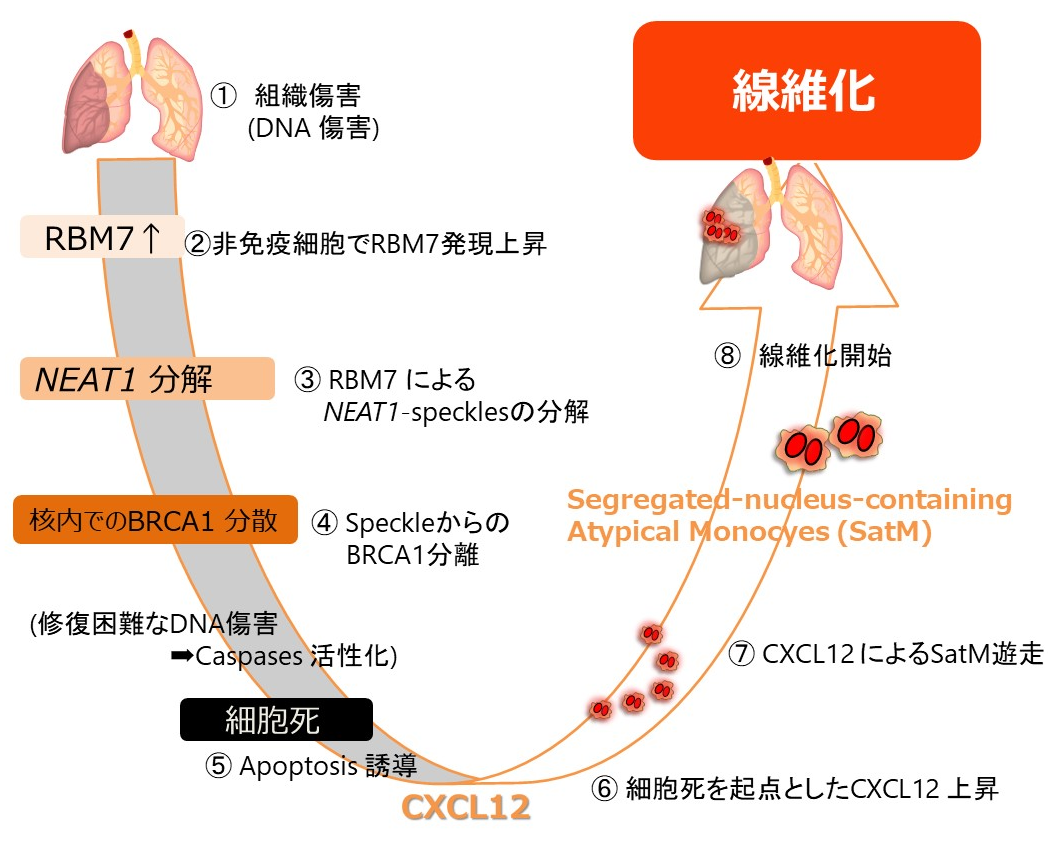
2020-03-26 自治医科大学,Johns Hopkins大学,大阪大学,日本医療研究開発機構
概要
自治医科大学の大学院生Nawin Chanthra、魚崎英毅准教授らの研究グループはラミニン-511および521が多能性幹細胞から得られた心筋細胞の成熟を促進させる細胞外マトリックス*1であることを発見しました。この研究成果は自治医科大学 阿部朋行講師、花園豊教授、大阪大学 関口清俊教授、Johns Hopkins大学 大学院生Matthew Miyamoto、Chulan Kwon准教授との共同研究によるもので、Scientific Reports誌に掲載されました。
背景
虚血性心疾患を含む心疾患は日本の死因第2位です。また、医薬品開発で人に対する毒性が確認され研究が中止になることが少なくありませんが、心臓に対する毒性は重大な副作用の一つです。2006年にiPS細胞*2が発明され、iPS細胞から分化誘導*3した心筋細胞は、再生医療への応用が期待されています。さらに、遺伝性心筋症や不整脈など心疾患の研究、創薬における心毒性の評価などの用途でも期待されています。しかしながら、iPS細胞から得られる心筋細胞は、胎児相当の成熟度と非常に未熟であり、疾患研究や創薬での応用には限界があることが知られていました。そのため、心筋細胞の成熟を進めるための研究が世界中で行われてきました。心筋細胞の成熟は細胞の形、機能、代謝など多面的な評価が行われますが、いずれも専門的な技術が必要となることが多く、また時間もかかるなどの問題点がありました。一方、分化誘導法の研究などでは、GFPなどの蛍光タンパクを特定の細胞に分化した時だけに発現させる方法を用いることで研究が進んできました。そこで、本研究では心筋細胞が成熟した時に発現する遺伝子に対して、蛍光タンパクをノックイン*4した新しい心筋細胞成熟レポーターの開発を行いました。さらに、蛍光を指標として、細胞外マトリックスのスクリーニングを行うことで成熟を促進する細胞外マトリックスの同定を試みました。
詳細な説明
マウスES細胞から分化誘導した心筋細胞が胎生後期相当までしか成熟しないという過去のデータより、成熟レポーターに用いる遺伝子候補として、新生仔期以降に発現する遺伝子が適していると考えられます。マウス心臓の経時的遺伝子発現解析より、Myom2遺伝子*5が新生仔期以降に発現することを同定し、マウスES細胞のMyom2遺伝子座に赤色蛍光タンパクTagRFPをノックインしたMyom2-RFP マウスES細胞を樹立しました。
Myom2-RFPマウスES細胞から心筋細胞を分化誘導すると、分化早期にはRFPが発現しませんが、長期間培養することで、RFPが発現し、さらに時間経過に従ってRFPの陽性率、蛍光輝度が増加することがわかりました。RFP陽性心筋細胞と陰性心筋細胞を比較すると、形態、サルコメア構造、二核化の程度、カルシウムトランジェント、遺伝子発現などすべての点でRFP陽性細胞がより成熟していることが明らかになりました。また、RFPはMyom2と融合タンパクを形成し、Myom2同様サルコメアのM-lineに局在します。高倍率・高時間分解能の蛍光顕微鏡を用いることで、RFPの動きを観察し、サルコメアの短縮を観察することも可能になりました。
発生・成長過程の心臓内では細胞外マトリックスの発現がダイナミックに変化します。そこで、市販されている細胞外マトリックスであるコラーゲンⅠ、Ⅲ、Ⅳ、ファイブロネクチンと、大阪大学関口研究室で開発されたラミニン111、121、211、221、311、321、332、411、421、511、521の各種E8フラグメントについてMyom2-RFPの陽性率と蛍光輝度を指標としたスクリーニングを実施しました。15種類の細胞外マトリックスのうち、ラミニン511および521のみがMyom2-RFPの蛍光輝度を強力に増加させました。また、更なる解析で、細胞サイズやサルコメア長、二核化率の増加、成熟した心室筋で電気的な刺激を伝搬するギャップジャンクションタンパクConnexin-43の発現増加と細胞膜上への局在、ミトコンドリア機能の指標である酸素消費速度の増加が認められ、Myom2-RFPを用いたサルコメア短縮率も増加するなど、ラミニン511や521によって心筋細胞の成熟が進むことが明らかになりました。
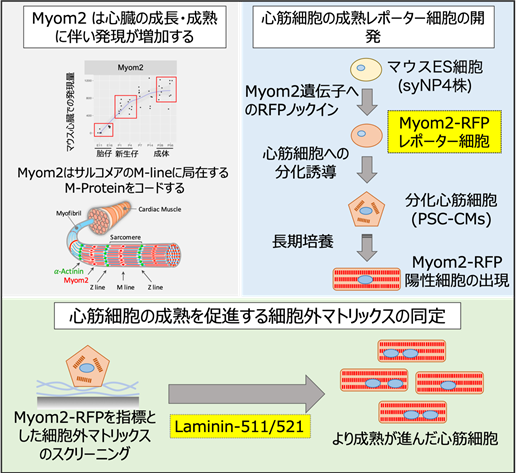
図:研究成果のまとめ(左上)心臓の成長・成熟に伴う遺伝子としてサルコメアM-lineに局在するMyom2を同定した。
(右上)マウスES細胞のMyom2遺伝子座にRFPをノックインしたレポーター細胞を樹立した。ノックインES細胞を心筋細胞へと分化誘導し、さらに成熟が促進することが知られている長期培養することでMyom2-RFP陽性細胞が出現した。また、Myom2-RFP陽性細胞がRFP陰性細胞と比べて成熟した心筋細胞であることを確認した。
(下)Myom2-RFPを指標としたスクリーニングを実施し、Laminin-511および521を同定した。
今後の展開と社会へのインパクト
本研究ではマウスES細胞由来の心筋細胞を使っており、ラミニン511や521がヒトiPS細胞由来の心筋細胞でも同様に効果があるのかは今後の検討課題です。私達は、マウスおよびヒト心臓での経時的な遺伝子発現解析の比較から、新しい成熟マーカー遺伝子を多数同定しています。Myom2-RFPやこれら新しい成熟マーカーを組み合わせ、新たな因子の探索を進めることで、より心筋細胞の成熟を進められるようになると期待されます。本研究によりその第一歩を踏み出したと考えています。
研究プロジェクトについて
本研究は、日本医療研究開発機構(AMED)「再生医療実現拠点ネットワークプログラム(幹細胞・再生医学イノベーション創出プログラム)」の「未成熟心筋細胞の成熟心筋細胞へのリプログラミングとその分子メカニズムの解明」(研究開発代表者:魚崎英毅、課題番号18bm0704012h0003)および「再生医療実現拠点ネットワークプログラム(技術開発個別課題)」の「幹細胞培養用基材の開発」(研究開発代表者:関口清俊、課題番号17bm0404005h0005)の一環として実施されました。
その他の研究費
日本学術振興会科学研究費助成事業若手研究(19K17613)、国際共同研究加速基金(国際共同研究強化(B))(19KK0219)、ノバルティス研究助成、日本心臓血圧研究振興会榊原記念研究助成金、武田科学振興財団医学系研究助成、上原記念生命科学財団研究奨励金、先進医薬研究振興財団循環医学研究助成、日本循環器学会基礎研究助成(以上、研究代表:魚崎英毅)、自治医科大学大学院医学研究科若手スタートアップ研究費、同、研究奨励賞(研究代表:Nawin Chanthra)の支援を受けました。
用語説明
- *1 細胞外マトリックス
- 細胞の外にある主にタンパクからなる構成成分。細胞の足場となるだけでなく、形態形成、分化に関わり、細胞表面の受容体との相互作用でシグナル伝達も担う。また、液性因子とも相互作用するなど、様々な機能を有する。本研究で扱った細胞外マトリックスはラミニン、コラーゲン、ファイブロネクチンであるが、それ以外にも様々な細胞外マトリックスが知られている。
- *2 iPS細胞
- Induced Pluripotent Stem Cells。2006年に山中教授らにより発明された、体細胞に複数の転写因子を発現させることで、得られる多能性幹細胞。胚性幹(ES)細胞と同様、様々な体内の細胞へと分化できる。
- *3 分化誘導
- 多能性幹細胞に対して、化合物やサイトカインなど液性因子、細胞外マトリックスを適宜加えることで目的の細胞への分化を誘導すること。
- *4 ノックイン
- ゲノム上の任意の場所に外来DNAを挿入すること。ノックインを行うことで、本来の遺伝子発現にあった外来DNAの発現を得ることができる。本研究ではMyom2遺伝子の停止コドンをTagRFPで置き換えることで、Myom2とTagRFPが融合した、Myom2-RFPタンパクを発現させている。この場合、TagRFPはMyom2の発現量を反映するだけではなく、その局在も反映することができる。
- *5 Myom2遺伝子
- 横紋筋(骨格筋・心筋)を特徴づける横紋構造(サルコメア)の構成要素であり、サルコメアのM-lineに局在するMyomesin 2(あるいはM-proteinとも呼ばれる)をコードしている。新生仔以降に発現が増加する遺伝子の一つ。
論文情報
- 論文タイトル
- A Novel Fluorescent Reporter System Identifies Laminin-511/521 as Potent Regulators of Cardiomyocyte Maturation
- 著者名
- Nawin Chanthra1, Tomoyuki Abe1, Matthew Miyamoto2,3, Kiyotoshi Sekiguchi4, Chulan Kwon2,3, Yutaka Hanazono1,5, Hideki Uosaki1,5,*
本論文は「Scientific Reports」に2020年3月6日(金)にオンライン掲載されました。
- 所属
-
- 自治医科大学 分子病態治療研究センター 再生医学研究部
- Johns Hopkins大学Division of Cardiology
- Johns Hopkins大学Institute for Cell Engineering
- 大阪大学 蛋白質研究所 マトリクソーム科学(ニッピ)研究室
- 自治医科大学 先端医療技術開発センター 幹細胞創薬基盤
お問合せ先
研究に関すること
魚崎 英毅(ウオサキ ヒデキ)
自治医科大学
分子病態治療研究センター 再生医学研究部
AMED事業に関すること
国立研究開発法人日本医療研究開発機構
戦略推進部 再生医療研究課