2021-05-06 株式会社リボミック,大阪大学,日本医療研究開発機構
研究成果のポイント
- 軟骨無形成症(ACH)モデルマウスと患者由来iPS細胞で、FGF2阻害により骨の成長が促進された
- 治療法のない希少疾患である軟骨無形成症(ACH)に対する治療薬の開発が期待される
- 核酸医薬としてのアプタマーの実用化の加速に寄与する
概要
軟骨無形成症A(chondroplasia、ACHと略)は新生児約25,000人に対して1人の頻度で発生する希少疾患で、現在有効な治療法がほとんどなく、新規医薬品開発が求められている厚生労働省の指定難病です。この疾患は、線維芽細胞増殖因子(FGF)に対する受容体のひとつであるFGFR3の突然変異によって発症し、四肢短縮による低身長を主な症状とします。
我々は、ACHモデルマウス※1を用いた薬理試験において、抗FGF2アプタマー※2(RBM-007)が低身長改善効果を示すことを発見し、その作用機序を明らかにしました。また、ACH患者由来のiPSC(人工多能性幹細胞)は軟骨細胞への分化が不全になっていますが、このiPS細胞を試験管内で培養する際、RBM-007を添加することにより、軟骨細胞への分化が可能となりました。さらには、免疫不全マウスにこのRBM-007を添加した分化細胞を移植すると、マウスの体内で軟骨組織が形成されることが明らかになりました。これらの結果から、RBM-007がACHに対する新薬となりうることが強く示唆されました。
この研究は、国立研究開発法人日本医療研究開発機構(AMED)難治性疾患実用化研究事業「抗FGF2アプタマー(RBM-007)を用いた軟骨無形成症治療薬の開発」、および創薬支援推進事業・希少疾病用医薬品指定前実用化支援事業「抗FGF2アプタマーを用いた軟骨無形成症治療薬の開発」の支援により行われたもので、本研究の成果は、米国科学誌「Science Translational Medicine」に、2021年5月5日(米国東部時間)に公開される予定です。
研究の背景
軟骨無形成症(ACH)の原因となる遺伝子は22種類のFGFタンパク質に対する4種類のFGF受容体のひとつFGFR3です。遺伝様式は常染色体優性遺伝ですが、約90%以上は新規突然変異によるものとされ、健康な両親から生まれます。患者の95%にFGFR3のG380R点変異(380番目のグリシンがアルギニンに置換される変異)をみとめます。日本では6,000人、世界では250,000人の患者が推定されております。
ACHでは、FGFタンパク質の結合により変異型FGFR3が活性化すると骨を作るための軟骨の形成にブレーキがかかり、骨の伸長が抑制されて、低身長となります(図1)。
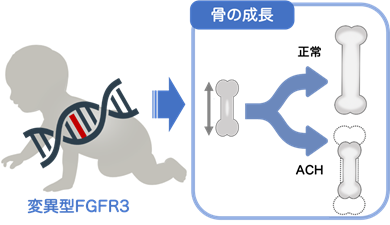
図1.軟骨無形成症の発症機序
そのため、FGFR3の活性化を阻害することで、骨の伸長を回復させるような医薬品の開発が試みられています。その中で、我々はFGFR3に結合するFGFメンバーの中でも主要なプレーヤーであるFGF2に注目し、その阻害剤がACHの根本的な治療薬となりうるのではないかと考え本研究を実施しました。
研究の内容
今回我々は、FGF2阻害剤としてFGF2に対する特異的RNAアプタマー(RBM-007)を用いました。RBM-007は37鎖長のRNA分子でFGF2に対して特異的かつ強い結合活性をもち、FGF受容体への結合を完全に阻害することができます。
本研究では、1)軟骨細胞を用いたin vitro※3評価系、2)ACHモデルマウスを用いたin vivo※4評価系、さらに、3)ACH患者由来のiPS細胞を用いたin vitro/in vivo評価系を用い、RBM-007の効果を検証しました。
その結果、
- RBM-007がFGFR3を介したシグナル伝達を完全に遮断すること、
- ACHの原因となるFGFR3変異を移入したことによって、短縮した骨長がRBM-007の投与による軟骨成長板の機能活性化により回復すること(図2)、
- 軟骨細胞への分化能が失われたACH患者由来のiPS細胞がRBM-007の添加により軟骨細胞への分化能を回復し、移植した免疫不全マウスにおいて軟骨様組織を形成することが明らかになりました。
これらの結果から、RBM-007はACHに対する新規治療薬になることが期待されます。
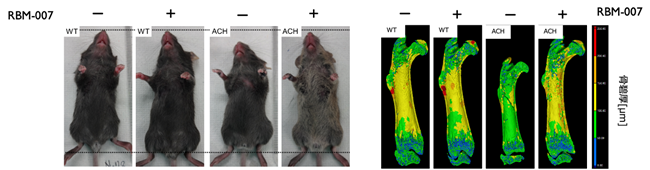
図2.ACHモデルマウスの身長と大腿骨長に対するRBM-007投与の効果
WTは野生型のマウス、ACHは病態モデルマウスを示す。
研究成果の意義
軟骨無形成症(ACH)は未だ治療薬のない指定難病に定められている希少疾患であり、医薬品の開発が強く望まれています。本研究成果により、FGF2阻害剤であるRBM-007がACHモデルマウス並びに患者由来iPS細胞由来の骨の成長を促進させることが明らかになり、RBM-007は新規ACH治療薬として有望であると考えられます。
骨の成長に重要である軟骨を形成する器官(成長板)は太い骨の端(骨幹端)にあり、成長期に活発に増殖し、思春期が終わる頃にはその働きを停止します。しかしながら、ACHの患者さんは軟骨形成が不全のため、成長期の骨の成長を伴う身長増加が見られません。そのため、ACH治療薬は、軟骨の成長時期である幼少期から長期にわたって投与する必要があり、優れた安全性が求められます。現在、RBM-007は米国において加齢黄斑変性症に対する第Ⅱ相臨床試験が進行中であり、非臨床試験においても優れた安全性が確認されております。ACHに関しても、RBM-007は治験開始に必要な準備をすべて完了し、2020年7月に国内の1治験施設にて、RBM-007の安全性・忍容性及び薬物動態を調べることを目的とする、第Ⅰ相試験を開始いたしました。今後は、患者さんのために新規ACH治療薬の実現を目指すところです。
論文情報
- 掲載誌
- Science Translational Medicine
- タイトル
- RNA aptamer restores defective bone growth in FGFR3-related skeletal dysplasia
- 著者名
- Takeshi Kimura, Michaela Bosakova, Yosuke Nonaka, Eva Hruba, Kie Yasuda, Satoshi Futakawa, Takuo Kubota, Bohumil Fafilek, Tomas Gregor, Sara P. Abraham, Regina Gomolkova, Silvie Belaskova, Martin Pes, Fabiana Csukasi, Ivan Duran, Masatoshi Fujiwara, Michaela Kavkova, Tomas Zikmund, Josef Kaiser, Marcela Buchtova, Deborah Krakow, Yoshikazu Nakamura, Keiichi Ozono, Pavel Krejci
- DOI
- 10.1126/scitranslmed.aba4226
用語説明
- ※1 ACHモデルマウス
- FGFR3の遺伝子をACH疾患変異型に人為的に改変したマウス。ACH患者と共通する低身長を示す。
- ※2 アプタマー
- アプタマーとは、標的とするタンパク質の形状にフィットする立体構造をつくって結合し、その働きを阻害あるいは調節できる核酸分子。アプタマーは、SELEX法とよぶ人工進化技術によって、膨大な数の1本鎖核酸の中から標的タンパク質を「餌」にして標的に強い結合力をもつ分子を「魚釣り」と同じ原理で釣り上げて作製する。RBM-007はFGF2に対して特異的かつ高い親和性をもつ。RBM-007はすでに米国において、滲出型加齢黄斑変性に対する第Ⅱ相臨床試験が実施中である。
- ※3 in vitro
- in vitro(イン・ビトロ)とは、“試験管内で(の)”という意味で、試験管や培養器などの中でヒトや動物の組織を用いて、体内と同様の環境を人工的に作り、薬物の反応を検出する試験のことを表す。
- ※4 in vivo
- in vivo(イン・ビボ)とは、“生体内で(の)”という意味で、マウスなどの実験動物を用い、生体内に直接被験物質を投与し、生体内や細胞内での薬物の反応を検出する試験のことを表す。
お問い合わせ先
株式会社リボミック 広報担当
大阪大学 医学系研究科 小児科 教授 大薗恵一
AMED事業に関すること
国立研究開発法人日本医療研究開発機構
創薬事業部 創薬企画・評価課
難治性疾患実用化研究事業 担当
創薬支援推進事業・希少疾病用医薬品指定前実用化支援事業 担当