葉の成長過程における詳細な遺伝子発現マップを作成
2021-05-25 理化学研究所,横浜市立大学,ロンドン大学ロイヤル・ホロウェイ校
理化学研究所(理研)環境資源科学研究センターバイオ生産情報研究チームの持田恵一チームリーダー(横浜市立大学大学院客員教授)、高萩航太郎大学院生リサーチ・アソシエイト(研究当時、横浜市立大学大学院生命ナノシステム科学研究科)、ロンドン大学ロイヤル・ホロウェイ校のエンリケ・ロペス准教授らの国際共同研究チームは、パンコムギ(コムギ)の葉の発生過程について詳しく調べ、コムギの光合成機能は、2段階の葉緑体発生過程(色素体[1]増殖期と葉緑体成長期)を経て成立することを明らかにしました。
本研究成果は、作物の収穫高に影響する葉の発生や光合成機能の理解、および作物の生産性向上に有用な遺伝子の同定や育種に貢献すると期待できます。
今回、国際共同研究チームは、コムギの葉の成長方向に沿って、細胞の大きさ、葉緑体が細胞内に占める割合や葉緑体ゲノムのコピー数の変化といった細胞学的な観察を行い、葉原基細胞や葉肉細胞[2]とその内部で発達する葉緑体の状態から、コムギの葉の発生過程を15段階に分類しました。そして、各発生段階の葉組織について、葉緑体の分化と発達、細胞分裂の周期、タンパク質・遺伝子発現などの観点から調査しました。これらのデータを統合して、各発生段階を特徴付けるとともに、コムギの葉の発生に関してはこれまでで最も網羅的かつ詳細な遺伝子発現マップを作成しました。さらに、各発生段階において特徴的な細胞学的な変化と遺伝子発現状態から、コムギの葉における光合成機能が2段階の葉緑体の発生過程を経て成立することを明らかにしました。
本研究は、科学雑誌『Genome Biology』オンライン版(5月11日付)に掲載されました。
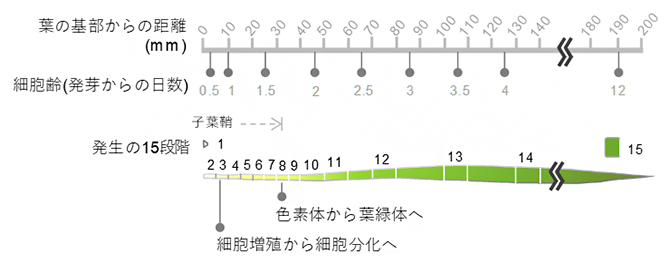
コムギの葉の発生過程(15段階)
背景
世界の人口は、2055年には100億人を超えると予想され、食料増産が求められるなか、作物の生産性の向上が課題となっています。コムギ、イネ、トウモロコシといった主要な穀物の生産性(収量性)は、光合成によって炭水化物を作る能力(ソース能)と、作った炭水化物を貯蔵する能力(シンク能)で決まるため、光合成能力の強化は収量性の高い作物の開発につながると考えられています。
コムギやイネといったイネ科植物の葉は、葉の基部から先端部に向かって発生が進むため、先端部に向かうほど発生の進んだ細胞で構成されていることが知られています。これを生かして、これまでにもイネ科植物の葉の基部から先端部に向かって葉組織を観察することで、発生に伴う時間的な変化が調べられてきました。しかし、葉の基部の茎頂組織に存在する分裂組織(メリステム)[3]から葉の原基組織が発生し先端に向かって成熟する過程における、葉緑体の発生過程と遺伝子発現の関係の全体像は未解明でした。
研究手法と成果
国際共同研究チームはまず、パンコムギ(コムギ)の葉の基部から先端部にわたる細胞を詳しく観察しました。コムギ葉の基部には、未分化の色素体である原色素体(プロプラスチド)[4]を持つ未分化な細胞や葉原基細胞が存在しています。また、先端部に向かうにつれて細胞内の色素体や葉緑体の数や大きさが変わり、成熟した葉肉細胞へと変化していきます。そこで、コムギの葉の基部から先端部における細胞について、その形態とともに原色素体や葉緑体の数や大きさを定量し、葉の発生過程を15段階(ステージ)に分類・定義しました(図1)。
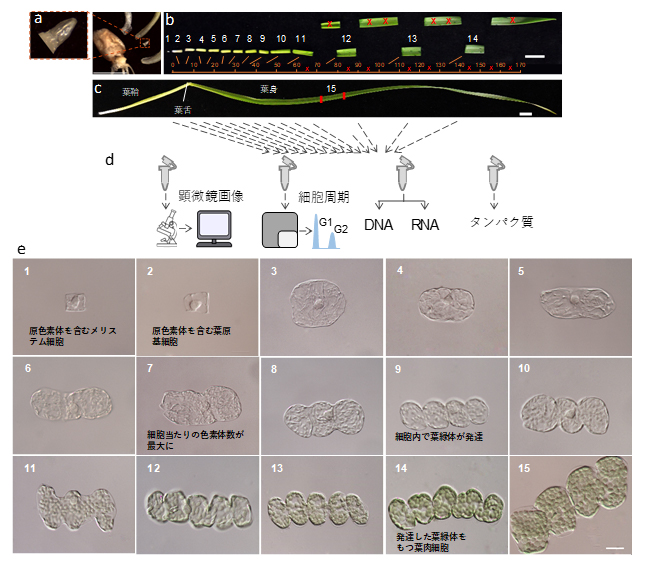
図1 コムギの葉の15段階にわたる発生過程
a)発芽6日後の葉の基部から取り出した茎頂組織のサンプル。スケールバーは5mm。
b)葉鞘と葉身を内部の形態的細胞な変化(e)に沿って13段階に分けた組織。スケールバーは10mm。
c)発芽14日後の完成した葉。スケールバーは10mm。
d)葉の発生過程を15段階の組織について、顕微鏡画像および細胞周期の定量を行うとともに、DNA、RNA、タンパク質を抽出し、分子生物学的な解析を行った。
e)葉の発生過程を15段階の組織で観察される細胞の顕微鏡画像。スケールバーは25μm。写真左上の数字は葉の発生段階の組織に対応する。
各段階の組織について、細胞や葉緑体の形態を調べるための顕微鏡画像、および葉緑体ゲノムのコピー数の変化を調べるための組織サンプルを収集するとともに、遺伝子の働きを調べるためのRNAやタンパク質を抽出し、葉肉細胞の発生過程のどの段階でどのような変化が細胞内で起きているかを詳細に調査するための試料を整備しました(図1d)。
まず、葉の発生段階の各RNA試料をRNA-seq法[5]により解析し、コムギゲノム上に見いだされた10万個あまりの遺伝子のうち、葉の発生段階で発現変動を示す約4万個の発現時期と発現量を明らかにしました。そしてこれらの遺伝子の発現や生物的機能が、葉肉細胞の分化と発達に沿って移り変わる軌跡(発生過程のトラジェクトリ[6])を初めて可視化しました(図2)。
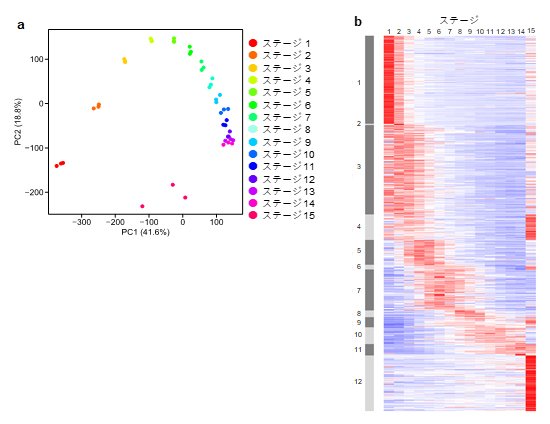
図2 遺伝子発現状態に基づいて描いたコムギの葉の発生過程のトラジェクトリ
a)コムギの葉の発生過程で発現が変動する約4万個の遺伝子の発現データを主成分分析することによって、各段階(ステージ)のサンプルの類似性を描画した、遺伝子発現から見た発生過程のトラジェクトリ。それぞれの点が、一つのサンプルに対応し、横軸は第一主成分軸、縦軸は第二主成分軸を示す主成分分析の結果で、距離が近い点ほどサンプル間での遺伝子発現が類似していると考えられる。
b)15段階の組織における発現パターンの類似性に基づいて、コムギ葉の発生過程で発現が変動する約4万個の遺伝子をグループ化し、発生ステージに沿うように並べた発現強度のヒートマップ(遺伝子発現マップの概観)。赤色が濃いほど、それぞれの遺伝子が15ステージの中で相対的に多く発現していることを示す。発現パターンの類似性に基づくグルーピングでは、大きく12の遺伝子グループに分類された(左端灰色の縦帯図の数字に対応)。
次に、各段階の組織について、細胞周期、細胞の大きさ、細胞当たりの色素体または葉緑体の数、細胞当たりの色素体または葉緑体の占める面積、色素体または葉緑体のゲノムDNA量、色素体または葉緑体リボソーム[7]と細胞質リボソーム量の比などの量的な変化を調査しました。これらの調査結果を統合して解析した結果、葉肉細胞が成熟して光合成が成立するまでの過程は2段階に分かれることが明らかになりました(図3)。
その2段階とは、細胞内の色素体が分裂することで、数が増加するステージ1~7の「色素体増殖期」と、細胞内で葉緑体が肥大化して細胞質の空間を埋めながら発達するステージ8以降の「葉緑体発達期」です(図3 a, b)。色素体と葉緑体の発達に関連するとされる遺伝子の発現の多寡は、ステージ8でちょうど入れ替わっていることからも、遺伝子発現制御による秩序だった発生の転換があることが示されました(図3c)。また、光合成に関連すると考えられる制御因子の遺伝子の発現パターンを重ね合わせることで、それぞれのステージでどのような遺伝子が制御されているかを推定しました(図3d)。
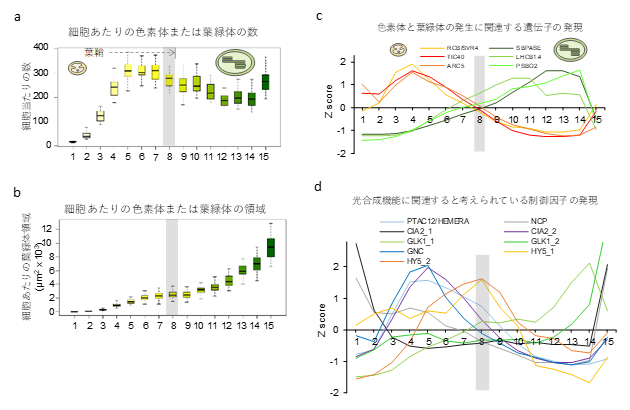
図3 コムギの葉の発生過程における細胞と遺伝子発現の変化
a-b)aは各ステージの細胞の画像解析から定量した細胞当たりの色素体または葉緑体の数の変化。bは細胞内に占める色素体または葉緑体の面積。色素体はステージ1から5にかけて細胞内で増加し、ステージ7まででほぼ最大化し、ステージ8以降、葉緑体に発達することが分かった。
c)色素体と葉緑体の発生に関連する遺伝子の発現は、ステージ8で入れ替わる。
d)光合成機能に関連すると考えられている制御因子の発現。
今後の期待
本研究により、主要作物でもあるコムギの葉の発生過程の詳細な遺伝子発現マップが作成されました。この遺伝子発現マップは、光合成機能が成立する過程の葉の遺伝子発現解析では、最も解像度の高いものといえます。さらに、各発生段階の組織についての細胞学的な定量解析結果との統合により、作物の収量性にも重要な光合成機能の成立過程において、どのような変化がいつ起こるかという参照情報として(図4)、コムギをはじめ、イネやトウモロコシといったイネ科作物の光合成機能を向上させる研究に有用な知見を与えると期待できます。
なお本研究は、主要作物の光合成機能向上により収量性向上を目指した育種等のための基盤的な情報を提供することで、国際連合が掲げる「持続可能な開発目標(SDGs)[8]」のうち「2.飢餓をゼロに」および「15.陸の豊かさも守ろう」への貢献が期待できる成果といえます。
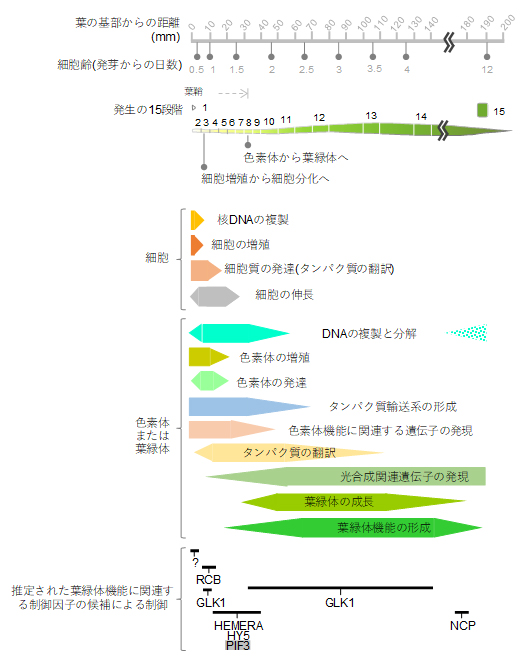
図4 本研究で明らかになったコムギの葉の発生過程における細胞内の変化
コムギの葉の発生過程を15段階に沿って、細胞レベル・色素体または葉緑体レベル・遺伝子発現レベルの変化を示した。
補足説明
1.色素体
植物や藻類などの細胞に存在し、光合成、物質の貯蔵、化合物の合成などを担う細胞小器官の総称。そのうち、形態や機能を分化させ、光合成色素を含み光合成を行うものが葉緑体である。
2.葉肉細胞
植物の葉の表皮細胞層の内側にある細胞で、細胞内に多数の葉緑体を持ち、光合成を行っている。
3.分裂組織(メリステム)
植物において、細胞分裂を活発に行い、未分化な細胞で構成されている組織のこと。茎側の分裂組織のことを茎頂分裂組織(茎頂メリステム)と呼び、その周辺部から葉の組織に分化する葉原基が発生する。
4.原色素体(プロプラスチド)
植物の茎や根の先端にある分裂組織の細胞に含まれている小さな色素体のこと。葉が発生して成長するのに伴い、葉緑体へと形態を変える。
5.RNA-seq法
細胞内で発現する遺伝子の転写物であるRNA分子を、網羅的に定量することで、どのような遺伝子がどれくらい働いているか(発現しているか)を調べる方法。
6.発生過程のトラジェクトリ
生物の発生や成長など、時間変化に沿って徐々に変化する生物の状態の変化のパターンを軌跡(トラジェクトリ)として表現したもの。網羅的な遺伝子発現データなどの、生物の細胞内の状態によって変動する多様な分子の変動データを、主成分分析などの次元削減することで描画されることが多い。
7.リボソーム
細胞におけるタンパク質合成を行う酵素複合体で、リボソームタンパク質とリボソームRNA(rRNA)で構成されている。植物の細胞では、核・葉緑体・ミトコンドリアの3種の細胞内小器官それぞれに別々のrRNA遺伝子があり、核で合成されたrRNAが細胞質細胞質のリボソーム合成に、葉緑体とミトコンドリアではそれぞれの細胞小器官でrRNA合成とリボソーム合成が行われる。本研究では、細胞質rRNAと葉緑体rRNAの量比を調べることで、葉の発生に伴う葉緑体のタンパク質合成機能の変化を調査した。
8.持続可能な開発目標(SDGs)
2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標。持続可能な世界を実現するための17のゴール、169のターゲットから構成され、発展途上国のみならず,先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる(外務省ホームページから一部改変して転載)。
国際共同研究チーム
理化学研究所 環境資源科学研究センター バイオ生産情報研究チーム
チームリーダー 持田 恵一(もちだ けいいち)
(横浜市立大学大学院客員教授)
大学院生リサーチ・アソシエイト(研究当時) 高萩 航太郎(たかはぎ こうたろう)
(横浜市立大学大学院 生命ナノシステム科学研究科(研究当時))
テクニカルスタッフⅠ 山口(上原) 由紀子(やまぐち(うえはら) ゆきこ)
テクニカルスタッフ(研究当時) 井上 小槙(いのうえ こまき)
ロンドン大学ロイヤル・ホロウェイ校
准教授 エンリケ・ロペス(Enrique López-Juez)
リサーチ・アソシエイト ナレシュ・ロウディヤ(Naresh Loudya)
大学院生 プリアンカ・ミシュラ(Priyanka Mishra)
教授 ラズロ・ボグレ(Laszlo Bogre)
研究支援
本研究の一部は、日本学術振興会(JSPS)科学研究費補助金若手研究(A)「全ゲノム情報に基づくゲノム倍数性進化過程の再構築(研究代表者:持田恵一)」および科学技術振興機構(JST)戦略的基礎研究創造事業CREST「環境変動に対する植物の頑健性の解明と応用に向けた基盤技術の創出」の研究課題「データ科学に基づく作物設計基盤技術の構築(研究代表者:平山隆志)」の支援を受けて実施しました。
原論文情報
Naresh Loudya, Priyanka Mishra, Kotaro Takahagi, Yukiko Uehara-Yamaguchi, Komaki Inoue, Laszlo Bogre, Keiichi Mochida, Enrique López-Juez, “Cellular and transcriptomic analyses reveal two-staged chloroplast biogenesis underpinning photosynthesis build-up in the wheat leaf”, Genome Biology, 10.1186/s13059-021-02366-3
発表者
理化学研究所
環境資源科学研究センター バイオ生産情報研究チーム
チームリーダー 持田 恵一(もちだ けいいち)
(横浜市立大学大学院 客員教授)
大学院生リサーチ・アソシエイト(研究当時)
高萩 航太郎(たかはぎ こうたろう)
(横浜市立大学大学院 生命ナノシステム科学研究科(研究当時))
ロンドン大学ロイヤル・ホロウェイ校
准教授 エンリケ・ロペス(Enrique López-Juez)
報道担当
理化学研究所 広報室 報道担当
横浜市立大学 広報課長 上村 一太郎