2021-06-10 京都大学,東北大学,理化学研究所,日本医療研究開発機構
概要
京都大学大学院 医学研究科 萩原正敏教授、岩田想 同教授(兼・理化学研究所グループディレクター)、前田信太郎 同博士課程学生らの研究グループは井上飛鳥 東北大学薬学研究科准教授、南後恵理子 同大学多元物質科学研究所教授(兼・理化学研究所チームリーダー)、平田邦生 理化学研究所専任技師(放射光科学研究センター生命系放射光利用システム開発チーム)らと共同でスフィンゴシン-1-リン酸(S1P)という脂質を認識するS1P受容体S1PR3のS1Pと結合した状態での立体構造を、X線結晶構造解析によって解明しました。
S1Pはその受容体を介して、免疫細胞の体内での輸送、血管透過性、血管の発生などを制御する生理活性を有する脂質です。そのため、S1P受容体は自己免疫疾患などの炎症性疾患に対する治療薬の標的となっています。しかしながら、S1Pがどのように受容体を活性化して細胞に情報を伝達しているかは明らかとなっていませんでした。本研究によりS1Pは受容体中で脂質鎖をまっすぐ伸ばすことで受容体を活性化することがわかりました。また、脂質鎖の長さによって細胞内に伝える情報が偏る機構の一端も明らかにしました。これらの情報により、S1P受容体を標的とした新薬の設計が加速されると期待されます。
本研究成果は、2021年6月9日に米国の国際学術誌「Science Advances」にオンライン掲載されました。
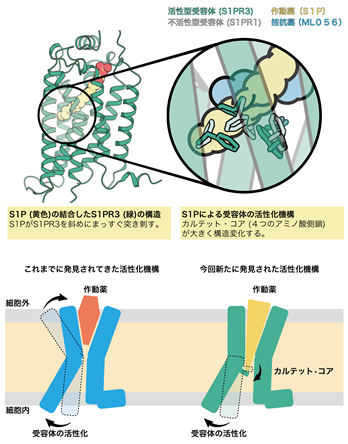
図 本研究の概要
背景
生体内で脂質はエネルギー源や細胞膜の構成成分としてだけでなく、受容体を介して生理活性作用を示す分子であることが知られています。このような分子を脂質メディエーターと呼んでいます。スフィンゴシン-1-リン酸(S1P)1)も脂質メディエーターとして知られている脂質の一つで、Gタンパク質共役受容体(GPCR)2)であるS1PR1-5を介して、血管・免疫系を中心に様々な生理作用を示します。近年では自己免疫疾患などの炎症性疾患に対してS1P受容体を標的とした化合物が治療薬として開発、上市されています。
我々のグループでは新規に同定した抗癌作用を示す化合物がS1P受容体に対する作動薬3)であり、さらにその伝達するシグナル4)が内在性の作動薬であるS1Pとは異なることを見出しました(Toyomoto, M. et al. Cell Chem. Biol. 2021)。しかしながら、S1P受容体が作動薬の種類に応じてどのように細胞内に伝えるシグナルを変化させているかは明らかとなっていません。また、これまでにS1P受容体では拮抗薬5)の結合した不活性型のS1PR1の構造しか解かれておらず、S1P受容体の活性化機構すら明らかとなっていませんでした(Hanson, M. A. et al. Science 2012)。そこで本研究では、S1Pの結合した状態でのS1PR3の立体構造の解明を試みました。
研究手法・成果
本研究ではS1Pが結合したS1PR3の構造を、X線結晶構造解析6)の手法を用いて決定しました。そのためにはS1PR3の結晶を取得する必要がありましたが、独自に取得したS1PR3特異的に結合する抗体の断片を一緒に結晶化することで、良質なデータを取得できる結晶を得ることに成功しました。データを得るためのX線回折実験は高輝度放射光施設のSPring-87)のビームラインBL32XUにて行いました。実に316個の結晶から自動的にデータを取得し、構造決定することができました。
解析の結果、先行研究で構造決定された不活性型のS1PR1に結合したS1Pを模倣した拮抗薬と比較すると、拮抗薬はL字に折れ曲がった形になっていましたが、S1Pは受容体に対して脂質鎖を斜めにまっすぐ突き刺していることがわかりました(図1)。この違いが受容体の活性化に強く関与していることが示唆されました。このことは斜めにまっすぐ突き刺さるために構造変化を起こしているアミノ酸残基(カルテット・コア)を変異させるとS1Pに応答した受容体の活性化が弱まることからも支持されました。これまで構造決定されたGPCRでは細胞外側のポケットが作動薬と結合し収縮することで活性化すると提唱されてきましたが、今回のS1Pの結合したS1PR3の構造から作動薬がポケットの奥深くにあるスイッチ(カルテット・コア)を押すことで活性化する機構が新たに明らかになりました(図2)。これまでにS1P以外にもプロスタグランジン8)やカンナビノイド9)などの脂質に対する受容体は活性型で構造決定されてきましたが、今回発見した受容体を斜めにまっすぐ突き刺すような作動薬の結合様式は見られていませんでした。これらのことから、斜めにまっすぐ突き刺すことで受容体を活性化する機構はS1PとS1P受容体が独自に獲得したものである可能性が示唆されます。
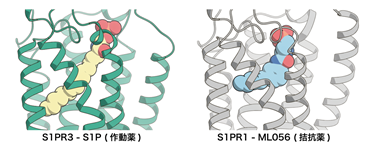
図1今回構造を明らかにした作動薬(S1P)の結合した活性型のS1PR3の構造(左)と先行研究で構造決定された拮抗薬(ML056)の結合した不活性型のS1PR1の構造(右)。拮抗薬に比べ、作動薬であるS1Pは斜めに伸びきった構造をしている。
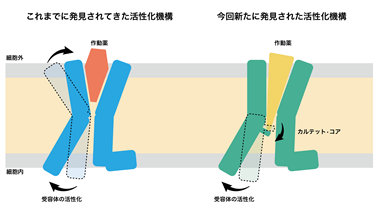
図2これまでに構造決定されたGPCRでは作動薬と結合することで細胞外側のポケットが収縮することによって受容体の活性化が誘導される(左)。今回構造決定されたS1PR3では作動薬と結合することで細胞外側の構造はほとんど変化せずに、受容体中心部に存在するカルテット・コアを構造変化させ、受容体の活性化が誘導される(右)。
またS1Pの結合様式から、脂質鎖を短くすると受容体の活性状態が変化すると予測されたため、生体内のS1Pの大部分を占めるd18:1S1P(炭素が18個並んでいるS1P)よりもさらに脂質鎖の短いS1Pの類縁体のd16:1 S1Pを使って受容体の活性を測定したところ、d18:1S1Pよりも一部のシグナルのみ弱まりました(図3)。さらに変異体解析により、脂質鎖を取り囲む疎水性アミノ酸残基群がこの現象に関わっていることがわかりました。これらのことから、脂質鎖と周辺のアミノ酸残基の相互作用の仕方を少し変えるだけで受容体の制御するシグナル伝達に偏りを引き起こせることがわかりました。S1P受容体をはじめ、GPCRは上市されている薬の約30%近くの標的分子であると知られています。近年では構造情報に基づく薬のデザイン(SBDD: Structure-based drug design)10)が熱心に行われており、本研究成果はSBDDの礎となることが期待されます。
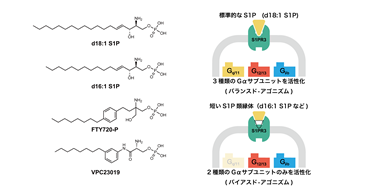
図3 今回シグナル解析を行った作動薬のリスト(左)とそれらの解析結果のまとめ(右)今回構造解析に用いたd18:1 S1Pに応答してS1PER3はGq/11,Gi/o,G12/13という3種類のGタンパク質群を活性化するのに対し、d18:1 S1Pよりも短い脂質鎖を持つd16:1 S1Pなどは2種類のGタンパク質群のみを活性化する。
波及効果、今後の予定
本研究では、免疫や血管系の機能を調節するS1P受容体の構造を解明しました。その結果、S1Pはまっすぐ受容体に突き刺さることで受容体を活性化することがわかりました。また、シグナル伝達に偏りを持たせることのできる作動薬に求められる性質なども明らかにすることができました。しかしながら、短い脂質鎖をもつ作動薬がどのようにシグナル伝達に偏りを引き起こしているのか詳細な機構は明らかとなっていません。今後は短い脂質鎖を持つ作動薬の結合した構造などを決定することでこの機構を明らかにしていく予定です。
研究プロジェクトについて
本研究は東北大学、理化学研究所などとの共同研究により行われました。また、日本学術振興会(JSPS)の特別研究員奨励費(19J22636)、科学研究費助成事業(18H02394,17K08264,19H05776,19H05777,15H05721)や、国立研究開発法人日本医療研究開発機構(AMED)の創薬等ライフサイエンス研究支援基盤事業(BINDS)(JP20am0101070,JP20am0101079,JP20am0101092)、革新的先端研究開発支援事業ソロタイプ(PRIME)(JP19gm5910013)、同インキュベートタイプ(LEAP)(JP20gm0010004)など、多くの支援を受けています。
用語解説
- 1)スフィンゴシン-1-リン酸(S1P)
- 生体膜の構成成分であるスフィンゴ脂質から代謝され、産生されるリゾリン脂質の1つで、リン酸基などの極性官能基と一本の脂質鎖で構成される。S1P受容体を介して、免疫細胞や血管内皮細胞の機能を制御している。
- 2)Gタンパク質共役受容体(GPCR)
- 細胞膜表面にある7回膜貫通型の膜タンパク質である。ヒトでは約800種類の遺伝子がGPCRをコードしており、受容体によって様々な基質に反応して、三量体Gタンパク質を活性化させる。
- 3)作動薬
- 受容体に結合する事で、受容体の構造変化を促し活性化するもの。
- 4)シグナル
- 生体内では細胞間や細胞外-細胞内、細胞内で情報を伝達するために、小分子やタンパク質を利用する。何かしらの刺激に応答して、小分子やタンパク質を増加、減少、生化学的に変化させて、情報が伝えられる。この情報をシグナルという。GPCRは細胞外から細胞内へのシグナル伝達を司っている。
- 5)拮抗薬
- 受容体に結合する事で、作動薬が受容体に結合することを拮抗阻害するもの。
- 6)X線結晶構造解析
- タンパク質や化合物などの結晶(分子が3次元で規則正しく並んでいる)に高輝度X線を照射し、得られた回折像から分子の立体構造を明らかにする方法。
- 7)SPring-8
- 兵庫県播磨科学公園都市にある世界最高性能の放射光を生み出すことができる大型放射光施設である。
- 8)プロスタグランジン
- 炎症反応などを制御する脂質メディエーター群で、五員環を特徴とする。アラキドン酸経路によって生合成される。
- 9)カンナビノイド
- 大麻などに含まれる生理活性を示す脂質群である。
- 10)SBDD(Structure-based drug design)
- X線結晶構造解析などで明らかにされたタンパク質などの立体構造情報をもとに、薬の改良を行うこと。コンピューター上での仮想の化合物群を用いた大規模スクリーニングや薬が結合しうるポケットの予測やそこにはまる化合物のデザインなどが行われている。
論文タイトルと著者
- タイトル
- Endogenous agonist-bound S1PR3 structure reveals determinants of G protein-subtype bias(内因性の作動薬と結合したS1PR3の構造から、Gタンパク質サブタイプの偏りの決定要因が明らかになる)
- 著者
- Shintaro Maeda, Yuki Shiimura, Hidetsugu Asada, Kunio Hirata, Fangjia Luo, Eriko Nango, Nobuo Tanaka, Masayasu Toyomoto, Asuka Inoue, Junken Aoki, So Iwata*, and Masatoshi Hagiwara*
- 掲載誌
- Science Advances
- DOI
- 10.1126/sciadv.abf5325
お問い合わせ先
萩原 正敏(はぎわら まさとし)
京都大学大学院医学研究科・教授
井上 飛鳥(いのうえ あすか)
東北大学大学院薬学研究科・准教授
南後 恵理子(なんご えりこ)
東北大学多元物質科学研究所・教授
報道・取材に関するお問い合わせ
京都大学 総務部広報課国際広報室
東北大学大学院薬学研究科総務係
理化学研究所 広報室 報道担当
AMED事業に関するお問い合わせ
日本医療研究開発機構(AMED)創薬事業部 医薬品研究開発課
創薬等ライフサイエンス研究支援基盤事業(BINDS)