カリフォルニア大学サンディエゴ校の研究者らは、RNAを直接標的とすることで、進行性の神経変性疾患の原因となる有害なタンパク質の蓄積を排除し、他のヒト遺伝子には大きな障害を与えないことに成功した By directly targeting RNA, UC San Diego researchers were able to eliminate toxic protein buildup that causes the progressive neurodegenerative condition while not significantly disrupting other human genes
2022-12-12 カリフォルニア大学サンディエゴ校(UCSD)
しかし、2022年12月12日にNature Neuroscienceに掲載された新しい研究で、カリフォルニア大学サンディエゴ校医学部の研究者は、他の同僚とともに、RNA標的CRISPR/Cas13d技術を使用して、HDを引き起こす有害なRNAを特異的に排除する新しい治療戦略を開発したことを説明しています。
CRISPRは、ゲノムの特定の位置に遺伝物質を追加、削除、変更することができるゲノム編集ツールとして知られています。CRISPRは、細菌が使用する自然発生的な免疫防御システムに基づいている。しかし、現在の方法では、意図しない部位を編集してしまい、永久的かつ遺伝性の染色体挿入やゲノムの変化を引き起こしてしまう危険性がある。このため、ゲノムを改変することなくRNAを直接標的とするCRISPRシステムの特定に大きな努力が払われている。
カリフォルニア大学アーバイン校およびジョンズ・ホプキンス大学の研究者らとともに、Yeo教授のチームは、最近報告されたRNA標的CRISPR技術を用いて、HDに伴うRNA(DNAの命令とタンパク質生成の間の化学的中間体)の蓄積に影響を与えられるかどうかを調査した。
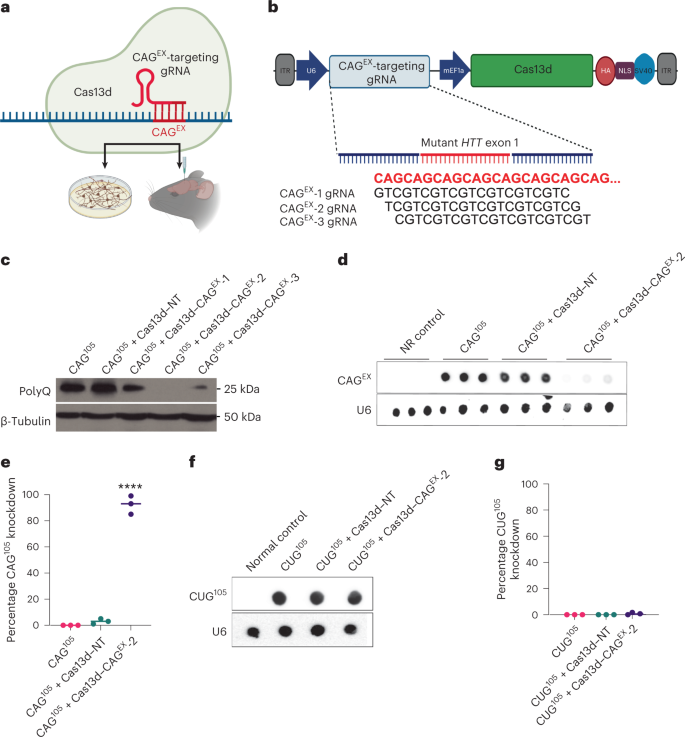
研究チームは、HD患者由来の幹細胞から開発した神経細胞培養液に、ウイルスを用いてこの治療法を投与し、変異したRNA分子を標的にして破壊するだけでなく、蓄積した有害なタンパク質も除去できることを明らかにした。また、他のヒト遺伝子の発現は、この治療法によって概ね阻害されないことも実証された。
Yeoの研究室は、ジョンズ・ホプキンス医学の精神医学と行動科学の教授であるWenzhen Duan, MD, PhDと共同で、マウスでの前臨床試験を実施しました。Duanと筆頭著者であるQian Wu博士は、HDのマウスモデルにおいて、この治療法が運動協調性を改善し、線条体の劣化を抑え、有害なタンパク質のレベルを低下させることを発見しました。この効果は少なくとも8カ月間持続し、副作用もなく、他のRNA分子への標的外影響も最小限でした。
<関連情報>
- https://today.ucsd.edu/story/crispr-technology-improves-huntingtons-disease-symptoms-in-models
- https://www.nature.com/articles/s41593-022-01207-1
RNA標的CRISPR-Cas13dシステムはハンチントン病モデルにおける疾患関連表現型を軽減させる An RNA-targeting CRISPR–Cas13d system alleviates disease-related phenotypes in Huntington’s disease models
Kathryn H. Morelli,Qian Wu,Maya L. Gosztyla,Hongshuai Liu,Minmin Yao,Chuangchuang Zhang,Jiaxu Chen,Ryan J. Marina,Kari Lee,Krysten L. Jones,Megan Y. Huang,Allison Li,Charlene Smith-Geater,Leslie M. Thompson,Wenzhen Duan & Gene W. Yeo
Nature Neuroscience Published:12 December 2022
DOI:https://doi.org/10.1038/s41593-022-01207-1
Abstract
Huntington’s disease (HD) is a fatal, dominantly inherited neurodegenerative disorder caused by CAG trinucleotide expansion in exon 1 of the huntingtin (HTT) gene. Since the reduction of pathogenic mutant HTT messenger RNA is therapeutic, we developed a mutant allele-sensitive CAGEX RNA-targeting CRISPR–Cas13d system (Cas13d–CAGEX) that eliminates toxic CAGEX RNA in fibroblasts derived from patients with HD and induced pluripotent stem cell-derived neurons. We show that intrastriatal delivery of Cas13d–CAGEX via an adeno-associated viral vector selectively reduces mutant HTT mRNA and protein levels in the striatum of heterozygous zQ175 mice, a model of HD. This also led to improved motor coordination, attenuated striatal atrophy and reduction of mutant HTT protein aggregates. These phenotypic improvements lasted for at least eight months without adverse effects and with minimal off-target transcriptomic effects. Taken together, we demonstrate proof of principle of an RNA-targeting CRISPR–Cas13d system as a therapeutic approach for HD, a strategy with implications for the treatment of other dominantly inherited disorders.