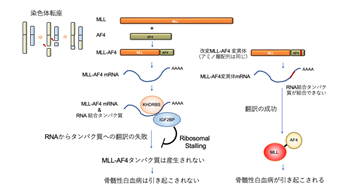
2022-12-13 京都大学iPS細胞研究所
ポイント
- iPS細胞に導入されたCAR遺伝子のシグナル伝達部の違いが、T細胞への分化効率に影響を与えることを見出した。
- iCAR-T細胞は通常のCAR-T細胞に比較して、CARを介した活性化シグナルが弱いことが明らかになったが、DGK遺伝子ノックアウトによってシグナル活性は増強し、モデルマウス固形がん内でのiCAR-T細胞増殖と生存が向上した。
- さらに膜結合型IL-15/IL-15Rα遺伝子を導入し、サイトカイン刺激による活性化シグナルを補完することによって、iCAR-T細胞のモデルマウス固形がん内での増殖と生存は更に向上した。
- モデルマウスにおいて固形がんの増大を抑え、治療群の生存期間を延長させることのできるiCAR-T細胞の開発に成功した。
iCAR-T細胞:iPS細胞に由来する細胞傷害性CAR-T細胞
1. 要旨
上田樹 研究員(当時:CiRA増殖分化機構研究部門、現:シカゴ大学ポスドク研究員)と金子新教授(CiRA増殖分化機構研究部門)らの研究グループは、マウスの固形がんモデルにおいても抗腫瘍効果を発揮するCAR-T細胞をiPS細胞から作製する方法を開発しました。
キメラ抗原受容体(CAR)注1)を発現したT(CAR-T)細胞を用いた、固形がん注2)に対する免疫細胞療法において、静脈から投与されたCAR-T細胞が腫瘍局所に集積し、増殖すること、そしてその場にとどまり働く持続性が重要となります。研究グループは、iPS細胞からT細胞への分化誘導にCAR遺伝子の構成が影響することを見出し、分化誘導効率を落とさないCARを選出しました。さらに、T細胞の活性化に関わる2種類のシグナル関連の遺伝子操作を適用した結果、マウスの腫瘍モデルにおいて、CAR遺伝子を導入したiPS細胞に由来する細胞障害性T細胞(iCAR-T細胞)が、腫瘍のある部位で効率的に増殖し、従来に比べ長期に生存することを示しました。さらには同モデルマウスにおいて、改変前の20分の1の投与量であっても固形がんの増大を抑え、治療群の生存期間を延長させることが明らかになりました。これまで困難とされてきた固形がんに対する、多能性幹細胞から誘導したエフェクター機能注3)を持つCAR-T細胞の実用化に、今回の最適化が貢献することが期待されます。
この研究成果は、日本時間2022年12月13日(火)午前1時(英国時間12月12日(月)午後4時)に「Nature Biomedical Engineering」で公開されました。
2. 研究の背景
T細胞やNK細胞などの細胞傷害性免疫細胞は、がん免疫療法において、CARなどの遺伝子を搭載した自家移植用細胞の供給源となることが知られています。2013年に初めてiPS細胞から抗原特異的T細胞を分化させる手法が報告されて以来、iPS細胞技術を用いたがん免疫療法の応用に向けた研究が進められています。近年では分化誘導法の改良が進み、血液がんの動物モデルにおいては、健常人の初代培養T細胞に匹敵する治療効果を持ったiPS細胞由来CAR-T細胞(iCAR-T細胞)が報告されているほか、iPS細胞の免疫原性を遺伝子操作で減弱させて”ユニバーサル”化したiCAR-T細胞の有用性も報告されるなど、同種(他家)移植細胞治療へのiCAR-T細胞の貢献も期待されています。
一方で、通常のCAR-T細胞治療においても、固形がんは血液がんに比して治療の難易度が高いがんであることが知られています。腫瘍組織への免疫細胞の到達やその場での増殖、エフェクター機能の発揮とその持続といった要件を満たす必要があり、治療効果を期待するには、依然として改善が必要な状況です。今回、研究グループはCARシグナルを補完するT細胞活性化シグナルに着目し、遺伝子改変を行うことによって、腫瘍局所におけるiCAR-T細胞の挙動の改善と、固形がんに対するiCAR-T細胞の治療効果の向上に取り組みました。
3. 研究結果
1) iPS細胞からT細胞への分化誘導に適したCAR遺伝子構成の解明
一部のCAR遺伝子の構成は予期しない持続的なCARシグナル伝達を生じさせるために、CAR-T細胞の機能低下を引き起こすことが分かっています。研究グループはまずCAR遺伝子の構成がiPS細胞からT細胞への分化に及ぼす影響を調べました。T細胞受容体シグナル(「第一のシグナル」)伝達時に共刺激(「第二のシグナル」)分子として機能する4-1BBおよびCD28に関して、構成の異なる4種類のCAR遺伝子(19z、1928z、19bbz、1928bbz)をiPS細胞にそれぞれ導入しました。その後、T細胞への分化誘導を行ったところ、4-1BBを含むCAR(19bbz)と、CD28と4-1BBを両方含むCAR(1928bbz)では、iPS細胞へのCAR遺伝子の導入による分化誘導への有意な影響がないことが分かりました。
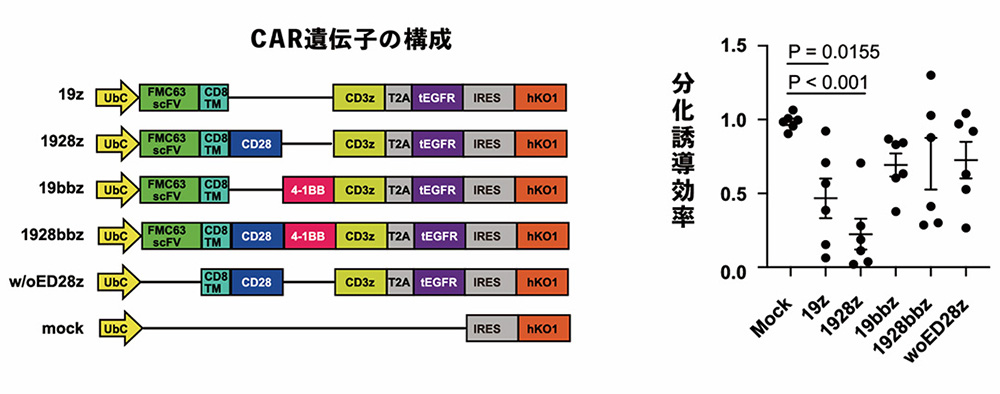
図1 CAR遺伝子の構成がCD4CD8陽性細胞への分化誘導効率に与える影響
2) ジアシルグリセロールリン酸化酵素(DGK)の阻害によるiCAR-T細胞の機能改善
iCAR-T細胞(iCAR-TCTL)の機能を詳細に解析したところ、通常のCAR-T細胞に比較して、CARの下流のシグナル伝達経路にある分子のリン酸化が不足し、活性が弱くなっていることが明らかになりました。そこで、iCAR-T細胞のエフェクター機能を向上させるために、T細胞受容体シグナル(「第一のシグナル」)を増強させる方法を検討しました。
まず、研究グループは、T細胞受容体シグナルを阻害するタンパク質として知られているジアシルグリセロールリン酸化酵素のDGKαとDGKζに着目しました。これまでにマウスの実験で DGKαとDGKζを阻害すると、T細胞のエフェクター機能が向上することが報告されています。本研究では DGKαとDGKζを欠損させたiCAR-T細胞(DGK-dKO-iCAR-TCTL)を作製し、T細胞受容体シグナルを増強させた効果について、固形がんマウスモデルによる評価を行いました。
DGKを欠損させたiCAR-T細胞(DGK-dKO-iCAR-TCTL)を固形がんモデルマウスに投与したところ、DGKを欠損させていないiPS細胞由来CAR-T細胞(iCAR-TCTL)と比べ、より多くの細胞障害性T細胞が腫瘍局所に検出され、長期にわたって存在しました。この結果は、遺伝子改変によりiCAR-T細胞の腫瘍局所での増殖と生存が改善されたことを示しています。
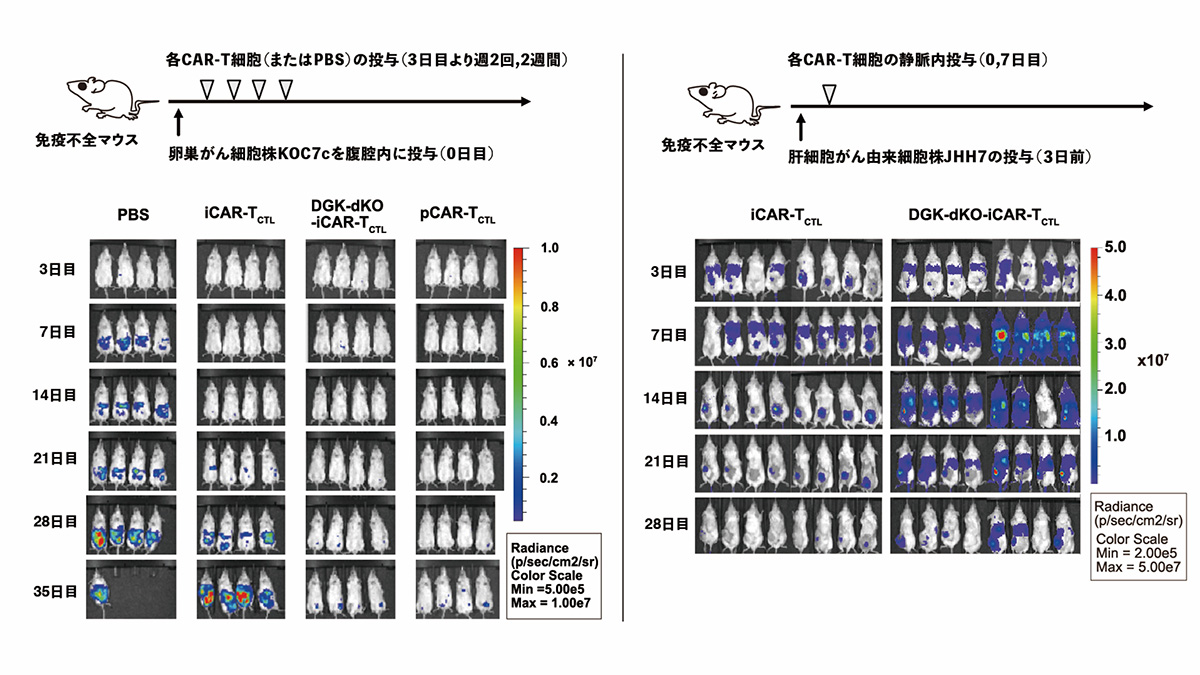
図2 DGKの欠損によるiCAR-T細胞の腫瘍への集積、増殖、持続性の向上
3) 膜結合型IL-15の遺伝子導入によるiCAR-T細胞の機能改善
T細胞の活性化には、T細胞受容体シグナル、共刺激シグナルに加えて、サイトカイン刺激によるシグナル(「第3のシグナル」)も重要です。これまでに、研究グループは膜結合型IL-15/IL-15Rα(mbIL15)遺伝子の導入によって、iCAR-T細胞の体内残存が改善し、血液がん治療効果が改善されることを報告しています。そこで、 本研究でもDGK-KOに加えて、mbIL15をiCAR-T細胞に導入し、効果を評価しました。mbIL15を導入したiCAR-T細胞(iCAR-TCTL-mbIL15tg)は、mbIL15を導入していない細胞(iCAR-TCTL)と比べて腫瘍における増殖性および持続性の向上が確認されました。
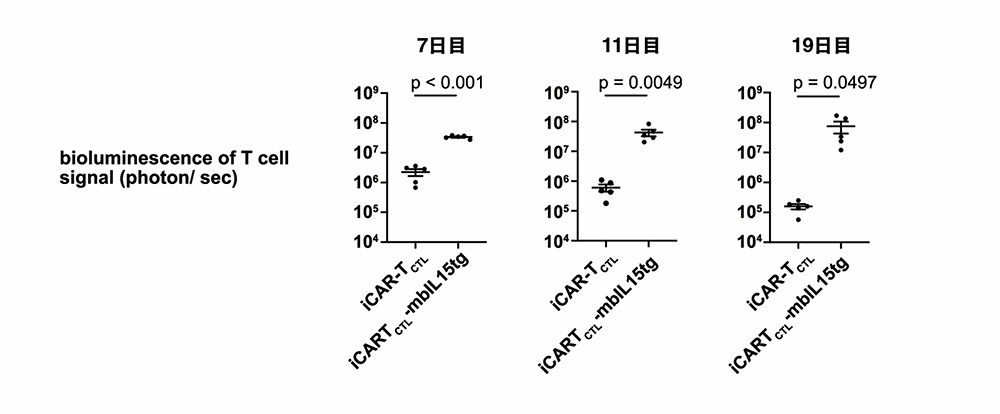
図3 膜結合型 IL15の遺伝子導入によるiCAR-T細胞の腫瘍内検出
4) ジアシルグリセロールリン酸化酵素(GDK)の阻害と膜結合型IL-15の遺伝子導入を組み合わせiCAR-T細胞の抗固形がん効果
次に、卵巣がんモデルマウスを用いて、DGKの欠損と膜結合型IL15遺伝子の導入を組み合わせたことによる効果を調べました。その結果、いずれか一方の操作を施したiCAR-T細胞と比較して、両方の操作を行なったiCAR-T細胞が長期に腫瘍で効果を発揮し、腫瘍モデルマウスの生存を改善しました。
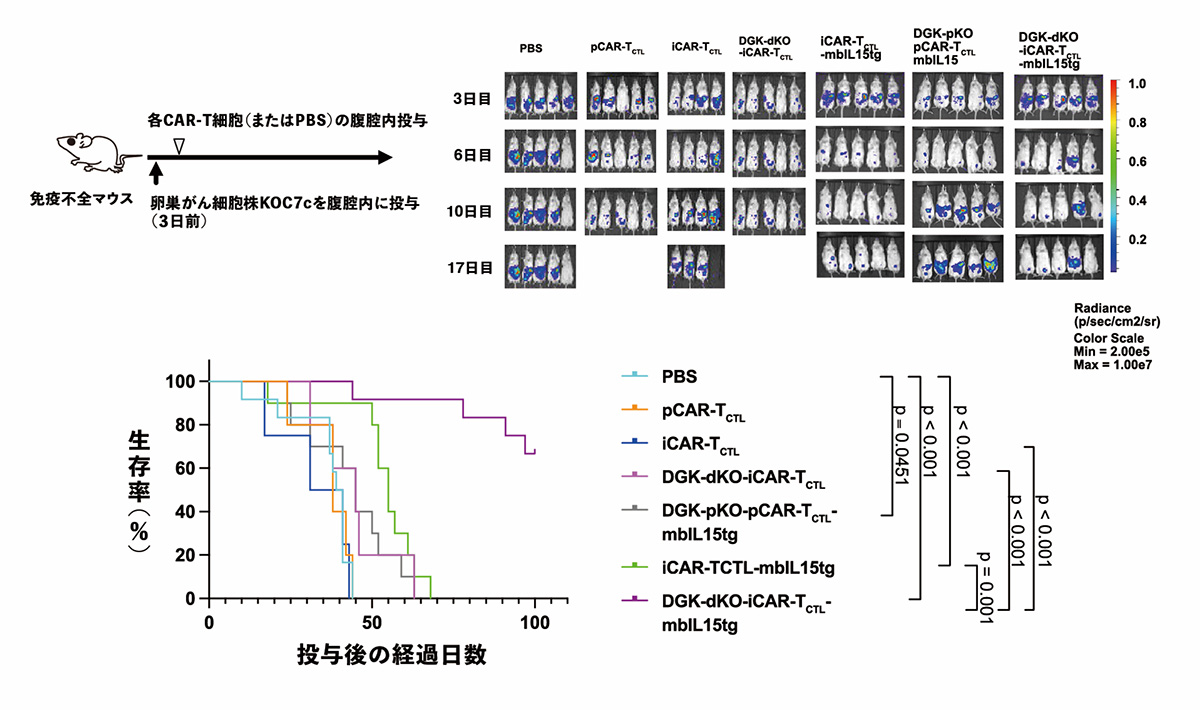
図4 2種の遺伝子操作の組み合わせによる抗腫瘍効果の検証
最後に、がん免疫療法が困難な固形がんのモデルへの効果の検証として、皮下にがん細胞を播種した肝細胞がんモデルマウスに、DGK欠損と膜結合型IL-15の遺伝子導入をおこなったiCAR-T細胞を静脈注射で投与しました。その結果、腫瘍形成を有意に抑え、固形がんモデルマウスの生存率を改善させることができました。
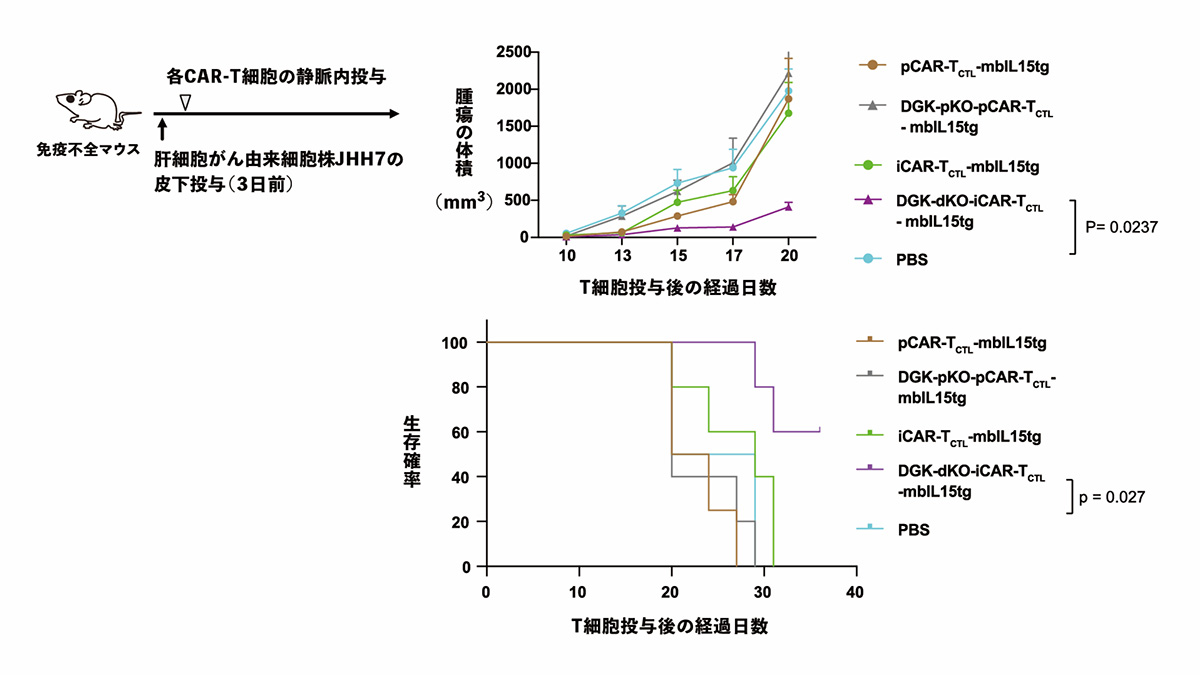
図5 がん免疫療法が難しい固形がんモデル
4. まとめ
本研究により、CAR遺伝子の適切な構成の選択と分化誘導法の最適化、さらに細胞の活性化を促す遺伝子操作を組み合わせることで、高機能なiPS細胞由来CAR-T細胞を作製することが可能であることを示しました。本研究での結果は、iPS細胞由来CAR-T細胞が固形がんにも治療効果を持つ可能性があることを示しています。
5. 論文名と著者
- 論文名
Optimization of the proliferation and persistency of CAR T cells derived from human induced pluripotent stem cells - ジャーナル名
Nature Biomedical Engineering - 著者
Tatsuki Ueda1,2, Sara Shiina1,3, Shoichi Iriguchi1,3, Seitaro Terakura4, Yohei Kawai1, Ryotaro Kabai5, Satoko Sakamoto5, Akira Watanabe5, Kohei Ohara1, Bo Wang1,3, Huaigeng Xu1, Atsutaka Minagawa1, Akitsu Hotta1, Knut Woltjen1, Yasushi Uemura6, Yuzo Kodama7, Hiroshi Seno2, Tetsuya Nakatsura6, Koji Tamada8, Shin Kaneko1,3,*
* : 責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学大学院 医学研究科 消化器内科
- タケダ-CiRA 共同研究プログラム(T-CiRA)
- 名古屋大学大学院 医学系研究科
- 京都大学大学院 医学研究科 メディカルイノベーションセンター
- 国立がん研究センター 先端医療開発センター 免疫療法開発分野
- 神戸大学大学院 医学研究科
- 山口大学大学院 医学系研究科
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本医療研究開発機構(AMED)(JP15cm0106115、JP18ck0106204、 JP22bm0104001)
- 国立がん研究センター研究助成(28-A-8)
7. 用語説明
注1)キメラ抗原受容体(CAR)
抗体のターゲット認識部位を細胞外に、T細胞活性化タンパク質を細胞内に内包した人工タンパク質の総称。CD19タンパク質をターゲットとしたCARを発現したT細胞において完全寛解を達成した患者さんもいることから、免疫細胞療法において注目されている。
注2)固形がん
血液がんと異なり、臓器や組織において、がん細胞がかたまりで増える種類のがん。上皮細胞から発生する癌腫と非上皮細胞から発生する肉腫を含む。CAR-T細胞を用いたがん免疫療法において、血液がんよりも治療が困難とされている。
注3) エフェクター機能
ここではエフェクターT細胞が持つ、病原体や異常細胞を排除する免疫機能のこと。成熟したT細胞は、最初はナイーブT細胞と呼ばれる状態にある。他の免疫細胞(樹状細胞)から刺激をうけると、ナイーブT細胞が分裂、分化し、実際に病原体に対して攻撃をするエフェクターT細胞になる。