2023-03-03 理化学研究所
理化学研究所(理研)計算科学研究センター 粒子系生物物理研究チームの杉田 有治 チームリーダー(開拓研究本部 杉田理論分子科学研究室 主任研究員、生命機能科学研究センター 分子機能シミュレーション研究チーム チームリーダー)、タン・チェン 特別研究員、開拓研究本部 杉田理論分子科学研究室の新津 藍 研究員の研究チームは、「Heroタンパク質[1]」が他のタンパク質の局所的な濃縮(凝縮)を制御する分子機構を、シミュレーションを用いて解明しました。
本研究成果は、細胞内に生じるタンパク質の凝縮や液-液相分離[2]における分子間相互作用に関する理解を深めるものであり、筋萎縮性側索硬化症(ALS)をはじめとする神経変性疾患につながるタンパク質の凝縮を制御する仕組みの解明に貢献すると期待できます。
今回、研究チームはスーパーコンピュータ「富岳」[3]と理研Hokusai-BigWaterfall[4]を用いて、Heroタンパク質の一種(Hero11)と、ALSの発症に関連するTDP-43[5]というタンパク質の相互作用に関する分子動力学シミュレーション[6]を行いました。その結果、Hero11に多く含まれるプラス電荷を持つアミノ酸やHero11の立体構造(α-ヘリックス構造[7]の有無)が、TDP-43の凝縮の抑制において重要な役割を果たすことが示されました。Heroタンパク質が他のタンパク質の凝縮を制御する機能があることは既に実験的に示されていましたが、本研究によって、その機能の分子機構が理論的に明らかになりました。
本研究は、科学雑誌『Journal of the American Chemical Society(JACS)Au』オンライン版(2月24日付)に掲載されました。
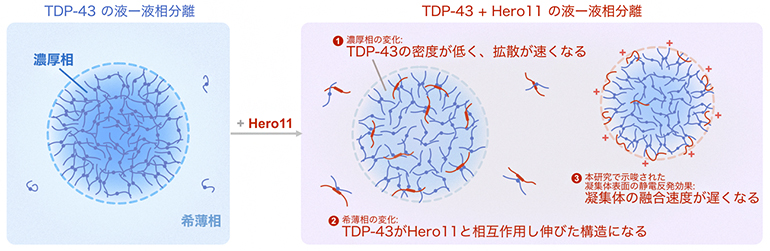
TDP-43の液-液相分離をHero11が制御する分子メカニズム
背景
「液-液相分離」は、希薄相と濃厚相の二つに液体状態を分離する一般的な物理現象です。近年、細胞内でのタンパク質やRNAなどの生体分子による液-液相分離が、さまざまな生命現象において重要な役割を果たすことが明らかになってきました。また、アルツハイマー病やパーキンソン病、筋萎縮性側索硬化症(ALS)などの神経変性疾患の発症要因の一つは特定のタンパク質の凝縮だと考えられていますが、このようなタンパク質の凝縮は液-液相分離の濃厚相で生じやすいことが明らかになっています。
多くの細胞は、タンパク質の凝縮や液-液相分離を抑制・制御するための機能を持っています。東京大学定量生命科学研究所の泊 幸秀 教授らは、2020年に「Heroタンパク質」というタンパク質群を発見し、これらに他のタンパク質の相分離を抑制する効果があることを示しました注1)。しかし、Heroタンパク質が凝縮を制御するメカニズムの詳細は明らかになっていませんでした。
一方、分子動力学シミュレーションによる生体分子の凝縮や液-液相分離の研究は数多く行われています。例えば、生体分子による液-液相分離が生じる仕組みを説明する「Stickers-and-spacers」モデルでは、他のタンパク質と相互作用する「Stickers」とあまり相互作用をしない「Spacers」の両方の部分を持つ生体分子が液-液相分離を引き起こすことが示唆されました。複数のStickersによる弱い相互作用が動的に生じることで(多価相互作用)、分子の流動性を保ったまま濃厚相を生じるとされています。
そこで今回、研究チームは分子動力学シミュレーションによって、Heroタンパク質の一つであるHero11が神経変性疾患ALSに関連するTDP-43というタンパク質の凝縮注2)を抑制するメカニズムの解明を試みました。
注1)2020年3月13日東京大学プレスリリース「Heroタンパク質の発見とその驚くべき機能![]() 」
」
注2)2012年12月18日プレスリリース「TDP-43タンパク質の安定化が神経難病ALSの発症時期のカギ」
研究手法と成果
分子動力学シミュレーションを行うには、タンパク質の立体構造を初期構造として入力する必要がありますが、Hero11の立体構造については、実験的に得られた情報がほとんどありませんでした。限られた情報から立体構造を予測するために、研究チームは、AlphaFold2という情報科学的に立体構造を予測するサーバーから構造を得た上で、それを初期モデルとして全原子モデル[8]を用いた分子動力学シミュレーションを行いました。その結果、Hero11は固有の安定な立体構造を持たないものの、完全なランダムコイル状態[7]でもないことが分かりました。
そこで、AlphaFold2の予測から得られたα-ヘリックス構造を含む構造モデルとα-ヘリックス構造を持たない構造モデルを基に、一つのアミノ酸残基を1粒子で近似した粗視化分子モデル[8]を構築しました。TDP-43の立体構造については先行研究が存在するため、一部分をα-ヘリックス構造と仮定して粗視化分子モデルを作成しました。Hero11とTDP-43をそれぞれ100分子含む粗視化分子モデルについて、異なる温度での多数回のシミュレーションを行い、Hero11とTDP-43それぞれの単独系および混合系での凝縮のメカニズムを詳しく解析しました。多数の分子を含むモデルのシミュレーションにおいては、計算能力の高いスーパーコンピュータ「富岳」と理研Hokusai-BigWaterfallを活用しました。また、全原子モデルだけでなく粗視化分子モデルも導入されている分子動力学ソフトウェアGENESIS[9]を用いました。
まず、TDP-43だけを100分子含む系をシミュレーションしたところ、室温に近い温度(295K、約22℃)で凝縮しました(図1上)。この結果は、実験によって明らかになっていた結果とよく一致しました。一方、Hero11だけを100分子含む系は同じ温度では凝縮しませんでした。興味深いことに、Hero11に含まれるプラス電荷を持つアミノ酸(リジン、アルギニン)を全て、電荷を持たず最も単純な構造のグリシンに置換した変異体(KR-less変異体)は、295Kで凝縮しました。これらの結果は、これまでに明らかになったTDP-43やHero11の実験結果を再現するだけでなく、Hero11に含まれる電荷を持つアミノ酸の役割を強く示唆しています。
次に、TDP-43とHero11をそれぞれ100分子ずつ含む混合系のシミュレーションを行いました。その結果、Hero11を加えることでTDP-43の凝縮が抑制されることと(図1中)、KR-less変異体にはTDP-43の凝縮を抑制する効果がないこと(図1下)が分かりました。

図1 TDP-43とHero11の粗視化分子モデルによるシミュレーションの結果
295K(約22℃)におけるTDP-43の凝縮(上)、TDP-43とHero11の混合系における凝縮の抑制(中)、TDP-43と電荷を持つアミノ酸を全てグリシンに置換したKR-less変異体の混合系における凝縮形成(下)。TDP-43を緑と青で、Hero11を赤で示した。
TDP-43の凝縮の抑制・制御に関するHero11の機能をより詳しく理解するために、シミュレーション上の液-液相分離で生じた濃厚相と希薄相に含まれるTDP-43とHero11を調べました。その結果、TDP-43単独系と比べると、TDP-43とHero11の混合系では濃厚相における粒子濃度が低下し、その結果としてTDP-43の拡散運動が加速していました。これらは、Hero11に含まれるプラス電荷を帯びたアミノ酸によるHero11同士の静電的相互作用による斥力の影響によって生じたと考えられます。一方、希薄相においては、Hero11とTDP-43の間に引力が働いており、希薄相にTDP-43が安定に存在できるようになりました(図2)。
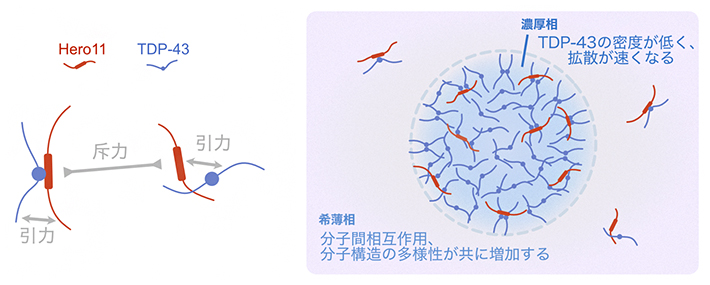
図2 Hero11とTDP-43の間の分子間相互作用と液-液相分離の模式図
Hero11間の静電的な斥力が濃厚相における粒子密度を低下させている一方で、Hero11とTDP-43の間に働く引力が希薄相におけるTDP-43とHero11の相互作用を安定化させる。
さらに、Hero11に含まれる部分的な二次構造(α-ヘリックス構造の有無)が凝縮の抑制にどのように関係しているのか調べました。その結果、α-ヘリックスを持たないと仮定した場合に、Hero11がTDP-43の凝縮体の表面により多く存在していました(図3)。おそらく、TDP-43による小さな凝縮体の表面にHero11が存在することで、凝縮体同士に静電的な斥力が生じて、さらに大きな凝縮体へと成長することを防いでいると考えられます。実験から得られたHero11の凝縮抑制効果を示すデータと照らし合わせると、Hero11はα-ヘリックス構造を持たない可能性が考えられますが、さらなる実験と計算による解析が必要です。
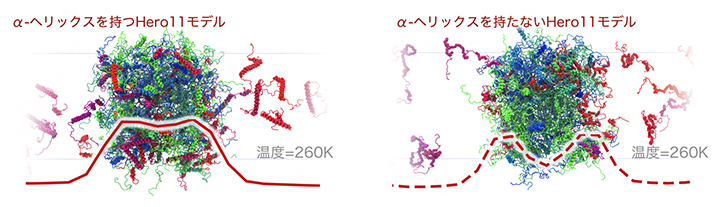
図3 α-ヘリックスの有無によるTDP-43による凝縮体(液滴)におけるHero11の配置の違い
左がα-ヘリックスを持つHero11の場合、右がα-ヘリックスを持たないHero11の場合の260K(約13℃)におけるHero11とTDP-43の配置の模式図。赤の実線と破線は凝縮体上のHero11の数を示す。赤線の形状が示すように、Hero11がα-ヘリックスを持たない場合に、Hero11がTDP-43による凝縮体の表面でより多く観測される。
今後の期待
本研究では、Heroタンパク質による他のタンパク質の凝縮抑制には、Heroタンパク質同士の静電的な斥力が巧みに使われていることを示しました。Heroタンパク質だけでなく、他のタンパク質やRNAもタンパク質の凝縮を抑制・制御していることが知られています。これらの多くもプラスまたはマイナスの電荷に偏っているため、この研究で示された静電的な斥力効果は一般的な分子機構である可能性が高いです。
今回のシミュレーションでは、Hero11とTDP-43のみの混合系を対象としましたが、細胞内環境には他のイオンや代謝物なども数多く含まれており、シミュレーションで得られた分子機構が細胞内でも実際に働いているかは不明です。今後は、スーパーコンピュータ「富岳」での全原子モデルに基づく分子動力学シミュレーションによって、新しい発見が得られると考えています。
また、計算科学で得られた知見を実験にフィードバックし、さらに新たな実験結果を計算科学で解析することで、細胞内でのタンパク質凝縮の詳しい分子機構が明らかになり、アルツハイマー病やパーキンソン病、ALSなどタンパク質凝縮が重要な役割を果たしている神経変性疾患の原因解明と治療に役立つと期待できます。
補足説明
1.Heroタンパク質
他のタンパク質の凝縮を防ぐ機能を持つタンパク質群。熱に強く、95℃で煮沸しても水溶性を保つ。HeroはHeat-resistant obscureの略。
2.液-液相分離
分子が均一に混ざり合った混合系が温度や分子間相互作用などの変化により、濃厚相と希薄相の2相に分離する現象。細胞質や核などの細胞内環境において、タンパク質やRNAの液-液相分離が生じており、重要な生命現象のプラットフォームとして働くことがわかってきた。そのため、膜に覆われたオルガネラとの比較で、相分離で生じた濃厚相は「膜のないオルガネラ」と呼ばれる。
3.スーパーコンピュータ「富岳」
スーパーコンピュータ「京」の後継機。社会的・科学的課題の解決で日本の成長に貢献し、世界をリードする成果を生み出すことを目的とし、電力性能、計算性能、ユーザーの利便性・使い勝手の良さ、画期的な成果創出、ビッグデータやAI(人工知能)の加速機能の総合力において世界最高レベルのスーパーコンピュータ。15万8976個の中央演算装置(CPU)を搭載し、1秒間に約44京2010兆回の計算が可能。2020年6月から2021年11月にかけて、世界のスパコンランキング「TOP500」「HPCG」「HPL-AI」「Graph500」で4期連続の世界1位を獲得した。
4.理研Hokusai-BigWaterfall
超並列演算システム、大容量メモリ演算サーバーと、フロントエンドサーバー、2種類のストレージから構成される。理研での科学技術研究などの推進と発展に資する研究のために使われている。
5.TDP-43
DNAに結合して転写を抑制するタンパク質。凝縮するとALSの発症の一因になると考えられている。TDPはTAR DNA-binding proteinの略。
6.分子動力学シミュレーション
原子間に働く力を計算し、運動方程式を繰り返し解くことで、分子の動きを追跡する方法。
7.α-ヘリックス構造、ランダムコイル状態
タンパク質の立体構造を構成する要素のうち、鎖状につながったアミノ酸がらせん状の形をとる二次構造をα-ヘリックス構造という。ランダムコイル状態は、鎖状のアミノ酸が完全に伸びた状態ではなく、分子内相互作用はある程度存在するものの、特定の二次構造は持たず揺らぎの大きい状態。
8.全原子モデル、粗視化分子モデル
分子を構成する全ての原子(全原子モデル)の動きを追う分子動力学シミュレーションでは、扱える系が時間的・空間的に限られている。より長時間で大規模な分子系の分子動力学シミュレーションを低コストで実行するために、一つのアミノ酸残基を1粒子で近似した粗視化分子モデルが用いられている。
9.分子動力学ソフトウェアGENESIS
粒子系生物物理研究チームを中心に開発しているソフトウェア。細胞内環境を含む大きな生体分子系のシミュレーションやレプリカ交換分子動力学法などの構造探索手法を利用することができる(GENESIS![]() )。
)。
研究支援
本研究は、理化学研究所計算科学研究センターと開拓研究本部で実施し、日本学術振興会(JSPS)科学研究費助成事業基盤研究(S)「マルチスケール分子動力学シミュレーションによる細胞内分子動態の解明」、学術変革領域研究(A)「非ドメイン型バイオポリマーの分子動力学」、文部科学省「富岳」一般課題「Phase behavior of biomolecules studied with molecular dynamics simulations」(課題番号:hp200028)、「富岳」成果創出加速プログラム「全原子・粗視化分子動力学による細胞内分子動態の解明」(課題番号:hp200135、hp210177、hp220170)らによる助成を受けて行われました。
原論文情報
Cheng Tan, Ai Niitsu, Yuji Sugita, “Highly Charged Proteins and Their Repulsive Interactions Antagonize Biomolecular Condensation”, Journal of the American Chemical Society(JACS)Au, 10.1021/jacsau.2c00646
発表者
理化学研究所
計算科学研究センター 粒子系生物物理研究チーム
チームリーダー 杉田 有治(スギタ・ユウジ)
(開拓研究本部 杉田理論分子科学研究室 主任研究員、生命機能科学研究センター 分子機能シミュレーション研究チーム チームリーダー)
特別研究員 TAN Cheng(タン・チェン)
開拓研究本部 杉田理論分子科学研究室
研究員 新津 藍(ニイツ・アイ)
(科学技術振興機構(JST)さきがけ専任研究員)
報道担当
理化学研究所 広報室 報道担当


