負の制御が細胞間でばらつくことで細胞間の不均一性が生み出される
2018-09-05 自然科学研究機構 基礎生物学研究所,京都大学,自然科学研究機構 生命創成探究センター
多細胞生物を構成する細胞は、ストレス(炎症性サイトカインや浸透圧、紫外線などによるDNA損傷など)により回復不能なまでにダメージを受けた場合には、積極的にアポトーシスと呼ばれる細胞死を誘導し、自殺することが知られています。アポトーシスのスイッチがオンになると不可逆的に細胞の運命が決まってしまいます。このアポトーシスを活性化させる際に重要となるのがストレス応答MAPキナーゼ(SAPK)であるp38とJNKと呼ばれるリン酸化酵素です。このp38とJNKがどのようにして、アポトーシスのスイッチを入れるのか、また細胞の運命(生存細胞と自殺細胞)をどのようにして制御しているのか、についてはよくわかっていませんでした。
今回、基礎生物学研究所 定量生物学研究部門 / 生命創成探究センター 定量生物学研究グループの三浦晴子研究員、近藤洋平助教、青木一洋教授らは、京都大学の松田道行教授との共同研究により、p38とJNKの活性を生きた細胞内で同時に観察できる蛍光レポーターを開発しました。このシステムを用いてさまざまなストレス条件下におけるp38とJNKの活性を1細胞レベルで観察したところ、JNKはp38によって負に制御されること、さらにこの負の制御が細胞間でばらつくためにJNK活性が細胞間でばらつくことを見出しました。また紫外線ストレスによる細胞死の際、JNK活性がある閾値を超えた細胞ではアポトーシスが起きること、細胞間のJNK活性のばらつき度合いにより細胞死が起きる割合を決定されることを発見しました。本成果は、米国の学術誌「Cell Reports」誌に掲載予定で、2018年9月4日付けでオンライン先行公開されました。
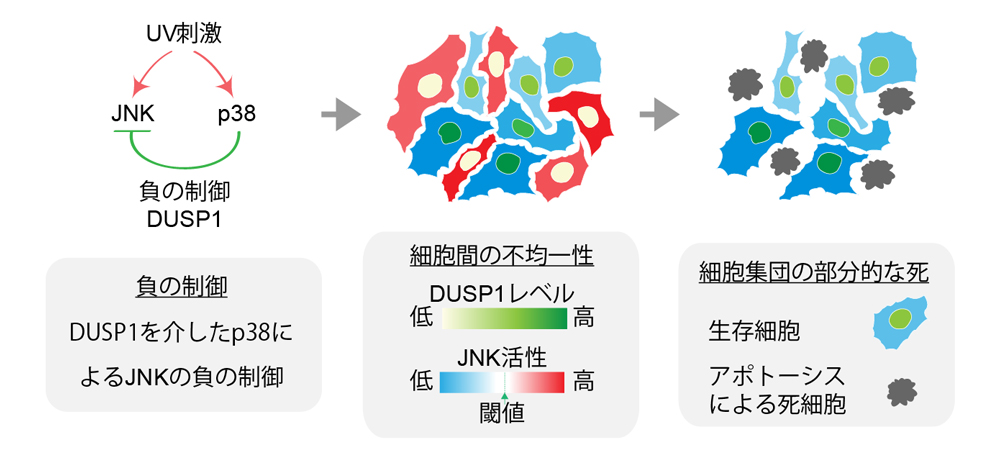
本研究成果の概要図
【研究の背景】
多細胞生物を構成する細胞は、積極的に自殺する「アポトーシス」と呼ばれる機構を有していることが知られています。アポトーシスは、オタマジャクシがカエルになりしっぽが無くなる時や胎児の指と指の間が無くなって指が形づくられるときなど生理的な場面でも観察されますが、ストレス(炎症性サイトカインや浸透圧、紫外線などによるDNA損傷など)により回復不能なまでにダメージを受けた場合にも観察されます。多細胞生物においては、ある割合の細胞がアポトーシスすることで、組織全体や個体としてのストレスに対して適応すると考えられます。また悪性腫瘍の治療で使われる放射線治療や多くの抗がん剤はDNAを傷つけて腫瘍細胞をアポトーシスに導くことが知られていますが、すべての腫瘍細胞を殺すことは難しく、これが治療抵抗性の一因となっていました。
アポトーシスは、一度そのスイッチがオンになると不可逆的に細胞の運命が決まり、必ず細胞は死んでしまいます。このアポトーシスを活性化させる際に重要となるのがストレス応答MAPキナーゼ(SAPK)であるp38とJNKと呼ばれるリン酸化酵素です。p38とJNKはストレスに応答して活性化し、転写因子やアポトーシスの実行因子などをリン酸化することでアポトーシスを誘導します。p38やJNKの活性はこれまでは生化学的な方法で調べられてきました。この方法では大多数の細胞をすりつぶして得られた細胞集団の平均値としてのp38、JNKの活性が測定できますが、一方で、細胞ごとの個性や不均一性といった情報は消えてしまいます。このような現状から、可逆的で連続的(アナログ的)に活性が変動するp38とJNKがどのようにして不可逆的でスイッチ的(デジタル的)な現象であるアポトーシスを引き起こすのか、また生存細胞と自殺細胞の割合をどのようにして制御しているのか、についてはよくわかっていませんでした。
【研究の成果】
研究グループは、生きた細胞でp38およびJNKの活性とアポトーシスを同時に観察できる実験系を構築しました。まず、感度のよいp38活性の蛍光レポーター(mKO-MK2、p38の活性化レベルをオレンジ色の蛍光として検出)を独自に開発し、既存のJNKレポーター(JNK KTR-mChery、JNKの活性化レベルを赤色蛍光として検出)と組み合わせたシステムを構築しました(図1A、B)。これにより1細胞レベルでp38とJNKの活性を同時に可視化することに成功しました(図1C)。
(動画1 :http://www.nibb.ac.jp/pressroom/news/uploads/20180905/Movie_S1.gif)
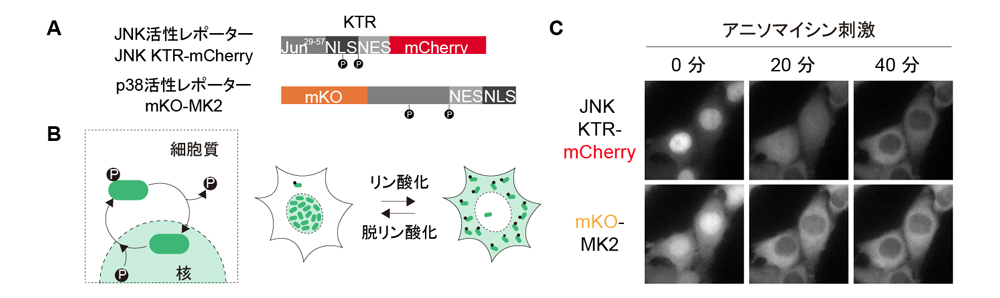 図1 p38とJNKの蛍光レポーターの作製と生細胞イメージング
図1 p38とJNKの蛍光レポーターの作製と生細胞イメージング
A. JNK活性レポーター JNK KTR-mChery(上)とp38活性レポーター mKO-MK2(下)の構造。
B. JNK活性レポーターとp38活性レポーターの動作原理。細胞内でJNK、p38が活性化するとレポーターは細胞の核から細胞質へと局在変化する。核と細胞質の蛍光強度比を測定することで活性化レベルを定量することができる。
C. アニソマイシン(タンパク質合成阻害剤)ストレス刺激によるJNKとp38活性の同時可視化。刺激により、両レポーターとも核から細胞質へと移行する。
次に様々なストレス(炎症性サイトカイン、浸透圧、紫外線)に細胞をさらした際のp38とJNKの活性を定量化しました。その結果、p38がJNKを負に制御する分子機構が明らかになりました。この負の制御機構は翻訳後修飾によるものと転写を介するものの2種類に分けられること、後者の分子機構はDUSP1というJNKの不活性化因子の発現誘導であることを見出しました(図2A)。さらにイメージングを進めていく過程で、JNKの活性は細胞間でばらつくこと、および、このJNK活性の細胞間の不均一性は、p38からJNKへの負の制御を阻害剤などで抑制すると消失することが分かりました(図2B)。
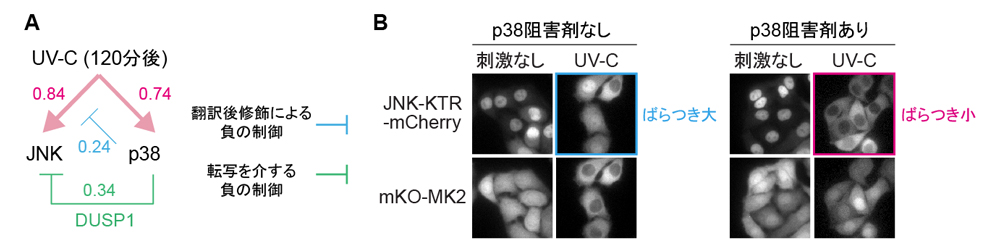 図2 ストレス刺激によるJNKとp38活性化経路の定量化
図2 ストレス刺激によるJNKとp38活性化経路の定量化
A. 紫外線(UV-C)刺激によるJNKとp38の活性化(ピンク矢印)と不活性化(青色線、緑色線)経路とその強さ(数値)をまとめた。
B. p38阻害剤によるJNKの活性化と細胞間のばらつきの減少。p38阻害剤がない状態(左)だと、UV-C刺激により、JNKとp38が両方とも活性化する。このときJNKは細胞ごとに活性化する細胞と活性化しない細胞にばらつく。p38阻害剤を処理すると(右)、UV-Cによるp38の活性化は抑制されるが(右下)、JNK活性化は亢進し、すべての細胞でJNK活性が一定になる(右上)。
最後に、JNK活性の細胞間の不均一性の意義を検証するために、紫外線(UV-C)によるp38とJNKの活性分布とアポトーシスの関係を調べました。その結果、紫外線刺激によってJNK活性がばらつくこと、JNK活性の高い細胞でのみアポトーシスが起きることが明らかになりました(図3)。
(動画2:http://www.nibb.ac.jp/pressroom/news/uploads/20180905/Movie_S2.gif)
またこのばらつきはp38からの負の制御因子であるDUSP1をノックアウトすることで消失し、ほとんどの細胞がアポトーシスすることが分かりました。CRISPR/Cas9遺伝子編集法により内在性のDUSP1を可視化したところ、紫外線によるDUSP1タンパク質の発現上昇もばらつきがあり、これが細胞死の運命を決定していることが明らかになりました。
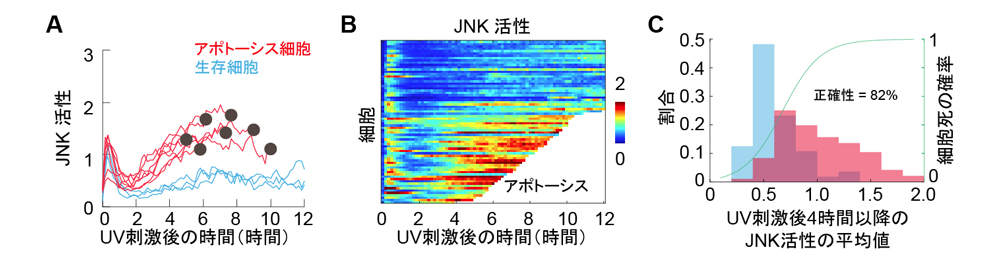 図3 紫外線(UV-C)による細胞死とJNK活性との関係
図3 紫外線(UV-C)による細胞死とJNK活性との関係
A.紫外線(UV-C)刺激によるJNK活性化の時系列データ。アポトーシスした細胞は赤色線(●はアポトーシスした時点)、生存細胞は青色線。
B. Aのデータをヒートマップで表現した。横軸は時間、縦軸は細胞、色はJNK活性を表している。白色の領域がアポトーシスした細胞データ。アポトーシスする細胞は、JNK活性が高くなることが分かる。
C. アポトーシスした細胞(赤色)と生存細胞(青色)のUV-C刺激後4時間後以降のJNK活性の平均値をヒストグラムで表した。アポトーシス細胞が生存細胞よりも有意にJNK活性が高い。ロジスティック回帰による判別結果を緑色線で表している。
これらの結果から、ストレスによって細胞がアポトーシスする細胞では、p38によるDUSP1の発現が十分でなく、その結果としてJNK活性が高くなり、アポトーシスのスイッチがオンになり、逆に生き残る細胞では、p38により十分にDUSP1が発現し、JNK活性が抑制されるためにアポトーシスを回避していることが明らかになりました(図4)。
【今後の展望】
青木教授は「今回、私達が見出したp38によるJNK活性とアポトーシスの抑制は、抗がん剤や放射線治療後の腫瘍細胞の部分的な殺傷(fractional killing)と治療抵抗性に寄与している可能性があると考えています。今後の展開としては、このようなシグナル伝達の不均一性を制御することで、放射線治療や抗がん剤の効果を増加させるような取り組みに発展させることが出来るかもしれません。」と語っています。
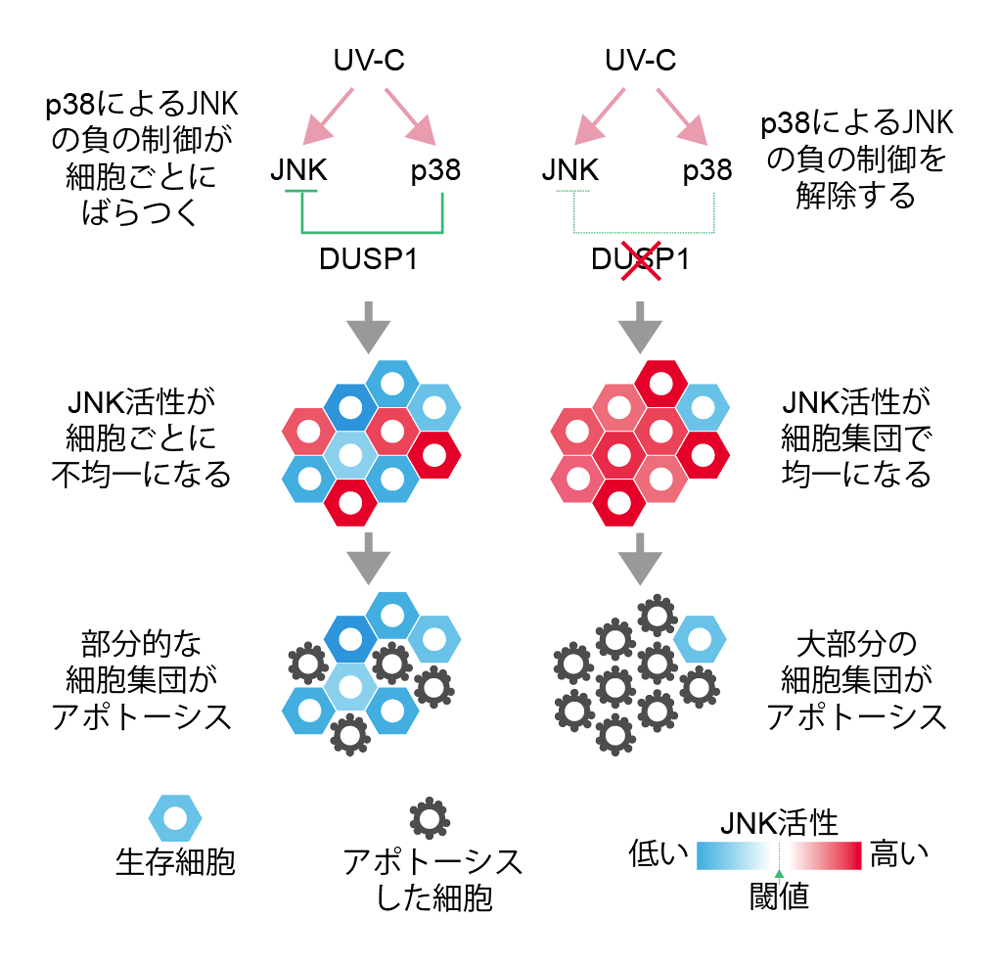 図4 今回の研究のまとめ
図4 今回の研究のまとめ
紫外線(UV-C)ストレス刺激により、JNKとp38はどちらも活性化するが、p38によるJNKの負の制御により、JNK活性が細胞間で不均一になる。その結果、部分的な細胞集団でUV-C刺激によるアポトーシスが起きる(左)。p38によるJNKの負の制御を解除すると、JNKの活性化が均一に起き、その結果、大部分の細胞集団でアポトーシスが引き起こされる(右)。
【発表雑誌】
雑誌名 Cell Reports
掲載日 2018年9月4日
論文タイトル: Cell-to-cell heterogeneity in p38-mediated cross-inhibition of JNK causes stochastic cell death.
著者:Haruko Miura, Yohei Kondo, Michiyuki Matsuda, Kazuhiro Aoki
DOI: https://doi.org/10.1016/j.celrep.2018.08.020
【研究グループ】
本研究は、基礎生物学研究所/生命創成探究センターの青木一洋教授、京都大学大学院生命科学研科の松田道行教授による共同研究グループの成果です。
【研究サポート】
本研究は、文部科学省科学研究費助成事業・新学術領域「共鳴誘導で革新するバイオイメージング」、基盤研究(B)、基盤研究(B)特設分野、AMED創薬等ライフサイエンス研究支援基盤事業 生命動態システム科学推進事業「多次元定量イメージングに基づく数理モデルを用いた動的生命システムの革新的研究体系の開発・教育拠点」、科学技術振興機構CREST(JPMJCR1654)の支援のもと行われました。
【本研究に関するお問い合わせ先】
基礎生物学研究所 定量生物学研究部門
生命創成探究センター 定量生物学研究グループ
教授 青木 一洋 (アオキ カズヒロ)
【報道担当】
基礎生物学研究所 広報室
自然科学研究機構 生命創成探究センター 広報担当