新たな治療標的としてのDNAシトシン脱アミノ化酵素の可能性
2019-05-17 京都大学
高折晃史 医学研究科教授、白川康太郎 同助教、山崎寛章 同研究員らの研究グループは、多発性骨髄腫における遺伝子変異蓄積の分子メカニズムの一端を解明しました。
がんは経過とともに遺伝子変異を蓄積しクローン進化を引き起こします。多くのがん患者では当初有効であった抗がん剤治療に対して抵抗性になることに、このクローン進化が関与していると考えられていますが、その分子メカニズムは解っていません。
今回、本研究グループは、内在性のDNAシトシン脱アミノ化酵素であるAPOBEC3Bが、骨髄腫のゲノムに特定のパターンの遺伝子変異を蓄積し、またこの変異の修復過程で遺伝子欠失を起こすことを明らかにしました。APOBEC3Bが蓄積する遺伝子異常が多発性骨髄腫のクローン進化やゲノム不安定性を促し、病期の進展や薬剤耐性化の原因となると考えられます。
本研究成果は、APOBEC3Bの酵素活性を阻害することで骨髄腫の「遺伝子変異を制御し、従来の抗がん剤治療の効果を維持する」という新たなコンセプトのがん治療の開発につながることが期待されます。
本研究成果は、2019年5月9日に、国際学術誌「Scientific Reports」のオンライン版に掲載されました。
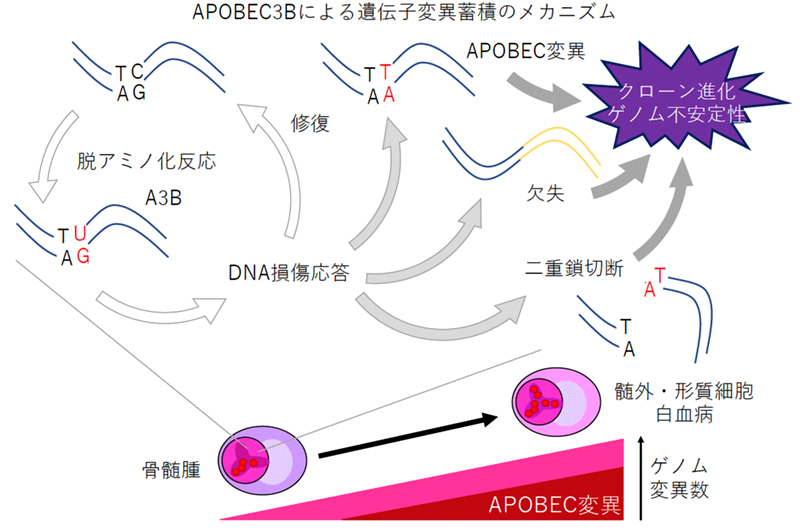
図:本研究の概要図
詳しい研究内容について
多発性骨髄腫における遺伝子変異蓄積の分子メカニズムの一端を解明 -新たな治療標的としてのDNAシトシン脱アミノ化酵素の可能性-
書誌情報
【DOI】 https://doi.org/10.1038/s41598-019-43575-y
【KURENAIアクセスURL】 http://hdl.handle.net/2433/241387
Hiroyuki Yamazaki, Kotaro Shirakawa, Tadahiko Matsumoto, Shigeki Hirabayashi, Yasuhiro Murakawa, Masayuki Kobayashi, Anamaria Daniela Sarca, Yasuhiro Kazuma, Hiroyuki Matsui, Wataru Maruyama, Hirofumi Fukuda, Ryutaro Shirakawa, Keisuke Shindo, Masaki Ri, Shinsuke Iida & Akifumi Takaori-Kondo (2019). Endogenous APOBEC3B Overexpression Constitutively Generates DNA Substitutions and Deletions in Myeloma Cells. Scientific Reports, 9:7122.
京都新聞(5月10日 24面)および産経新聞(5月10日 28面)に掲載されました。
多発性骨髄腫における遺伝子変異蓄積の分子メカニズムの一端を解明
―新たな治療標的としての DNA シトシン脱アミノ化酵素の可能性―
概要
京都大学大学院医学研究科 高折晃史 教授、白川康太郎 同助教、山崎寛章 同研究員らの研究グループは、多発性骨髄腫における遺伝子変異蓄積の分子メカニズムの一端を解明しました。
がんは経過とともに遺伝子変異を蓄積しクローン進化を引き起こします。多くのがん患者では当初有効であった抗がん剤治療に対して抵抗性になることに、このクローン進化が関与していると考えられていますが、その分子メカニズムは解っていません。今回、本研究グループは、内在性の DNA シトシン脱アミノ化酵素である APOBEC3B が、骨髄腫のゲノムに特定のパターンの遺伝子変異を蓄積し、またこの変異の修復過程で遺伝子欠失を起こすことを明らかにしました。APOBEC3B が蓄積する遺伝子異常が多発性骨髄腫のクローン進化やゲノム不安定性を促し、病期の進展や薬剤耐性化の原因となると考えられます。この知見は、APOBEC3B の酵素活性を阻害することで骨髄腫の『遺伝子変異を制御し、従来の抗がん剤治療の効果を維持する』という新たなコンセプトのがん治療の開発につながると考えています。
本研究成果は、2019 年 5 月 9 日に国際学術誌「Scientific Reports」のオンライン版に掲載されました。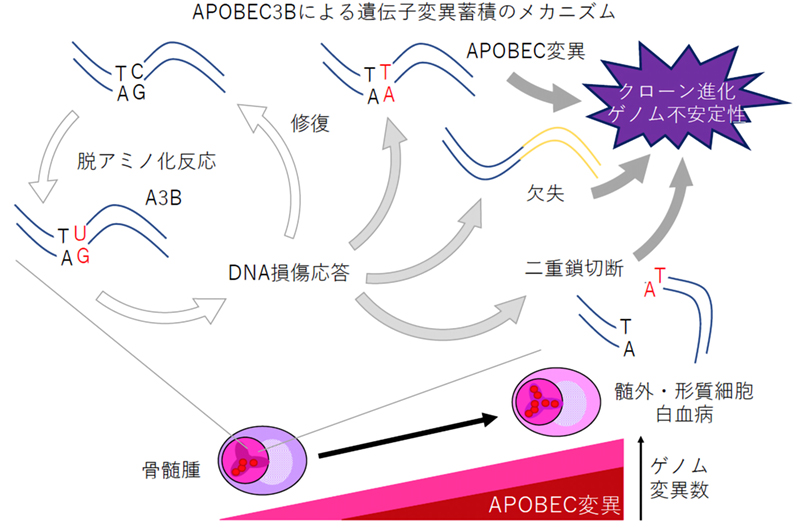 1.背景
1.背景
多発性骨髄腫は血液の細胞の一つである形質細胞ががん化した悪性腫瘍です。新しい種類の抗がん剤が開発され治療成績は格段に向上しましたが、多くの場合完治は困難で、長期的にはこれらの抗がん剤でも効果がなくなってしまいます。この薬剤耐性化は遺伝子異常の蓄積により起こると考えられていますが、どのように遺伝子異常が蓄積されるかは今まで明らかにされていませんでした。
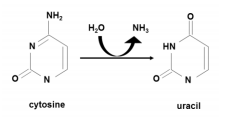
APOBEC は DNA シトシン脱アミノ化反応を触媒する酵素で、結果としてシトシンをチミンに変換し遺伝子変異を引き起こします。元々はウイルスの遺伝子に変異を導入することで、ウイルス感染に対する自然免疫として機能することが知られていましたが、多発性骨髄腫を含む一部のがんのゲノムにはこの酵素が特異的に認識する配列に遺伝子異常が蓄積することが知られています。
2.研究手法・成果
11 種類ある APOBEC のうち APOBEC3B(以下 A3B)が多発性骨髄腫で過剰に発現していること、A3B をあまり発現していない場合と比べて A3B を過剰に発現している骨髄腫の治療成績が良くないことを見いだしました。次に、ほとんどの骨髄腫細胞株に A3B が過剰発現していることを確認し、shRNA を使って A3B を抑制した場合には遺伝子変異の蓄積が見られないこと、抑制しない場合には A3B が認識する配列に遺伝子変異が蓄積しているだけでなく、短い DNA の欠失が生じることを確認しました。これらの結果は、多発性骨髄腫において A3B が遺伝子変異蓄積の原因となっており、病状や治療成績の悪化、抗がん剤に対する薬剤耐性化に関係することを示していると考えられます。
3.波及効果、今後の予定
本研究は、A3B が骨髄腫で『遺伝子変異を制御し、従来の抗がん剤治療の効果を維持する』という新たなコンセプトのがん治療の標的となりうることを明らかにしました。APOBEC はさらに乳がんや、肺がん、膀胱がん、子宮頚がんなど、多くの種類のがんにも遺伝子変異を引き起こすことが報告されています。A3B 阻害剤の開発により、多くのがんに対してこの新たなコンセプトのがん治療を併用することで、治療成績を向上することができる可能性があると考えています。
4.研究プロジェクトについて
本研究は理化学研究所 生命医科学研究センター、東北大学 加齢医学研究所、名古屋市立大学 大学院との共同研究であり、科研費の助成を受けて行われました。
<研究者のコメント>
APOBEC は発癌に関わる因子として近年注目が高まっています。腫瘍細胞由来の A3B のゲノム変異作用を綺麗に検出できたときはたいへん感動しました。特に、DNA 二重鎖の転写側の一本鎖に特異的に変異が入っていたり、全ての TC の部分に変異が入るわけではないことなど、これまでに APOBEC パターンと言われているフットプリントの特徴に新たな知見を加えるデータが意義深いと考えています。
<論文タイトルと著者>
タイトル:Endogenous APOBEC3B Overexpression Constitutively Generates DNA
Substitutions and Deletions in Myeloma Cells(骨髄腫細胞では APOBEC3B
の過剰発現により恒常的に DNA の変異と欠失が生み出されている)
著 者:Hiroyuki Yamazaki1 (山崎寛章), Kotaro Shirakawa1 (白川康太郎),
Tadahiko Matsumoto1 (松本忠彦), Shigeki Hirabayashi1, 2(平林茂樹),
Yasuhiro Murakawa2 (村川泰裕), Masayuki Kobayashi1 (小林正行),
Anamaria Daniela Sarca1 , Yasuhiro Kazuma1 (数馬安浩),
Hiroyuki Matsui1 (松井宏行), Wataru Maruyama1 (丸山亙),
Hirofumi Fukuda1 (福田寛文), Ryutaro Shirakawa3 (白川龍太郎),
Keisuke Shindo1 (新堂啓祐), Masaki Ri4 (李正樹), Shinsuke Iida4 (飯田真介)
and Akifumi Takaori-Kondo1 (高折晃史)
所 属:1 京都大学大学院 医学研究科 血液・腫瘍内科学、
2 理化学研究所 生命医科学研究センター、
3 東北大学 加齢医学研究所、
4 名古屋市立大学大学院 医学研究科 血液・腫瘍内科学
掲 載 誌:Scientific Reports DOI:10.1038/s41598-019-43575-y
<用語解説>
DNAシトシン脱アミノ化酵素:DNAのシトシンを脱アミノ化してシトシンに変換する酵素
クローン進化:共通の細胞より生じたがん細胞に遺伝子変異が生じてサブクローンが形成され、競合的選択に曝されることで、自然淘汰され進化すること
ゲノム不安定性:がん細胞などで DNA 修復機構・DNA 損傷応答機構に障害があり、正常に損傷を取り除くことができなっている状態
shRNA:相補的配列を持つ遺伝子の発現を抑制するヘアピン型の RNA 配列