2020-07-28 理化学研究所
理化学研究所(理研)生命機能科学研究センター個体パターニング研究チームの濱田博司チームリーダー、水野克俊研究員(研究当時、現客員研究員)らの共同研究グループは、動物の体の左右非対称性を決定する仕組みにおいて、繊毛[1]に流入するカルシウムイオン(以下カルシウム)が決定的な役割を果たすことを解明しました。
多くの動物の体は、表面的には左右対称ですが、臓器の形や配置など体内構造のほとんどは非対称です。この左右非対称性は、胚発生の初期に見られる「ノード[2]」という部位で決定されます。ノードには、動く繊毛(動繊毛)を持つ細胞と動かない繊毛(不動繊毛)を持つ細胞があり、動繊毛の回転により細胞外の体液が左向きに流れます。この水流をノード周縁部の細胞が不動繊毛で感知すると、左右非対称性を作り出すためのシグナルが開始します。不動繊毛には細胞外のカルシウムを細胞内に流入させるタンパク質が存在しますが、水流を感知する際にカルシウムが重要な役割を果たすかどうか、議論が分かれていました。
今回、共同研究グループは、トランスジェニックマウス[3]とライブイメージング[4]技術を駆使して、ノード周縁部の細胞内のカルシウムを直接可視化・観察しました。その結果、カルシウムの活発な濃度変化が観察され、水流に反応して繊毛へ流入するカルシウムの存在が示されました。この繊毛へのカルシウム流入は、ノードの左側で特異的に起こり、抑制すると左右の決定が遅れることから、ノードでの左右対称性の破れに必要であることが示唆されました。
本研究は、科学雑誌『Science Advances』(7月23日付)に掲載されました。
マウス初期胚の遺伝子発現(青色)の左右非対称性を決定するノードと繊毛
背景
多くの動物の体は外見的にはほぼ左右対称ですが、ヒトの心臓のように体の内部にある臓器のほとんどは、その形や配置が左右非対称です。この非対称性は、体ができる発生過程の早い段階で生まれます。この体の左右非対称性に異常が生じると、心疾患などさまざまな病気の原因となります。
ヒトを含む哺乳類では、初期胚の腹側に一過的に形成される、くぼみを持った構造「ノード」が左右を決定します。過去の研究から、左右非対称な臓器の形や配置ができる過程には、ノードの繊毛が決定的な役割を果たすことが知られています。ノードには2種類の繊毛が生えており、ノード中央部の細胞に生えている動く繊毛(動繊毛)と、ノード周縁部の細胞に見られる動かない繊毛(不動繊毛)とがあります(図1)。ノードの中央で動繊毛が回転運動し、周りの体液を左方向へ動かすことで流れの上流と下流が区別され、ノードの右側と左側で異なる遺伝子群を働かせるためのスイッチがオンとなり、左右対称性が破られます。この動繊毛による流れ(ノード流)は、ノード周縁部の不動繊毛により感知されます。
この仕組みとして、流れを感知すると不動繊毛に存在するPkd2[5]と呼ばれるカチオンチャネル[5]からカルシウムイオン(以下カルシウム)が流入し、細胞を左側と決定するためのシグナル伝達が開始されるとこれまで考えられてきました。しかし、2016年に米国のグループにより、繊毛に直接的に流れを吹きかけても繊毛へのカルシウム流入が起こらないという報告がなされ、繊毛とカルシウムの関係に関して疑問が投げかけられました注1)。そこで共同研究グループは、ノード周縁部の繊毛へのカルシウム流入が実際に起きているかを検証するため、細胞内のカルシウム濃度を可視化できるトランスジェニックマウスを作製し、ライブイメージングで観察することを試みました。
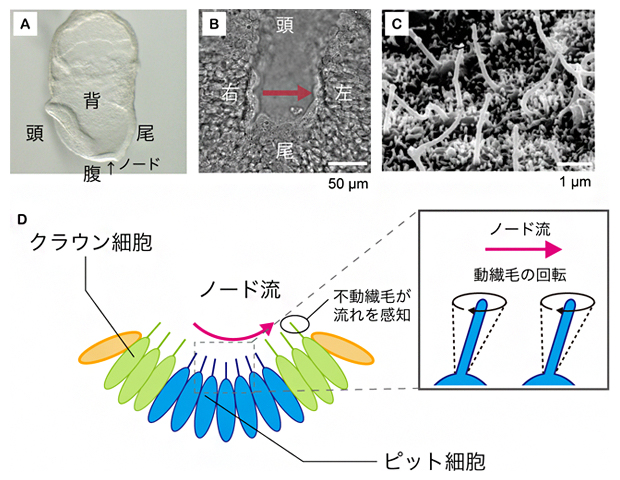
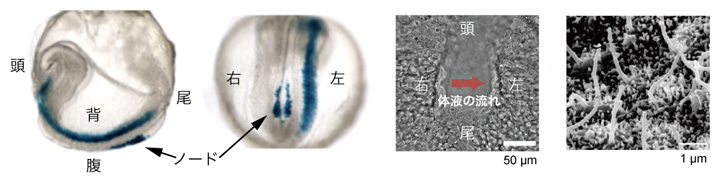
図1 マウス初期胚におけるノードの構造とノード流発生の仕組み
A)マウス受精後8日目胚を左側面から見た図。
B)ノードを腹側から捉えた拡大図。赤矢印のように、ノード流は右から左に流れる。スケールバーの1μmは1,000分の1mm。
C)ノードの繊毛の電子顕微鏡写真※。一つの細胞から、1本の長い動繊毛または不動繊毛が生じる。
D)ノード流の発生と感知の仕組み。ノード中央のピット細胞の動繊毛が斜めに回転運動をすることで、周りの体液を左方向へ動かし、ノード流を発生させる。この流れは、ノード周縁部のクラウン細胞の不動繊毛により感知される。
※出典)Shiratori, H.; Hamada, H. The left-right axis in the mouse: From origin to morphology. Development 133, 2095-2104 (2006).
注1)M. Delling, A. A. Indzhykulian, X. Liu, Y. Li, T. Xie, D. P. Corey, D. E. Clapham, Primary cilia are not calcium-responsive mechanosensors. Nature 531, 656-660 (2016).
研究手法と成果
本研究では、細胞内のカルシウムに依存して緑色蛍光を発するカルシウムセンサータンパク質GCaMP6[6]と、カルシウムに依存しない赤色蛍光タンパク質mCherryを用いました。共同研究グループは、これらのタンパク質がノード周縁部の細胞に発現するトランスジェニックマウスを作製し、不動繊毛特異的にGCaMP6とmCherryを発現させることに成功しました(図2左)。胚を生きたまま観察するライブイメージングにより数分間にわたって観察した結果、繊毛内で激しくカルシウム濃度が変動していることが、マウス胚において初めて示されました(図2右)。
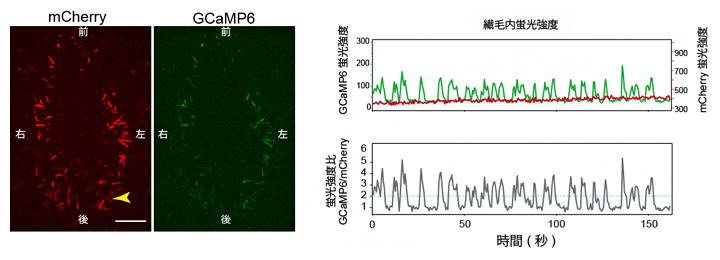
図2 ノード不動繊毛での蛍光タンパク質発現による、細胞内カルシウム濃度変化の可視化
左)ノードを腹側から観察した蛍光顕微鏡像。前後左右は胚での体軸方向を示す。スケールバーは25μm。
右)左図の矢じりで示した繊毛のGCaMP6(緑線)およびmCherry(赤線)の蛍光強度変化(上グラフ)と、GCaMP6とmCherryの蛍光強度比(下グラフ)を示す。カルシウムに依存しないmCherryがほぼ一定の蛍光強度であるのに対して、カルシウムセンサーであるGCaMP6のみが蛍光変化を示し、繊毛におけるカルシウム濃度変化の存在が示された。
次に、これらの繊毛内カルシウム濃度変化に左右差があるかを詳細に調べました。カルシウムの瞬間的な増加(スパイク)の頻度を計測したところ、正常なマウス胚では、ノードの左側が右側よりも高いスパイク頻度を示しました。一方、カルシウムを細胞内に流入させるカチオンチャネルを作るPkd2遺伝子の変異体や、繊毛が不動となるiv/iv変異体[7]では、このような左右での違いが見られませんでした(図3)。
さらに、繊毛以外の細胞内(細胞体)でのカルシウムシグナルを可視化するトランスジェニックマウスを作製したところ、細胞体でのカルシウム濃度変化も左側で頻度が高い傾向が見られました。また、Pkd2、iv/iv変異体、および繊毛を持たないKif3a[8]変異体では、いずれも左側への偏りは観察されませんでした。これらのことから、繊毛と細胞体での左右非対称なカルシウム濃度変化に、ノードでの水流の存在、カルシウムに依存したシグナル伝達に関わるPkd2チャネルの存在とその感知に関わる不動繊毛の存在が必要であることが明らかになりました。
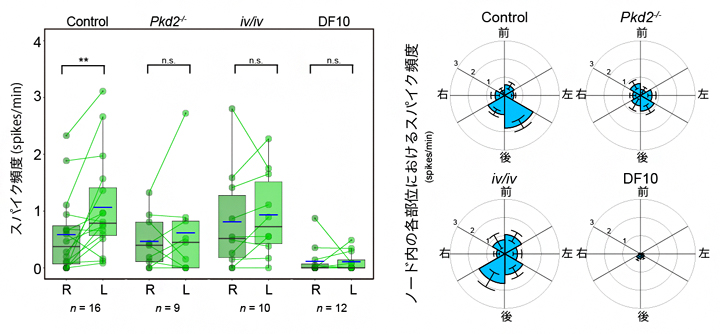
図3 左右で異なる繊毛内カルシウムの変化頻度
左)繊毛におけるカルシウム濃度頻度数の比較。点は個体ごとの計測値を示し、同じ個体の左右の値を線でつなげている。Control(正常胚)では左側が大きくなっているが、Pkd2、iv/iv変異体では左右差が失われている。なお、先行研究においてカルシウム流入が観察されなかった培養条件(DF10)では、繊毛内のカルシウム変動そのものが大きく減少していた。
右)ノードの部位における頻度の比較。正常マウス胚では、ノードの左側後方で特にカルシウム濃度変化が観察された。
以上の結果は、左右決定と繊毛内カルシウム濃度変化が密接に関係することを強く示唆しています。しかし、繊毛でのカルシウム濃度変化が、ノード流から繊毛へのカルシウムの直接的流入であるか、細胞体に由来するカルシウムから繊毛の漏れ込みであるのかはまだ明確ではありません。細胞内のカルシウムは小胞体[9]に蓄積されており、小胞体膜に存在するカルシウムポンプの働きで細胞体のカルシウム濃度が調節されています。そこで、カルシウムポンプの阻害剤であるタプシガルギン[9]でマウス胚を処理し、細胞体のカルシウム濃度変化を停止させたところ、繊毛内のカルシウム濃度変化を示すスパイクの多くが失われましたが、一部残存して観察されるスパイクも存在しました(図4)。
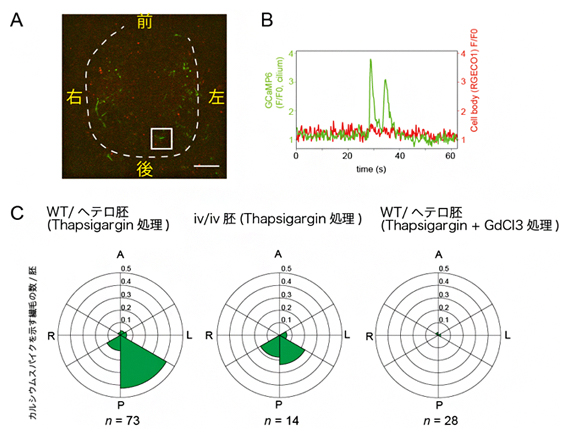
図4 細胞体におけるカルシウム濃度変化を除去した後も残存する繊毛内カルシウムシグナル
A)タプシガルギン(Thapsigargin)処理を施したマウス胚のノードの蛍光顕微鏡像。緑がカルシウムシグナルを示す。四角で囲った部分は、Bでのカルシウムシグナルを示す繊毛。スケールバーは20μm。
B)Thapsigargin処理により細胞体におけるカルシウム濃度上昇を停止させても、繊毛内カルシウム濃度上昇に由来するピークが一部残存している。
C)Thapsigargin処理下での細胞体カルシウムシグナルを伴わないカルシウム変動を示す繊毛の部位分布。対照実験の胚(WT/ヘテロ胚)では左側後方に特に集中する。一方、動繊毛を持たないiv/iv胚や、繊毛のカチオンチャネルの阻害剤GdCl3で処理した胚では、左側への偏差が観察されない。
このことは、繊毛において見られるカルシウム濃度変化には二つのタイプが存在することを示しています(図5)。一つ目(タイプ1)は、繊毛に依存するタイプのカルシウム経路です。ノード流からのシグナルを受けた不動繊毛におけるカルシウム濃度上昇をきっかけとして、細胞体でのカルシウム濃度はノードの左側で上昇します。もう一方(タイプ2)の繊毛非依存的なカルシウム経路では、左右差のないカルシウム濃度上昇です。
ノードの細胞がどのようにして繊毛依存的なシグナルと非依存的なカルシウムシグナルを区別するかは今後の課題ですが、一つにはカルシウム濃度上昇が生じる細胞内の位置が重要であると考えられます。タイプ1の変動が細胞の中でも特に繊毛基部の近傍で見られますが、タイプ2のカルシウム濃度変動にはこのような特徴は見られません。面白いことに、この繊毛基部の近傍は、ノード流を受けた後に、左右決定に関わるCerl2[10]遺伝子のmRNAの分解が起こることが知られている場所です。タイプ1のカルシウムが、優先的にCerl2mRNAの分解を引き起こしているのかもしれません。この可能性を示唆する実験結果として、繊毛のカルシウム流入が抑制されるトランスジェニックマウスでは、Cerl2mRNAの左右非対称な分布(ノード左側でのCerl2mRNA発現の低下)の確立が遅れることが確認されました。
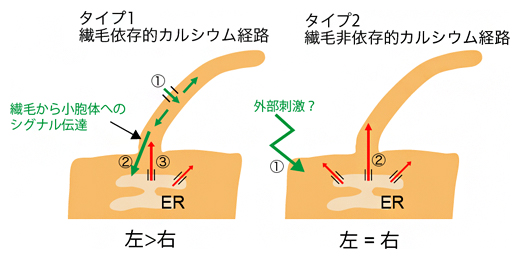
図5 二つのタイプの繊毛内カルシウム経路
タイプ1では、①ノード流を感知した繊毛に発現するカチオンチャネルにより細胞外のカルシウムが流入し、②このシグナルが繊毛基部を経て小胞体(ER)に伝達され、③小胞体に蓄積されたカルシウムがポンプの働きで細胞体に放出される。タイプ2では、①何らかの外部刺激等により、②小胞体に蓄積されたカルシウムがポンプの働きで細胞体に放出され、それが繊毛にも拡散する。
今後の期待
今回の研究により、不動繊毛がノード流を感知する際に、カルシウムシグナルが重要な役割を果たすことが示されました。一方、残された重要な疑問として、不動繊毛が感知しているのが流れによる物理的な刺激か、化学的な刺激かは、未だ明らかではありません。今後の研究で長年の謎になっているこの疑問を明らかにしたいと思います。また、細胞質におけるカルシウムシグナルが、実際にCerl2mRNAの分解を引き起こすメカニズムも解明したいと考えています。
補足説明
1.繊毛
細胞から突出する微小管を含む構造(オルガネラ)。繊毛には動くもの(動繊毛)と動かないもの(不動繊毛)があり、前者には、気道上皮・脳室上衣の繊毛や精子の鞭毛がある。後者は体の中のほとんどの細胞に見られ、細胞外からの種々のシグナルを感知するアンテナの役割を持つ。
2.ノード
哺乳類において左右対称性が破られる胚の部位。胚の腹側に一過的に現れ、くぼみのような外見を持つ。
3.トランスジェニックマウス
広義では何らかの遺伝子改変を持つマウスであるが、通常は狭義で用いられ、人工的な操作により外来性の遺伝子がゲノム中に挿入されたマウスを意味する。
4.ライブイメージング
生きた細胞や組織、個体の生命活動を継時観察すること。特に、GFPなどの蛍光タンパク質を用いて特定のタンパク質や細胞を標識し、蛍光顕微鏡でその動きや変化を詳細に観察する手法は、生命科学の必須の手法となっている。
5.Pkd2、カチオンチャネル
カチオンチャネルは、細胞膜などの生体膜上にあり、膜を隔てたイオンの濃度差を調節する分子のうち、カチオン(陽イオン)を濃度勾配に従って受動的に透過させるもの。Pkd2は、腎臓の遺伝性疾患である多発性嚢胞腎の原因タンパク質であり、カルシウム透過性カチオンチャネルとして機能する。
6.GCaMP6
カルシウムに結合すると緑色の蛍光輝度が変化する蛍光タンパク質GCaMPの、カルシウムに対する感度を向上させた改良版。2012年に埼玉大学(当時)の大倉正道博士らにより報告された。
7.iv/iv変異体
内臓の配置が左右正常な個体と左右逆になった個体が1:1の割合で生まれるマウスの変異体。モータータンパク質ダイニンの欠失により、動繊毛の回転運動が起こらなくなり、ノード流が失われたことが原因とされる。
8.Kif3a
繊毛の形成に関わるモータータンパク質キネシンをコードする遺伝子。
9.小胞体、タプシガルギン
小胞体は一重の膜で形成された細胞小器官で、タンパク質の合成や品質管理、およびカルシウムの貯蔵庫として働く。タプシガルギン(Thapsigargin)は小胞体膜上のカルシウムポンプを阻害する薬剤で、細胞質から小胞体へのカルシウムの取り込みを抑制し、小胞体から細胞質へのカルシウムの流出を促進する。
10.Cerl2
ノードで発現する分泌タンパク質Cerl2をコードする遺伝子。ノード流に反応して最も初期に左右非対称な発現を示す。
共同研究グループ
理化学研究所 生命機能科学研究センター
個体パターニング研究チーム
チームリーダー 濱田 博司(はまだ ひろし)
研究員(研究当時) 水野 克俊(みずの かつとし)
(現 客員研究員、福井大学医学部助教)
研究員 加藤 孝信(かとう たかのぶ)
研究員 峰岸 かつら(みねぎし かつら)
研究員 井手 隆広(いで たかひろ)
テクニカルスタッフⅠ 井川 弥生(いかわ やよい)
テクニカルスタッフⅠ 西村 博美(にしむら ひろみ)
細胞場構造研究チーム
チームリーダー 岩根 敦子(いわね あつこ)
研究員 板橋 岳志(いたばし たけし)
大阪大学大学院 生命機能研究科
准教授(研究当時) 白鳥 秀卓(しらとり ひでたか)
(現 京都産業大学総合生命科学部動物生命医科学科教授)
助教(研究当時) 高岡 勝吉(たかおか かつよし)
(現 徳島大学先端酵素学研究所准教授)
博士課程学生(研究当時) 塩澤 啓(しおざわ けい)
(現 大塚製薬)
東北大学大学院 歯学研究科
教授 中井 淳一(なかい じゅんいち)
研究支援
本研究の一部は、科学技術振興機構(JST)戦略的創造研究推進事業CREST「生命動態の理解と制御のための基盤技術の創出(領域代表者:山本雅)」、日本学術振興会(JSPS)科学研究費補助金基盤研究A「形態の非対称性の起源(研究代表者:濱田博司)」、同若手研究B「体の左右を決定づけるノード繊毛におけるカルシウム動態の可視化」、同基盤研究C「左右決定におけるノード繊毛由来カルシウムの機能解明(研究代表者:水野克俊)」による支援を受けて行われました。
原論文情報
Katsutoshi Mizuno, Kei Shiozawa, Takanobu A. Katoh, Katsura Minegishi, Takahiro Ide, Yayoi Ikawa, Hiromi Nishimura, Katsuyoshi Takaoka, Takeshi Itabashi, Atsuko Iwane, Junichi Nakai, Hidetaka Shiratori, Hiroshi Hamada, “Role of Ca2+ transients at the node of the mouse embryo in breaking of left-right symmetry”, Science Advances., 10.1126/sciadv.aba1195
発表者
理化学研究所
生命機能科学研究センター 個体パターニング研究チーム
チームリーダー 濱田 博司(はまだ ひろし)
研究員(研究当時) 水野 克俊(みずの かつとし)
(現 客員研究員)
報道担当
理化学研究所 広報室 報道担当