2021-06-10 東海大学,日本医療研究開発機構
概要
ヒト多能性幹細胞(iPS/ES細胞)から目的の分化細胞を効率的に作製することは、再生医療や創薬開発において重要なステップとなります。今回、東海大学医学部基礎医学系分子生命科学の福田篤講師等のグループは、ヒト多能性幹細胞と初期胚特異的に発現するLarge non-coding RNA XACT遺伝子が、女性多能性幹細胞特有のエピゲノム異常であるX染色体不活化の異常には関与せず、神経分化を制御していることを発見しました。本研究成果は、米国科学雑誌「Cell Reports」に2021年6月8日11時(米国東部時刻)に公開されました。
研究背景
ヒト多能性幹細胞(iPS/ES細胞*1)は体を構成する全ての細胞に分化することが可能です。その一方で、私達の体にはiPS細胞のような、いわゆる“万能細胞”は存在しませんが、iPS/ES細胞は着床直前の細胞によく似た性質を備えています。それ故、iPS/ES細胞は体を構成する全ての細胞へ分化することが可能であり、再生医療や創薬開発の分野において活躍しています。
しかし、ヒトには個体差があるようにiPS/ES細胞にも個体差はあります。特に、目的の細胞に分化させる際の効率は、個体差に大きく影響されます。さらに、体に存在しないiPS/ES細胞では、試験管産物特有の異常を引き起こすことが報告されています。代表的な試験管産物特有の異常は、女性iPS/ES細胞に生じる性染色体の異常です。通常、女性の細胞は2つのX染色体のうち1つが働かないように制御されています(X染色体不活化*2)。このX染色体不活化は、男性と女性の細胞において、X染色体からの遺伝子の量を平等にする働きを担っています。しかし、女性由来のiPS/ES細胞では、X染色体不活化が不可逆的に破綻し、本来働いていないX染色体からたくさんの遺伝子が動き始めてしまい、体には存在しない細胞状態となります。女性iPS/ES細胞におけるX染色体不活化破綻の影響は不明な点が多く残されています。
本研究の目的
私達は、ヒトiPS/ES細胞とヒト初期胚において男性、女性の細胞特異的に発現する非コード長鎖RNA XACT遺伝子(*3)に着目しました。
XACT遺伝子は、これまでの研究から以下のことが示されていました。
- ヒト着床期胚(男女とも)特異的な発現をするが機能は不明
- XACTはX染色体上の遺伝子であり、女性iPS/ES細胞で生じるX染色体不活化の異常の際、発現量が倍増し、X染色体不活化異常への関与が示唆されている
XACT遺伝子は、染色体DNAから転写された後にタンパク質を作らないnon-coding RNAとして働き、その長さが約250Kbもある非常に大きなRNAです。巨大な遺伝子であるが故に、その機能解析は行われていませんでした。
今回、私達はCRISPR/Cas9システム(*4)のゲノム編集技術を駆使し、XACT遺伝子の全長領域約400Kb除去することでXACT遺伝子の機能解析を行いました。
発見した事柄
ヒトiPS細胞を用いた結果、以下のことを突き止めました。
- XACT遺伝子は女性iPS/ES細胞におけるX染色体不活化異常には関与していない
- XACT遺伝子は神経細胞関連の遺伝子制御を行い、女性だけでなく、男性のiPS細胞においても神経分化を抑制している
研究結果の概要図
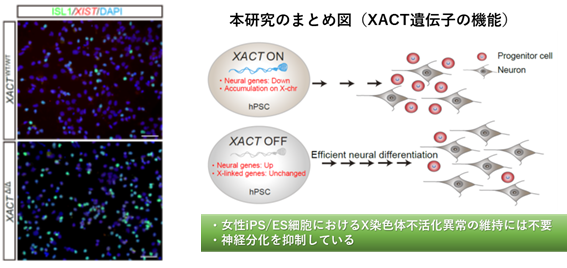
写真上(XACT正常iPS細胞由来)、写真下(XACT欠損iPS細胞由来)
緑:ISL1(運動神経マーカー)がXACT欠損により著しく増加している
今後の展望
今回、ヒトiPS/ES細胞を用いて、機能未知であった非コード長鎖RNA XACT遺伝子が男性・女性どちらのiPS細胞においても神経分化を制御する機能があることを初めて明らかにしました。XACT遺伝子はヒト初期発生胚特異的に発現していることを考慮すると、XACT遺伝子の時空間的な発現制御は、細胞が正しい方向へと分化するうえで重要な役割を担っていると考えられます。一方、女性iPS/ES細胞特異的なX染色体不活化破綻においては、これまで考えられていた説とは異なり、XACT遺伝子は関与していないことを発見し、別の機構が関与することが示唆されました。
本研究結果より、ヒトiPS/ES細胞におけるXACT遺伝子の働きを抑制することは、効率的な神経細胞作製へとつながることが示され、再生医療や創薬開発における活用に期待がもてます。さらに、ヒトiPS/ES細胞は、XACT遺伝子のように多くの遺伝子の動きがヒト初期胚と類似していることから生殖医療分野への研究展開にも活用出来ることが示されました。
本研究への支援
本研究は国立研究開発法人日本医療研究開発機構(AMED)再生医療実現拠点ネットワーク 幹細胞・再生医学イノベーション創出プログラム「ヒト多能性幹細胞を用いた転写/エピゲノム多様性・性差に基づく神経細胞分化能の制御機構解明と予測モデルの構築(代表:福田篤)」、神澤医学研究振興財団(代表:福田篤)、日本学術振興会基盤研究A(代表:阿久津英憲)の支援により行われました。
用語解析
- (*1) iPS/ES細胞
- induced pluripotent stem cell (iPS)/embryonic stem cell どちらも体を構成するほとんどの細胞に分化することができる多能性を備えた幹細胞。
- (*2) X染色体不活化
- 女性には性染色体であるX染色体が2つあり、そのうち1つを働かないようにしている。X染色体不活化は、男性の1つのX染色体と比較した際に、X染色体遺伝子量を男女間で均等にするために進化の過程で備えた機構。X染色体不活化の破綻などは、がん細胞などでみられ、細胞の機能に影響することが示唆されている。
- (*3) 非コード長鎖RNA XACT
- X染色体にコードされているタンパク質をつくらないRNA分子の一つ。RNA分子の長さが約250Kbあり、非常に巨大なRNA分子である。ヒト初期胚とiPS/ES細胞で特異的に発現している。女性のiPS/ES細胞では、X染色体不活化破綻により、XACT遺伝子量が倍増されており、X染色体不活化破綻の維持に必須であると考えられていた。
- (*4) CRISPR/Cas9システム
- ゲノム編集技術であり、DNAの特定領域を「はさみ」のように切断する。切断されたDNAは細胞の自己修復機能によって、切断面をつなぎ合わせる。しかし、完璧に元通りなることは少なく、切られた箇所を省いて末端同士が結合することがある。このシステムを利用して、本研究では約400KbものXACT遺伝子領域を欠損させることに成功した。
掲載誌情報
- 雑誌名
- Cell Reports
- タイトル
- Deletion of lncRNA XACT does not change expression dosage of X-linked genes but affects differentiation potential in hPSCs
- 著者
- Nami Motosugi1, Chisa Okada4, Akiko Sugiyama1, Tomoyuki Kawasaki5, Minoru Kimura2, Takashi Shiina1, Akihiro Umezawa5, Hidenori Akutsu5, Atsushi Fukuda1,2,3,5
- DOI
- 10.1016/j.celrep.2021.109222
- 所属情報
-
- 東海大学医学部医学科基礎医学系分子生命科学
- 東海大学総合医学研究所
- 東海大学マイクロ・ナノ研究開発センター
- 東海大学生命科学統合支援センター
- 国立成育医療研究センター研究所 再生医療センター
お問い合わせ先
研究に関して
福田 篤(ふくだ あつし)
東海大学医学部医学科基礎医学系分子生命科学
報道等その他に関して
東海大学メディカルサイエンスカレッジオフィス(研究支援担当)
AMED事業について
国立研究開発法人日本医療研究開発機構
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課