2022-06-14 スイス連邦工科大学ローザンヌ校(EPFL)
プロトコルは、加齢黄斑変性症に対する安全かつ効率的な多能性幹細胞ベースの治療法を開発できることを示すものである。この研究は、Stem Cell Reports誌の今月の表紙で発表され、特集されています。
ヒト胚性幹細胞をRPE細胞に分化させるためのプロトコルを、実際に臨床使用を想定したものにする研究を主導しています。このプロトコルは、加齢黄斑変性症に対する安全かつ効率的な多能性幹細胞ベースの治療法を開発できることを示すものである。この研究は、Stem Cell Reports誌の今月の表紙で発表され、特集されています。
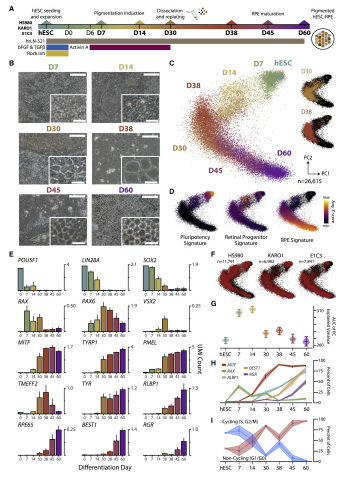
「定量的PCRやバルクRNA-seqなどの標準的な方法では、大規模な細胞集団のRNAの平均的な発現を捉えることができます」と、EPFLの博士課程学生でこの研究の主執筆者の一人であるAlex Ledererは述べています。「混合細胞集団では、これらの測定によって、プロセスが正しく展開されているかどうかを知るために重要な、個々の細胞間の重要な差異が不明瞭になる可能性があります」。その代わりに、研究者達は、単一細胞RNAシーケンス(scRNA-seq)と呼ばれる技術を使い、ある時点で個々の細胞内の全ての活性遺伝子を検出することができます。
研究チームはscRNA-seqを用いて、合計60日間かかる分化プロトコルの間、個々のヒト胚性幹細胞の全遺伝子発現プロファイルを調べることに成功した。これにより、網膜色素細胞に成長する際の集団内の過渡的な状態をすべて把握できただけでなく、プロトコルを最適化して非RPE細胞の成長を抑制し、汚染された細胞集団が形成されるのを防ぐことができました。
その結果、幹細胞はRPE細胞になるまでに、初期胚発生と非常によく似たプロセスを経ることがわかった。これは、胚の神経管が発達し、脳や視覚、聴覚、味覚などの感覚器官が形成される過程である。このパターニングの後、幹細胞はRPE細胞へと成熟を開始した。
<関連情報>
- https://actu.epfl.ch/news/streamlining-stem-cells-to-treat-macular-degenerat/
- https://www.cell.com/stem-cell-reports/fulltext/S2213-6711(22)00257-0
幹細胞由来網膜色素上皮細胞分化の分子プロファイリングが臨床応用に向けて確立された Molecular profiling of stem cell-derived retinal pigment epithelial cell differentiation established for clinical translation
Sandra Petrus-Reurer ,Alex R. Lederer ,Laura Baqué-Vidal,Iyadh Douagi,Belinda Pannagel,Irina Khven,Monica Aronsson,Hammurabi Bartuma,Magdalena Wagner,Andreas Wrona,Paschalis Efstathopoulos,Elham Jaberi,Hanni Willenbrock,Yutaka Shimizu,J. Carlos Villaescusa,Helder André,Erik Sundstrӧm,Aparna Bhaduri,Arnold Kriegstein,Anders Kvanta,Gioele La Manno,Fredrik Lanner
Stem Cell Reports Published:JUNE 14, 2022
DOI:https://doi.org/10.1016/j.stemcr.2022.05.005
Summary
Human embryonic stem cell-derived retinal pigment epithelial cells (hESC-RPE) are a promising cell source to treat age-related macular degeneration (AMD). Despite several ongoing clinical studies, a detailed mapping of transient cellular states during in vitro differentiation has not been performed. Here, we conduct single-cell transcriptomic profiling of an hESC-RPE differentiation protocol that has been developed for clinical use. Differentiation progressed through a culture diversification recapitulating early embryonic development, whereby cells rapidly acquired a rostral embryo patterning signature before converging toward the RPE lineage. At intermediate steps, we identified and examined the potency of an NCAM1+ retinal progenitor population and showed the ability of the protocol to suppress non-RPE fates. We demonstrated that the method produces a pure RPE pool capable of maturing further after subretinal transplantation in a large-eyed animal model. Our evaluation of hESC-RPE differentiation supports the development of safe and efficient pluripotent stem cell-based therapies for AMD.