ヒトロタウイルスの病原性発現機構解明に大きく前進 ~新規ワクチン開発、治療薬開発を加速~
2019-02-12 藤田医科大学,北里大学,日本医療研究開発機構
ポイント
- ヒトロタウイルスの人工合成に世界で初めて成功しました。
- ロタウイルス遺伝子のみで人工合成が可能で、ロタウイルス以外の遺伝子産物を必要としません。
- 自然なヒトロタウイルスの感染、増殖の機構を再現できるので、ヒトに対する安全性に優れた次世代ワクチンや治療薬開発への応用が期待されます。
概要
藤田医科大学の河本聡志講師、福田佐織研究補助員、谷口孝喜名誉教授、村田貴之教授らの研究グループは、北里大学の小山ちとせ研究員、片山和彦教授との共同研究により、ヒトロタウイルスの人工合成に世界で初めて成功しました。この研究成果は、自然なヒトロタウイルスの感染および増殖機構を再現できるので、病原性発現機構の解明、ヒトに対する安全性に優れた次世代ワクチンや治療薬開発の加速が期待できます。
背景
近年、ウイルスの遺伝情報を解読して、その核酸配列情報を元に、試験管内でウイルス遺伝子を大量に人工合成できるようになりました。試験管内で合成したウイルス遺伝子を細胞に導入して、感染性ウイルスを人工合成する技術を“リバースジェネティクス”と言います。リバースジェネティクスが可能になると、ウイルスが何故病気を起こすのか、ウイルスの増殖を止めるにはウイルスの何処を狙って薬を作れば良いのかを、ウイルス遺伝子を直接操作して研究できるようになり、ワクチンや治療薬の開発を一気に加速することができます。C型肝炎ウイルスやインフルエンザウイルスの治療薬は、このようにして作り出されたのです。
乳幼児に重篤な下痢症を引き起こすロタウイルスは、安全なワクチンや治療薬の開発のため、リバースジェネティクスの構築が切望されてきました。しかし、ロタウイルスのリバースジェネティクス構築は困難を極めました。なぜなら、ロタウイルスはウイルス内部に11本もの遺伝子断片を持つため、人工合成した11種類の遺伝子すべてを、同時に一つの細胞のなかに導入しなければならなかったからです。
2017年に、増殖能力が飛びぬけて良いサルロタウイルスを用いて、最初のリバースジェネティクスが開発されました。しかし、このシステムでは、動物ウイルス由来のFASTタンパク質※1と牛痘(ワクシニアウイルス)※2由来の酵素などを発現する別の遺伝子を同時に細胞に導入してロタウイルスの複製を助ける必要があり、純粋にサルロタウイルスの遺伝子のみではシステムが動かなかったのです(図1)。また、ヒトロタウイルスの試験管内実験系での増殖能力は、サルロタウイルスの~1/100程度であり、このシステムを利用しても上手くいきませんでした。
ヒトロタウイルスは、病原性、レセプターおよび増殖して細胞から出てきた新生ウイルスに感染力を持たせるための前処理条件などが、サルや他の動物ロタウイルスとは異なります。ヒトロタウイルスを正しく理解し、ヒトロタウイルスのワクチンや治療薬を開発するためには、動物のロタウイルスではなく、ヒトロタウイルスのリバースジェネティクスが必須なのです。
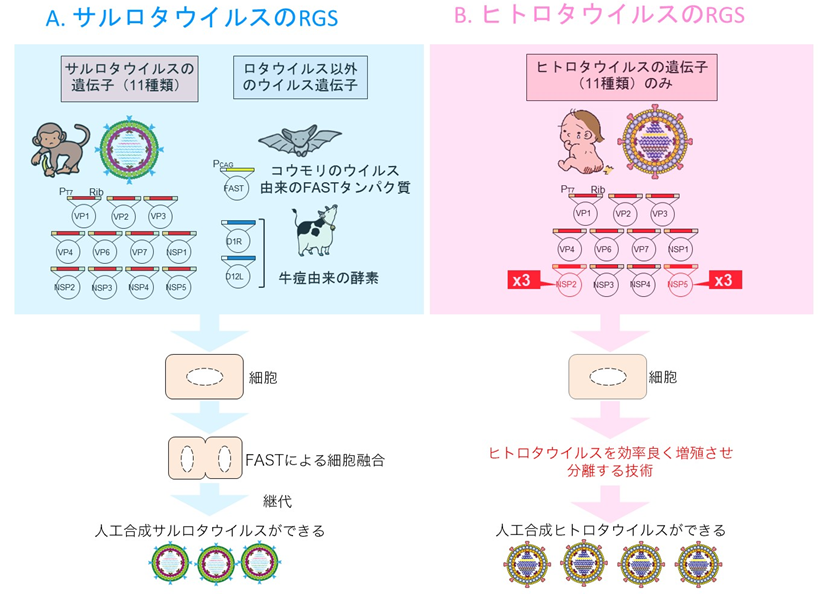
図1:従来のサルロタウイルスのリバースジェネティクス(A)は、サルロタウイルスを遺伝子操作するシステム。ヒトロタウイルスの研究をするには、ヒトロタウイルスの遺伝子を入れる必要がある。さらに、コウモリウイルスのFASTタンパク質や、牛痘由来の酵素を取り除き、人工合成サルロタウイルスを精製する必要がある。ヒトロタウイルスのリバースジェネティクス(B)は、ヒトロタウイルス遺伝子以外は含まれないので、安心。ヒトロタウイルス遺伝子を直接操作して、ワクチンに適した人工合成ウイルスを作り出したり、病原因子の位置を調べて、それを抑える薬の開発ができる。
研究成果
本研究グループは2018年に、動物ロタウイルスの11本の遺伝子のうち、2種類の遺伝子(非構造タンパク質NSP2とNSP5)を他の9本の遺伝子の3倍量にして細胞に導入することで、従来の~1,000倍も効率良く、ロタウイルスを人工合成できることを見出しました(Komoto et al. J Virol 92:e00588-18)。そこで、本研究で、ヒトロタウイルスの11本の遺伝子のうち、NSP2とNSP5遺伝子を他の9本の遺伝子の3倍量にして、さらに、ロタウイルス胃腸炎患者便中のウイルスを効率良く分離する技術(高濃度のトリプシン添加と回転培養)を利用することで、ヒトロタウイルスを人工合成することに成功しました(図1)。
本研究成果の意義
この研究成果により、世界で初めてヒトロタウイルスの遺伝子を自由自在に改変することが可能となりました。さらに、本研究グループの構築したヒトロタウイルスのリバースジェネティクスは、ロタウイルスの遺伝子のみで稼働し、ロタウイルス以外の遺伝子産物を必要としません。自然なヒトロタウイルスの感染、増殖、病原性発現の機構を再現して研究できるので、ヒトに対する安全性に優れた次世代ロタウイルスワクチンや治療薬の開発が飛躍的に進むものと期待できます(図2)。
図2:(上)ヒトロタウイルスの遺伝子を取り出して、弱毒化したり、感染力を低くする変異を加える。または、新規流行株と同じ遺伝子に改変する。リバースジェネティクス(RGS)でヒトロタウイルス変異株を造り、ワクチンや抗ウイルス薬の開発に利用する。
(下)サルロタウイルスにヒトロタウイルスの編集した遺伝子を入れ、RGSでヒトロタウイルスの遺伝子を持つサル・ヒトのキメラウイルスを造り、その性状の変化をサルの細胞などで研究する。変化が観察されたら、サル・ヒトのキメラウイルスをヒトに効率良く感染可能なキメラウイルスに作り直し、ヒト細胞で検証する。
本研究は、藤田医科大学の河本聡志講師、福田佐織研究補助員、谷口孝喜名誉教授、村田貴之教授らの研究グループが、北里大学北里生命科学研究所の小山ちとせ研究員、片山和彦教授との共同で行ったものです。
本研究成果は、2019年2月6日(米国東部時間)発行の「Journal of Virology 電子版」に掲載されました。
論文情報
- 論文タイトル:
- Generation of infectious recombinant human rotaviruses from just 11 cloned cDNAs encoding the rotavirus genome
- 著者:
- Satoshi Komotoa, Saori Fukudaa, Masanori Kugitaa, Riona Hatazawaa, Chitose Koyamab, Kazuhiko Katayamab, Takayuki Murataa, Koki Taniguchia
- Department of Virology and Parasitology, Fujita Health University School of Medicine, Toyoake, Aichi, Japana; Laboratory of Viral Infection I, Kitasato Institute for Life Sciences, Graduate School of Infection Control Sciences, Minato-ku, Tokyo, Japanb
研究支援
※本成果は、以下の研究課題によって得られました。
国立研究開発法人 日本医療研究開発機構
新興・再興感染症に対する革新的医薬品等開発推進研究事業
研究開発課題名:下痢症ウイルスの病原性発現機構の解明及び新規治療薬・ワクチン等の開発に向けた研究
研究開発代表者:染谷 雄一
研究開発期間:平成29年4月~平成32年3月
新興・再興感染症に対する革新的医薬品等開発推進研究事業
研究開発課題名:培養細胞感染系が確立されていない病原体の新たな感染複製系等の開発とそれを用いた診断・治療・予防法の開発に向けた研究
研究開発代表者:石井 孝司
研究開発期間:平成28年4月~平成31年3月
また本研究は、日本学術振興会科学研究費からの支援も受けています。
引用文献
Komoto S, Fukuda S, Ide T, Ito N, Sugiyama M, Yoshikawa T, Murata T, Taniguchi K. Generation of recombinant rotaviruses expressing fluorescent proteins by using an optimized reverse genetics system. 2018. J Virol. 92(13):e00588-18.
用語解説
- ※1 FASTタンパク質
- ヒトに病原性を示すコウモリレオウイルスに由来する細胞融合性タンパク質。
- ※2 牛痘
- 牛痘ウイルス(ワクシニアウイルス)感染を原因とする感染症。種々の動物を宿主とする。ヒトでは症状は軽い。
お問い合わせ先
内容に関するお問い合わせ先
藤田医科大学 医学部ウイルス・寄生虫学
講師 河本 聡志(コウモト サトシ)
北里大学 北里生命科学研究所・ウイルス感染制御学I
北里大学大学院感染制御科学府・ワクチン学研究室
教授 片山 和彦(カタヤマ カズヒコ)
報道に関するお問い合わせ先
学校法人藤田学園 広報部 学園広報課
学校法人北里研究所 総務部広報課
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構
戦略推進部 感染症研究課


