2022-08-18 理化学研究所,シンシナティ小児病院
理化学研究所(理研)生命機能科学研究センター呼吸器形成研究チームの岸本圭史研究員、森本充チームリーダー、シンシナティ小児病院の岩澤堅太郎研究員、武部貴則准教授、アーロン・ゾーン教授らの国際共同研究チームは、ヒト幹細胞(ES細胞/iPS細胞[1])から臓器固有の間充織[2]細胞を誘導する詳細な手法を報告しました。
本手法により作製できる臓器間充織細胞は、ヒト臓器発生の仕組みを解析するツールとして有用であるとともに、培養皿上でのヒト臓器の再建に向けた技術革新に貢献すると期待できます。
国際共同研究チームはこれまで、正常発生において呼吸器や消化管の臓器間充織が分化する仕組みを明らかにし、これらの過程をヒトES/iPS細胞を用いて再現することで、種々の臓器間充織細胞を作製してきました。本研究ではさらに、胃と食道の間充織細胞を区別して作製する手法を確立するとともに、これらの手法の詳細についてまとめ、ヒト幹細胞を扱う一定の経験があれば誰でも追試可能な手順書(プロトコール)として発表しました。
本研究は、科学雑誌『Nature Protocols』オンライン版(8月17日付)に掲載されました。
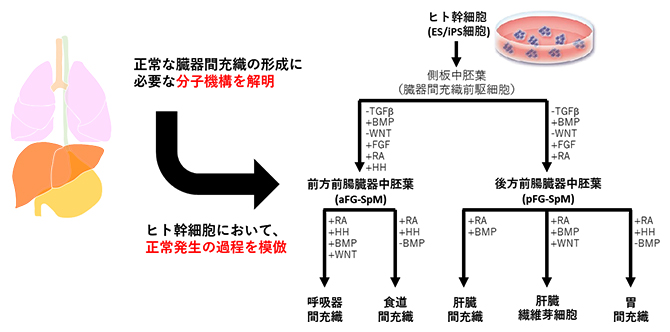
ヒト幹細胞から臓器の間充織細胞への分化誘導条件の確立
背景
近年の幹細胞研究および発生生物学研究の発展を背景に、さまざまな臓器に類似した3次元構造(オルガノイド[3])を培養皿上で作製することが可能になってきました。臓器は、外環境とのインターフェイスになる薄い上皮[4]組織と、その裏打ち構造となる間充織によって構成されます。また、発生過程において臓器が正しく機能的な構造へと成長するには、上皮組織と間充織が互いに作用し合うことが必要です。その分子メカニズムとしてヘッジホッグ(HH)[5]、BMP[5]、WNT[5]など細胞が分泌する成長因子[5]によるシグナル伝達の関与が知られています。
しかし、これまでの多くの研究は上皮組織にのみ焦点を当てており、間充織の発生はあまり注視されてきませんでした。このことが、多様な細胞種からなる臓器構造を培養皿上で再構築するための、大きな障害の一つでした。
国際共同研究チームは先行研究において、マウス胎児を用いた1細胞RNA解析(scRNAseq)[6]や遺伝学的手法により、食道・呼吸器・肝臓・胃をはじめとした前腸[7]由来の臓器が形成される初期のメカニズムを明らかにしてきました注1、2)。また、これらの知見を基に、ヒト幹細胞から臓器固有の間充織細胞を作製することにも成功しています。しかしこれらの報告では、実験方法については簡易な記載にとどめているため、他の研究者が再現性よく実験を行うためには、実験過程の詳しいノウハウや注意点などをより詳細に記載する必要がありました。
そこで本研究では、これらの手法をさらに発展させ、より効率的に臓器間充織を誘導する実験手法を確立するとともに、その解析方法を全て公開しました。
注1)2020年8月27日プレスリリース「呼吸器の発生をつかさどるメカニズムの解明」
注2)Lu Han et.al. Single cell transcriptomics identifies a signaling network coordinating endoderm and mesoderm diversification during foregut organogenesis. Nature Communications (2020) DOI: 10.1038/s41467-020-17968-x
研究手法と成果
前腸に由来する臓器の間充織細胞は、側板中胚葉[8]と呼ばれる前駆細胞を起源とします。そこでまず、既報注3)に従ってヒト幹細胞(ES/iPS細胞)から側板中胚葉を誘導することから始めました。次に、側板中胚葉から心臓・呼吸器・食道・胃・肝臓といった多様な臓器の間充織細胞を作り分けるためには、それぞれの臓器間充織への分化に必要な成長因子群を特定する必要がありました。上述の1細胞RNA解析の結果から、臓器が形成される初期段階では、心臓以外の前腸由来臓器ではレチノイン酸(RA)[5]シグナルが活性化していること、肝臓と心臓以外の臓器ではRAシグナルとHHシグナルが活性化していることが分かりました。そこで、既存の手法に加えてRA、あるいはRAとHH活性化剤を培養液に添加することで、臓器間充織細胞の前駆間充織細胞である臓器中胚葉の亜種を作製することに成功し、それぞれ「後方前腸臓器中胚葉(pFG-SpM)」と「前方前腸臓器中胚葉(aFG-SpM)」と名付けました(冒頭のまとめ図参照)。pFG-SpMは肝臓と胃の間充織細胞に、aFG-SpMは呼吸器と食道の間充織細胞になりやすい性質を持っていました。
次に、臓器固有の間充織細胞を誘導するためのシグナル経路を、マウス胎児を用いた1細胞RNA解析から推定し、これらのシグナルを制御する成長因子や化合物を培養液に添加する濃度やタイミングを検討しました。その結果、pFG-SpMにRA/BMPシグナルを活性化させると肝臓の間充織細胞が誘導されることや、RA/BMP/WNTシグナルを活性化すると肝臓線維芽細胞が誘導されることが分かりました(図1a、b)。一方、pFG-SpMのRA/HHシグナルを活性化しつつBMPシグナルを不活性化すると、胃の間充織細胞が形成されることが分かりました(図1c)。興味深いことに、同様の誘導をaFG-SpMに施すと、食道の間充織細胞が誘導されました(図1e)。さらに、aFG-SpMにおいてRA/HH/BMP/WNTシグナルを活性化することで、呼吸器の間充織細胞が誘導されました(図1d)。
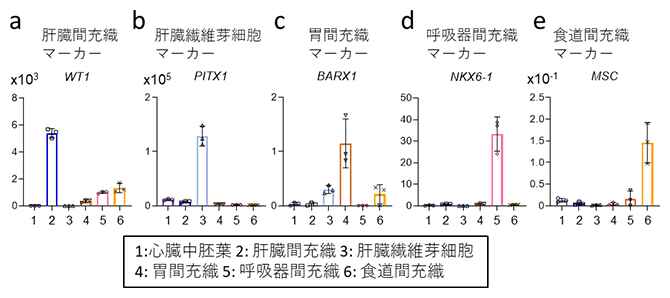
図1 ヒトES細胞から誘導した各種臓器間充織のマーカー遺伝子発現
横軸は、分化細胞に混在している可能性のある細胞種(1~6)を示す。臓器間充織マーカーの発現量(縦軸)はいずれも、培養7日目における定量PCRの測定値を示す。
a~c後方前腸臓器中胚葉(pFG-SpM)から分化させた臓器間充織。RA/BMPシグナルを活性化させると肝臓間充織マーカー遺伝子(WT1)が発現し(a)、RA/BMP/WNTシグナルを活性化すると肝臓線維芽細胞マーカー遺伝子(PITX1)が発現した(b)。RA/HHシグナルを活性化しつつBMPシグナルを不活性化すると、胃間充織マーカー遺伝子(BARX1)が発現した(c)。
d、e前方前腸臓器中胚葉(aFG-SpM)から分化させた臓器間充織。RA/HH/BMP/WNTシグナルを活性化すると呼吸器間充織マーカー遺伝子(NKX6-1)が発現し(d)、RA/HHシグナルを活性化しつつBMPシグナルを不活性化すると、食道間充織マーカー遺伝子(MSC)が発現した(e)。
それぞれの細胞の分化効率を定量解析した結果、高効率に各種間充織細胞が誘導されていること(肝臓間充織細胞:50~90%、肝臓線維芽細胞:60~75%、胃・呼吸器・食道間充織細胞:約30%)が分かりました(図2)。これらの結果から、正常な臓器発生の生体環境を培養皿上で模倣することで、ヒト幹細胞から肝臓、胃、食道および呼吸器の間充織細胞を誘導できることが示されました。
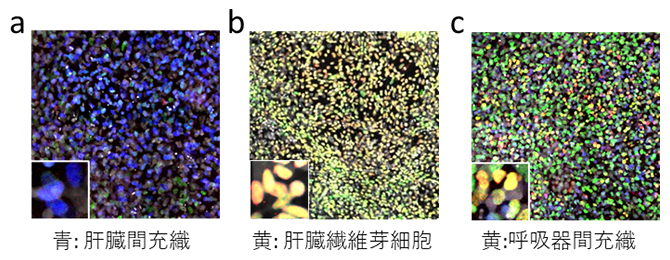
図2 ヒトES細胞から分化した臓器間充織細胞の例
a)ヒトES細胞から分化した肝臓間充織細胞。培養7日目のマーカー遺伝子の発現(WT1:青色)を示す。
b)ヒトES細胞から分化した肝臓繊維芽細胞。培養7日目のマーカー遺伝子の発現(PITX1:黄色、TBX5:緑色)を示す。
c)ヒトES細胞から分化した呼吸器間充織細胞。培養7日目のマーカー遺伝子の発現(NKX6-1:黄色、FOXF1:緑色)を示す。
さらに、今回確立した分化誘導方法と、既報の手法注1、2、4、5)を直接的に比較し、作製した臓器間充織細胞の特性を検証しました。その結果、今回の手法で作製された呼吸器間充織細胞は、特に背側の性質が強いことが分かりました。呼吸器は1本の管腔として形成されますが、平滑筋や軟骨の配置は背側と腹側で異なっています。すなわち、異なる手法を使い分けることで、異なる性質(背側と腹側)を持った呼吸器間充織細胞を作製できるといえます。同様に、肝臓の間充織細胞についても既報の手法注4、5)と比較検討したところ、今回作製した肝臓間充織細胞は、より広範な肝臓間充織マーカーを発現することから、生体の肝臓間充織細胞により近い性質を持つことが分かりました。
注3)Loh et al., Mapping the Pairwise Choices Leading from Pluripotency to Human Bone, Heart, and Other Mesoderm Cell Types. Cell (2016) DOI: 10.1016/j.cell.2016.06.011
注4)Takebe et al., Massive and Reproducible Production of Liver Buds Entirely from Human Pluripotent Stem Cells. Cell Reports (2017) DOI: 10.1016/j.celrep.2017.11.005
注5)Coll et al., Generation of Hepatic Stellate Cells from Human Pluripotent Stem Cells Enables In Vitro Modeling of Liver Fibrosis. Cell Stem Cell (2018) DOI: 10.1016/j.stem.2018.05.027
今後の期待
これまでの臓器発生研究の多くは上皮組織に焦点が当てられ、臓器間充織細胞が分化・多様化する仕組みはあまり分かっていませんでした。今回報告した臓器固有の間充織細胞を作製する手法は、ヒト間充織発生の仕組みを解析するための新しいin vitro(試験管内)モデルとしての利用が期待できます。
さらに近年、気管間充織の形成異常に起因する先天性呼吸器疾患の原因遺伝子の候補が見つかりつつあります。本手法を疾患患者由来のiPS細胞に対して適用することによって、遺伝子変異と間充織細胞分化の関係の解明や、病態の理解につながる可能性があります。
また、既存の手法により作製された臓器オルガノイドの多くは上皮組織に偏った構造をしています。国際共同研究チームは、これらのオルガノイドと本手法で作製した間充織組織を融合することによって、高次的な構造を持った、より生体の臓器に近い構造体を作出することに挑戦しています。
補足説明
1.ES細胞、iPS細胞
動物の初期胚が持つ、体を構成する全ての種類の体細胞へ分化する能力を多能性という。多能性を持ち、試験管内で培養して無限に増やすことができる細胞を多能性幹細胞という。ES細胞(胚性幹細胞)は、哺乳類の着床前胚(胚盤胞)に存在する内部細胞塊から作製された多能性幹細胞。iPS細胞(人工多能性幹細胞)は、皮膚や血液などから採取した細胞に少数の遺伝子などを導入して作製された多能性幹細胞。
2.間充織
中胚葉に由来する未熟な結合組織。器官形成の段階では、外胚葉や内胚葉由来の上皮組織と接していることが多い。
3.オルガノイド
幹細胞から人工的に作製した「ミニ臓器」。臓器形成の仕組みの解明や、臓器を標的とした創薬、再生医療への応用などが期待されている。
4.上皮
隙間なく敷き詰められた細胞が作るシート状の構造。体表や管腔の表面を覆って、さまざまな生理的機能を果たす。
5.ヘッジホッグ(HH)、BMP、WNT、成長因子、レチノイン酸(RA)
細胞培養や生体内において、一般的に細胞や組織の成長・増殖を刺激する活性を持つ物質を成長因子と呼ぶ。分化の制御などにも機能を発揮する。BMP、WNT、FGF、Activin、HHなどタンパク質性のものが多く、細胞膜上の受容体への結合を介して細胞内にシグナルを伝達する。一方、RAはビタミンAの誘導体であり、核内受容体に結合する。HHはhedgehog、BMPはBone morphogenetic protein、RA はRetinoic acidの略。WNTはショウジョウバエの遺伝子winglessとマウス乳がん遺伝子int-1に由来する。
6.1細胞RNA解析(scRNAseq)
1細胞中に含まれるRNAを、ハイスループットDNAシーケンサーを用いて配列決定し、網羅的かつ定量的にその量や種類を決定する方法。scRNAseqはSingle cell RNA sequenceの略。
7.前腸
呼吸器・食道・胃・肝臓・膵臓・十二指腸などの臓器のもととなる胎児期の構造。
8.側板中胚葉
心臓や呼吸器など多様な臓器の間充織や、四肢や血液の細胞のもととなる胎児期の構造。
国際共同研究チーム
理化学研究所 生命機能科学研究センター 呼吸器形成研究チーム
チームリーダー 森本 充(モリモト・ミツル)
研究員 岸本 圭史(キシモト・ケイシ)
シンシナティ小児病院(米国)
教授 アーロン・ゾーン(AaronMZorn)
准教授 武部 貴則(タケベ・タカノリ)
研究員 岩澤 堅太郎(イワサワ・ケンタロウ)
教授 ジェームズ・ウェルズ(JamesMWells)
研究員 ルー・ハン(LuHan)
大学院生 アリス・ソレル(AliceSorel)
大学院生 カルロス・フェラン-へレディア(CarlosFerran-Heredia)
研究支援
本研究の一部は、日本学術振興会(JSPS)科学研究費助成事業国際共同研究加速基金(国際共同研究強化(A))「気管及び食道オルガノイドの立体構造の作成基盤確立と間充織極性化機構の解明(研究代表者:岸本圭史)による支援を受けて行われました。
原論文情報
Keishi Kishimoto, Kentaro Iwasawa, Alice Sorel, Carlos Ferran-Heredia, Lu Han, Mitsuru Morimoto, James M Wells, Takanori Takebe and Aaron M Zorn, “Directed differentiation of human pluripotent stem cells into diverse organ-specific mesenchyme of the digestive and respiratory systems.”, Nature Protocols, 10.1038/s41596-022-00733-3
発表者
理化学研究所
生命機能科学研究センター 呼吸器形成研究チーム
チームリーダー 森本 充(モリモト・ミツル)
研究員 岸本 圭史(キシモト・ケイシ)
シンシナティ小児病院
教授 アーロン・ゾーン(Aaron M. Zorn)
准教授 武部 貴則(タケベ・タカノリ)
研究員 岩澤 堅太郎(イワサワ・ケンタロウ)
報道担当
理化学研究所 広報室 報道担当