2024-01-24 マックス・プランク研究所
◆Feuerbachらの研究では、HIVが細胞核への侵入を防ぐ核膜をくぐり抜ける仕組みが解明されました。核膜は核膜孔と呼ばれる微小な孔を通じて物質を通すが、その通行はimportinとexportinと呼ばれる分子トランスポータによって制御され、その中でもFG相と呼ばれる「スマートな」物質が役割を果たしている。しかし、HIVはこの制御をすり抜けるため、HIVキャプシド(カプセル)がimportinに似た表面を持つよう進化しており、これによって核膜孔を通り抜けることができることが判明しました。この発見は、HIVの感染メカニズムを理解し、将来的な治療法の開発に寄与する可能性があります。
<関連情報>
- https://www.mpg.de/21440718/0124-bich-how-hiv-smuggles-its-genetic-material-into-the-cell-nucleus-17216463-x
- https://www.nature.com/articles/s41586-023-06966-w
HIV-1カプシドは輸送受容体のように核膜孔のFG相に入る HIV-1 capsids enter the FG phase of nuclear pores like a transport receptor
Liran Fu,Erika N. Weiskopf,Onno Akkermans,Nicholas A. Swanson,Shiya Cheng,Thomas U. Schwartz & Dirk Görlich
Nature Published:24 January 2024
DOI:https://doi.org/10.1038/s41586-023-06966-w
Abstract
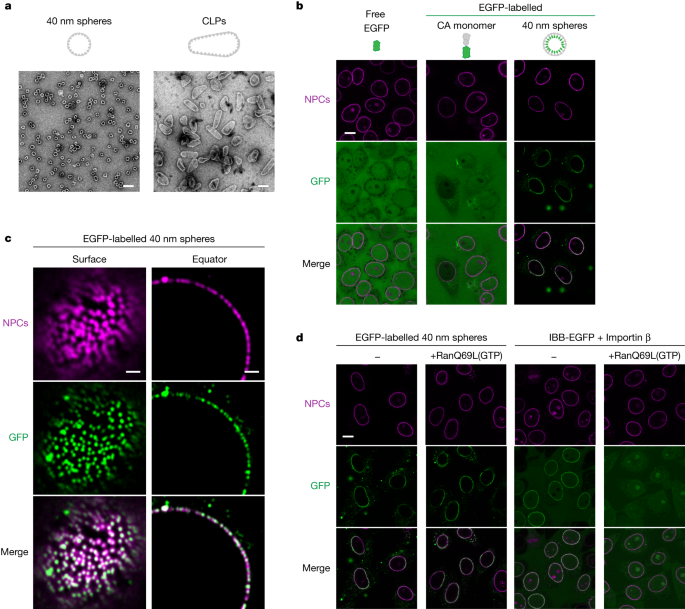
HIV-1 infection requires nuclear entry of the viral genome. Previous evidence suggests that this entry proceeds through nuclear pore complexes (NPCs), with the 120 × 60 nm capsid squeezing through an approximately 60-nm-wide central channel1 and crossing the permeability barrier of the NPC. This barrier can be described as an FG phase2 that is assembled from cohesively interacting phenylalanine–glycine (FG) repeats3 and is selectively permeable to cargo captured by nuclear transport receptors (NTRs). Here we show that HIV-1 capsid assemblies can target NPCs efficiently in an NTR-independent manner and bind directly to several types of FG repeats, including barrier-forming cohesive repeats. Like NTRs, the capsid readily partitions into an in vitro assembled cohesive FG phase that can serve as an NPC mimic and excludes much smaller inert probes such as mCherry. Indeed, entry of the capsid protein into such an FG phase is greatly enhanced by capsid assembly, which also allows the encapsulated clients to enter. Thus, our data indicate that the HIV-1 capsid behaves like an NTR, with its interior serving as a cargo container. Because capsid-coating with trans-acting NTRs would increase the diameter by 10 nm or more, we suggest that such a ‘self-translocating’ capsid undermines the size restrictions imposed by the NPC scaffold, thereby bypassing an otherwise effective barrier to viral infection.