2018-05-04京都大学iPS細胞研究所(CiRA),和歌山県立医科大学,国立研究開発法人 日本医療研究開発機構
ポイント
- 中條-西村症候群(Nakajo-Nishimura syndrome:NNS)注1)は、免疫プロテアソーム注2)遺伝子PSMB8の変異で起こる慢性炎症と脂肪・筋萎縮を特徴とする疾患で、そのメカニズムは詳しく知られておらず、未だ有効な治療法がない。
- PSMB8変異有無以外は遺伝背景をそろえたiPS/ES細胞をCRISPR/Cas9ゲノム編集技術注3)を用いて作製し、NNS患者さん由来iPS/ES細胞から作製した単球注4)系細胞を用いた解析によりNNSの病態再現に成功した。
- NNS患者さん由来iPS/ES細胞から作製した単球系細胞は、刺激前から過剰な活性酸素 注5)の産生が上昇しており、IFN-γ + TNF-α 刺激により、異常なJAK/STAT経路、p38MAPK経路の活性化や様々な生体応答反応経路が亢進していた。
- NNSを含めた免疫プロテアソーム異常症の病態解明、治療法開発につながる大きな一歩である。
1.要旨
京都大学iPS細胞研究所・齋藤潤准教授及び和歌山県立医科大学医学部・金澤伸雄准教授らの研究グループは、患者さん由来のiPS細胞とゲノム編集技術を用いて、NNSにおける免疫プロテアソーム活性の低下と異常な炎症反応の再現に成功しました。本研究は、京都大学と和歌山県立医科大学との共同研究により実施されました。
NNSは、乳幼児期に凍瘡様皮疹で発症し、繰り返す炎症と進行するやせ・消耗を主症状とする疾患です。NNSは、免疫プロテアソームβ5i をコードしているPSMB8遺伝子に異常があることが分かっています。NNSと類似の症状を呈する疾患として、海外においてもCANDLE症候群やJMP症候群が知られており、これらはプロテアソーム不全症として新たな疾患カテゴリーを形成し、プロテアソーム遺伝子と疾患を結びつける疾患群(プロテアソーム関連自己炎症疾患群)に分類されます。免疫プロテアソームの異常と病態形成の機序については、不明な点が多く、未だ有効な治療法が確立されていません。そこで、研究グループは、NNS患者さんからiPS細胞を作製し、NNS患者さん由来のiPS細胞のPSMB8遺伝子修復と健常ES細胞へのPSMB8変異遺伝子の導入を行い、PSMB8 (免疫プロテアソームβ5i )変異有無以外は遺伝的に均一なiPS/ES細胞を作製しました。それらのiPS/ES細胞を炎症に関わる細胞である単球細胞に分化させ、炎症反応の検討を行いました。感染などの際に体内で産生されるIFN-γ と TNF-α で刺激されたPSMB8変異単球細胞は、正常な単球細胞に比べて、免疫プロテアソームの機能が著しく低下しており、異常な炎症反応が起こっていて、これら異常な炎症反応は、抗酸化剤により減弱することも明らかにしました。以上の成果は、疾患特異的iPS/ES細胞技術はNNSを含めた免疫プロテアソーム異常症の病態解明、治療法開発に貢献することが期待されます。
この研究成果は、2018年5月3日(米国東部時間)に国際幹細胞学会(ISSCR)が発行する科学誌「Stem Cell Reports」にオンライン公開されます。
2.研究の背景
NNSは、子供の頃から発熱や赤い発疹などを繰り返す「自己炎症性疾患」の一種であり、徐々に顔や腕の脂肪が減ってやせていく疾患でもある厚生労働省の指定難病の一つです。1939年に東北帝国大学皮膚泌尿器科の中條敦先生、1950年に和歌山県立医科大学皮膚泌尿器科の西村長應先生が報告されたので、この名前が付けられました。長く日本だけの病気とされていましたが、最近、同じ病気と思われる患者さんが海外からも報告されています。この病気は、免疫プロテアソームβ5i をコードしているPSMB8遺伝子の変異により、生まれつき、プロテアソームという、体をつくる蛋白質の品質をチェックし粗悪品を分解処理するような酵素がうまく働かないことが原因と考えられています。この病気に対する決まった治療法はありません。発熱や発疹などに対してはステロイド剤の内服が有効ですが、脂肪筋肉の減少ややせには無効で、むしろ進行する全身の消耗とステロイドの副作用などによる弊害があることから、特異的で副作用の少ない治療法の開発が喫緊の課題です。また、これまで多くの研究がなされていますが、その発症のメカニズムはまだ十分には解明されておりません。
3.研究結果
1)遺伝的に背景をそろえたコントロールiPS細胞の作製
NNS患者由来iPS細胞(NNS1-1)へのPSMB8遺伝子修復と健常ES細胞(KhES-1)へのPSMB8変異遺伝子の導入を行い、PSMB8(免疫プロテアソームβ5i )変異有無以外は遺伝的に均一なiPS/ES細胞を作成しました。また、以前に我々の確立した分化誘導法によりiPS/ES細胞から単球系細胞への単球分化を行い、さらに熊本大学千住覚先生らが報告した遺伝子群を導入することにより、PSMB8変異有無の同一遺伝的iPS/ES細胞由来単球株を作製しました。これにより、iPS/ES細胞から分化するごとの実験的なばらつきを最小限に抑えることが可能となりました(図1)。
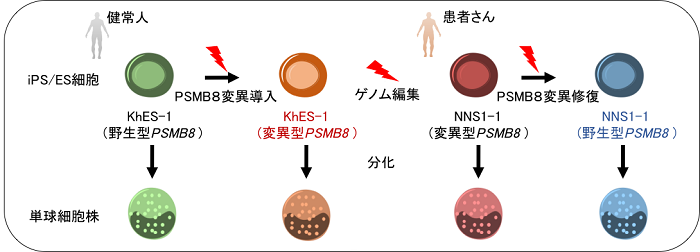
図1:患者さん由来iPS細胞とゲノム編集技術を用いた本研究のモデル図
2)変異型PSMB8単球は、免疫プロテアソームの機能欠損により、異常な炎症反応がおこっていて、それらは抗炎症効果をもつ薬剤によって抑えられた。
我々の作製したiPS/ES細胞由来単球株がNNS患者と同じ表現型を示すかについて検討したところ、変異型PSMB8単球細胞群(MT)は、IFN-γ + TNF-α 刺激により免疫プロテアソーム機能活性が野生型PSMB8単球細胞群(WT)に比べて減弱しており、また変異型PSMB8単球細胞群は、炎症性サイトカイン (IL-6)と炎症性ケモカイン(MCP-1、IP-10)産生が野生型PSMB8単球細胞群に比して顕著に亢進していました(図2)。これらの表現型は、NNS患者末梢血由来単球でも同様に認められたことから、我々は、iPS/ES細胞由来単球系細胞株を用いたNNSの病態再現に成功しており、創薬開発及び病態解析を実現するための技術的課題を克服していると言えます。そこで、次に我々は、NNS患者さん由来単球細胞で見られる異常な炎症反応を抑えるために、様々な抗炎症作用を持つ化合物の効果を調べました。変異型PSMB8細胞は、JAK阻害薬、MAPK阻害薬、抗酸化剤の投与により、IFN-γ + TNF-α 刺激により過剰に産生されていた炎症性サイトカインやケモカインが抑えられました(図3)。その効果は、各シグナルの病態への寄与や相互作用を示唆するとともに、新たな薬剤スクリーニングに有用であることが示されました。
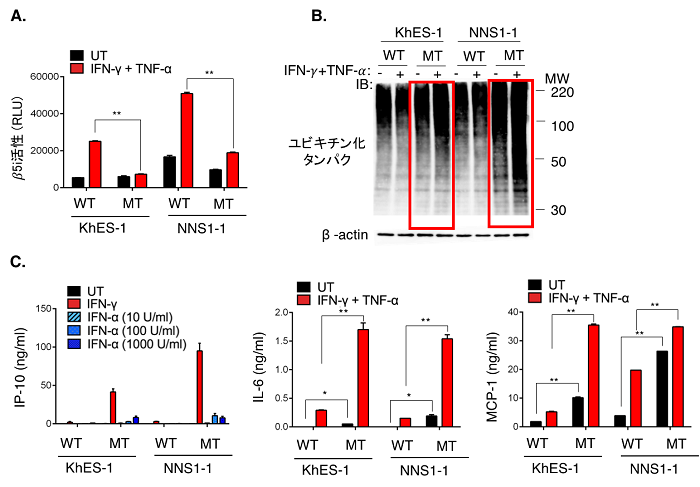
図2:患者さん由来iPS細胞から作製した単球でのプロテアソームの活性化、ユビキチン化タンパク質の蓄積と炎症性サイトカインの産生
A. 免疫プロテアソーム活性化の比較。IFN-γ + TNF-α 刺激により変異型PSMB8単球細胞群(MT)では、野生型PSMB8単球細胞群(WT)に比べて免疫プロテアソームの活性化が低くなっている。
B. ユビキチン化タンパク質の蓄積の検討。IFN-γ + TNF-α 刺激により、変異型PSMB8単球細胞群では、野生型PSMB8単球細胞群に比べてユビキチン化タンパク質の蓄積が見られる。
C. 炎症性サイトカイン産生を比較。IFN-γ + TNF-α 刺激により、変異型PSMB8単球細胞群では、野生型PSMB8単球細胞群に比べて炎症性サイトカインIL-6や炎症性ケモカインIP-10やMCP-1の産生が高くなっている。
t-test * P<0.05, ** P<0.01
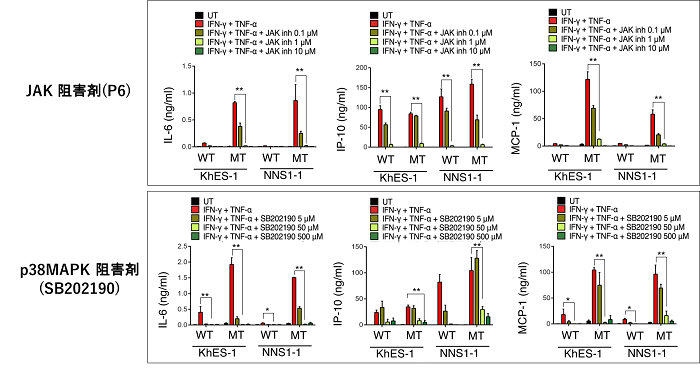
図3:抗炎症作用を持つ化合物の効果の検討
JAK阻害剤(P6)とMAPK阻害剤(SB202190)を単球に投与すると、濃度依存的にIL-6、MCP-1、IP-10産生が抑制された。 t-test * P<0.05, ** P<0.01
3)PSMB8遺伝子変異iPS細胞由来単球細胞は、刺激を加える前から、過剰な活性酸素産生があり、プライミング状態にあることが明らかになった。
変異型PSMB8単球は刺激する前の定常状態ですでに、細胞内の活性酸素が過剰で、STAT1、p38MAPKのリン酸化が野生型PSMB8に比べて高く、STAT1は、構成的な発現も高く、炎症の準備段階の状態にあることがわかりました。さらに、刺激前に抗酸化剤を投与しておくと、定常状態でのSTAT1のリン酸化が抑えられたので、活性酸素がNNSの単球における異常な炎症反応を起こす重要な役割をしていることがわかりました。
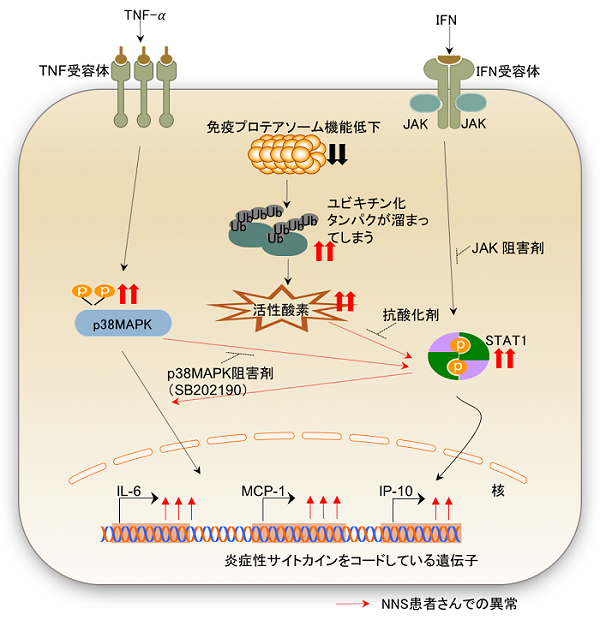
図4:本研究のまとめ
4.まとめ
本研究は、患者さん由来のiPS細胞を用いてNNSの疾患モデルを構築し、異常な炎症を引き起こすメカニズムの一端を明らかにしました。この成果により、NNSを含めた免疫プロテアソーム異常症の病態解明、治療法開発が一層進むことが期待されます。
5.論文名と著者
- 論文名
- “Pluripotent stem cell model of Nakajo-Nishimura syndrome untangles proinflammatory pathways mediated by oxidative stress.”
- ジャーナル名
- Stem Cell Reports
- 著者
- Fumiko Honda-Ozaki1*, Madoka Terashima1*, Akira Niwa1, Norikazu Saiki1, Yuri Kawasaki1, Haruna Ito1, Akitsu Hotta2, Ayako Nagahashi3, Koichi Igura3, Isao Asaka3, Hongmei Lisa Li2 4, Masakatsu Yanagimachi 5, Fukumi Furukawa6, Nobuo Kanazawa6**, Tatsutoshi Nakahata1, and Megumu K. Saito1** * 筆頭著者
** 責任著者 - 著者の所属機関
- 1. 京都大学 iPS細胞研究所 臨床応用研究部門
2. 京都大学 iPS細胞研究所 未来生命科学開拓部門
3. 京都大学 iPS細胞研究所 基盤技術研究部門
4. ボストン小児病院
5. 東京医科歯科大学小児科 発生発達病態学分野
6. 和歌山県立医科大学 医学部 皮膚科学講座
6.本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本医療研究開発機構(AMED)難治性疾患実用化研究事業「自己炎症性症候群Blau症候群と中條西村症候群の病態解析と新規治療標的探索」、再生医療実現拠点ネットワークプログラム 疾患特異的iPS細胞を活用した難病研究「難治性血液・免疫疾患由来の疾患特異的iPS細胞の樹立と新規治療法開発」
- 日本学術振興会
- 和歌山県立医科大学
7.用語説明
- 注1)中條-西村症候群(Nakajo-Nishimura syndrome:NNS):
- 慢性反復性の炎症と進行性のやせ・消耗を特徴とする、特異な自己炎症疾患の一種であり、常染色体劣性遺伝性である。1939年の中條、1950年の西村らの報告以来、「凍瘡を合併する骨骨膜症」などの病名で、和歌山・泉南を中心とした関西と関東・東北から、これまでに30例ほどの報告がある。
- 注2)免疫プロテアソーム:
- プロテアソームは不要なタンパク質をユビキチン化して選択的に分解するタンパク質分解酵素複合体である。誘導型の免疫プロテアソームは、免疫細胞において恒常的に発現し、また、IFN- やTNF-のような刺激によってその他の体細胞にも誘導されることが報告されている。
- 注3)ゲノム編集技術:
- 細胞内の遺伝子を切り貼りして編集する技術。CRISPR-Cas9システムなど、いくつかの方法がある。
- 注4)単球:
- 単球は、 白血球の成分の一種であり、白血球の3~8%を占め、感染に対する防衛の開始に重要な細胞である。細菌などの異物を細胞内に取り込み、消化し、異物の一部を細胞表面に提示する。
- 注5)活性酸素:
- 大気中に含まれる通常の酸素が、より化学反応を起こしやすい形に変化した分子の総称である。
体内で過剰に発生した活性酸素は炎症を引き起こし、さまざまな病気に結びつく。
お問い合わせ先
本件担当
京都大学iPS細胞研究所(CiRA)国際広報室
和田濵
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構
戦略推進部 難病研究課