立体構造からMILL2の分子機能を見出し、生理機能解明に道を拓く
2018-11-01 北海道大学,昭和薬科大学,日本医療研究開発機構
ポイント
- げっ歯類などのゲノムにコードされる非古典的MHC-I分子、MILL2の立体構造を解明。
- MILL2のα3ドメイン側面に他の非古典的MHC-I分子群にはない塩基性パッチを発見。
- MILL2が塩基性パッチを介して線維芽細胞表面のヘパラン硫酸に結合することを明らかに。
概要
北海道大学大学院薬学研究院の前仲勝実教授らの研究グループは、これまでその機能が解明されていなかったタンパク質分子MILL2のX線結晶構造解析を行い、分解能2.15Å(1Åは0.1ナノメートル)という高精度での立体構造の解明に成功しました。
2002年に発見されたMILLファミリーは、げっ歯類(ネズミなど)のゲノムにコードされる非古典的な主要組織適合遺伝子複合体クラスI(MHC-I)*1分子で、MILL1とMILL2の2種類があります。非古典的MHC-I分子群*2は、適応免疫の鍵となる抗原提示を担う古典的MHC-I分子によく似た分子構造を持っていますが、それらの機能は抗原提示にとどまらず、特殊な微生物抗原の提示、ナチュラルキラー細胞の活性調節、抗体の輸送、鉄輸送調節など、それぞれが幅広い生命現象の担い手となっています。MILLファミリーも何らかの重要な役割を担っていると推測されますが、その生理機能は明確ではありません。
本研究によりMILL2の構造を解析した結果、全体的な構造は古典的MHC-I分子を含む既知の非古典的MHC-I分子群とよく似ていましたが、α3ドメインの側面の構造が異なっており、その部分は他の非古典的MHC-I分子群には存在しない特異な塩基性パッチ*3を形成していることが見出されました。この塩基性パッチは、MILL2が線維芽(せんいが)細胞の表面に存在するヘパラン硫酸*4と結合するために必須であったことから、MILL2の分子機能は他の非古典的MHC-I分子群では例のない、ヘパラン硫酸との結合であることがわかりました。ヘパラン硫酸は細胞増殖や、炎症制御、傷の治癒などの様々な生理機能に深く関わる生体分子であり、本研究の成果はMILL2の生理機能解明への有力な手がかりとなります。
本研究は科学研究費補助金、日本学術振興会「頭脳循環を加速する若手研究者戦略的海外派遣プログラム」、日本医療研究開発機構(AMED)「創薬等ライフサイエンス研究支援基盤事業」、農業・食品産業技術総合研究機構生物系特定産業技術研究支援センター、武田科学振興財団などの助成を受けて実施されました。
なお、本研究成果は、2018年10月18日(木)公開のNature Communications誌に掲載されました。
背景
脊椎動物は、体内に侵入したウイルスなどの異物に由来するペプチド断片を、抗原ペプチドとしてT細胞に提示し、免疫を活性化するシステムを持っています。抗原提示と称されるこの免疫機能の鍵となっているのは、主要組織適合遺伝子複合体クラスI(MHC-I)という膜タンパク質です。MHC-I分子のα1-α2ドメインに形成された溝の中に抗原ペプチドがはまり込むように結合し、細胞表面に運ばれてT細胞に向けて提示されます。このようなMHC-I分子は後述する非古典的MHC-I分子群と区別して、古典的MHC-I分子と呼ばれています。
ヒトを含む哺乳類には、古典的MHC-I分子の重鎖と構造的に類似した分子群が数多く存在しており、これらを一括して非古典的MHC-I分子と呼んでいます。非古典的MHC-I分子群は、修飾された特殊なペプチドや糖脂質などの低分子を免疫細胞に提示してその活性を調節したり、抗体分子や鉄の輸送調節に関与したりするなど、抗原提示にとどまらない多様な生理機能を担っています。
2002年、研究グループの笠原正典教授(北海道大学大学院医学研究院分子病理学分野)は、げっ歯類(ネズミ等)のゲノム中に未知の非古典的MHC-I分子ファミリーを見出し、MILL(MHC class I-like located near the leukocyte receptor complex)と命名しました。これまでに知られている非古典的MHC-I分子群はどれも生体内で重要な役割を担っていることから、MILLファミリーに属するMILL1及びMILL2も、何らかの重要な生理機能を有するものと考えられましたが、これまでその解明には至っていませんでした。そこで前仲教授の研究グループは、X線結晶構造解析によってMILL2の立体構造を明らかにし、立体構造が含有する生物物理学的な情報を手がかりに生理機能を解明するため、本研究を実施しました。
研究手法
MILL2の立体構造を明らかにするために、組換えMILL2タンパク質を大腸菌での封入体として発現させ、軽鎖であるβ2ミクログロブリン(β2m)と共に巻き戻すことで、MILL2/β2m複合体を大量調製し、高度に精製して結晶化しました。得られた結晶について、高エネルギー加速器研究機構Photon factoryの高輝度X線を利用してX線回折データを取得し、MILL2の分子構造を2.15Åの分解能で決定しました。同時にX線小角散乱法により溶液構造を解析しました。さらに、標的細胞との結合活性を評価するとともに、リガンドのヘパラン硫酸を同定し、その結合様式を生化学的に解明しました。
研究成果
MILL2の全体構造は、これまでの非古典的MHC-I分子群と同様に、古典的MHC-I分子のそれとよく似ていました。しかし、α1-α2ドメイン間の溝は古典的MHC-I分子に比較して狭く、MILL2にはペプチド等の提示機能はないと推定されました(図1)。その一方、結晶中には古典的MHC-I分子とは大きく異なるもうひとつのMILL2構造も見出されました。それは古典的MHC-I分子のようにα1-α2ドメインがα3-β2mドメインに結合している「閉じた構造」ではなく、α1-α2ドメインがα3-β2mドメインから大きく離れた「開いた構造」と呼ぶべきものでした(図2 A)。このような「開いた構造」は、β2mと結合するタイプのMHC-I分子群では今までに報告されたことがない特殊なものです。「開いた構造」と「閉じた構造」が結晶中に混在していることから、MILL2のα1-α2ドメインのα3-β2mドメインに対する結合力が弱く、両方の構造を柔軟に行き来できるのではないかと推測されました。X線小角散乱法により溶液中では主に「閉じた構造」となっていることがわかりました。また、すでに立体構造が明らかになっている全てのMHC-I分子群がα3ドメインの側部にループ構造を有するのに対し、MILL2ではループに相当する部分がβストランド構造となっていました(図2 B)。そして、その領域には塩基性アミノ酸が集中している塩基性パッチが見られました(図2 C)。塩基性パッチは正電荷を持つことから、負電荷を有する生体分子との結合が予想され、実際にヘパラン硫酸がMILL2の結合分子として同定されました。MILL2は線維芽細胞に由来する培養細胞株NIH-3T3の表面に結合できますが、これはMILL2の塩基性パッチとNIH-3T3表面のヘパラン硫酸との相互作用によることがわかりました。また、ヘパラン硫酸と結合したMILL2はβ2mと乖離することから、ヘパラン硫酸との結合に伴い、「閉じた構造」から「開いた構造」になることが示唆されました。
今後への期待
本研究ではMILL2の立体構造の解明を基に、MILL2がヘパラン硫酸に結合する非古典的MHC-I分子であることを見出しました。これまでに報告された非古典的MHC-I分子群にはヘパラン硫酸と結合するものはなく、MILL2に特異的な分子機能です。ヘパラン硫酸は生体内ではヘパラン硫酸プロテオグリカンとして線維芽細胞や上皮細胞表面、細胞外マトリックスなどに存在します。そして細胞増殖や、炎症制御、傷の治癒などに関わっていることから、MILL2はこれらを調節するような生理機能を有している可能性があります。
本成果を足がかりに、非古典的MHC-I分子によるヘパラン硫酸への結合が生み出す新しい生体システムが発見される可能性が期待されます。また、MILLファミリーは我々ヒトのゲノム中には存在が確認されていないことから、ヒトには同様の機能を持つ別の分子が存在する可能性があります。
AMED事業
- 事業名:創薬等ライフサイエンス研究支援基盤事業
- 課題名:化合物ライブラリーを基盤とした北のアカデミア発創薬の加速(2017~2021年度(予定))
- 代表機関名:北海道大学
論文情報
- 論文名
- Structure of MHC class I-like MILL2 reveals heparan-sulfate binding and interdomain flexibility(MHCクラスI様分子MILL2の構造はヘパラン硫酸への結合とドメイン間の柔軟性を明らかにした)
- 著者名
- 梶川瑞穂1、2、尾瀬農之3、福永裕子2、岡部由紀2、3、松本直樹4、米澤健人5、清水伸隆5、Simon Kollnberger6、笠原正典7、前仲勝実2、3(1昭和薬科大学微生物学研究室、2九州大学生体防御医学研究所、3北海道大学大学院薬学研究院生体分子機能学研究室、4東京大学大学院新領域創成科学研究科、5高エネルギー加速器研究機構放射光科学研究施設、6カーディフ大学、
- 7北海道大学大学院医学研究院分子病理学分野)
- 雑誌名
- Nature Communications(英国総合科学誌)
- DOI
- 10.1038/s41467-018-06797-8
- 公表日
- 2018年10月18日(木)(オンライン公開)
参考図
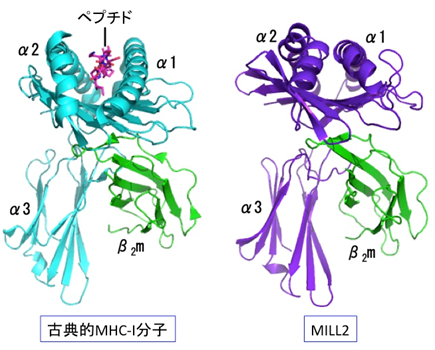
図1 一般的な古典的MHC-I分子とMILL2の全体構造の比較。(左)古典的MHC-I分子(HLA-B)の構造(PDB ID:1E27)。重鎖α1-α3がβ2mと複合体を形成し、α1-α2ドメインの間の溝に結合したペプチドを抗原提示する。図には示していないが、α3ドメインの下には細胞膜へと続く膜貫通領域部分が存在する。非古典的MHC-I分子群も古典的MHC-I分子とよく似た構造をとるが、構造の細部や性質が異なっており、それぞれ古典的MHC-Iとは異なる生理機能を獲得している。(右)本研究で明らかになったMILL2の構造。古典的MHC-I分子によく似ているが、α1-α2ドメイン間の溝は狭く、ペプチド等の低分子がはまり込めないと考えられる。
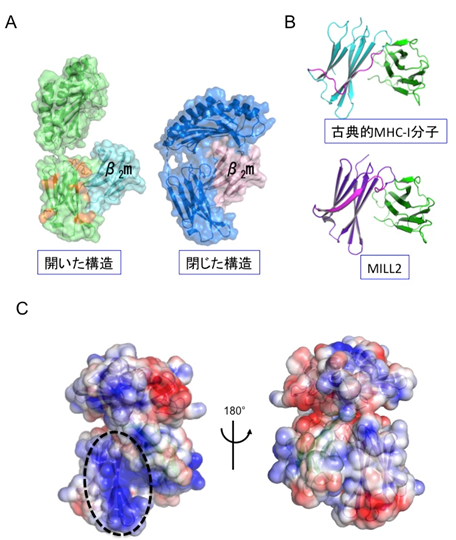
図2 MILL2の構造的特徴。(A)2種類のMILL2構造の比較。β2mと結合するタイプのMHC-Iはα1-α2ドメインがα3-β2mドメインに強固に結合して「閉じた構造」をとるが、MILL2の結晶中にはその閉じた構造の他に、α1-α2ドメインがα3-β2mドメインから離れている「開いた構造」が観察された。(B)α3-β2mドメインの比較。これまでに構造が明らかになっている古典的MHC-I分子及び非古典的MHC-I分子群のいずれも、α3ドメイン側面にはループ構造を有するが、MILL2ではβストランド構造になっている(図中のピンクで示した部分)。(C)MILL2の表面荷電を表す図。青色は塩基性アミノ酸による正電荷、赤色は酸性アミノ酸による負電荷のエリアを示す。MILL2特異的βストランド付近の領域は塩基性パッチ(点線囲み部分)となっており、ヘパラン硫酸との結合を担う領域であることが本研究によって明らかになった。
用語解説
- *1 主要組織適合遺伝子複合体クラスI(MHC-I)
- ほぼすべての有核細胞に発現し、細胞内で産生されたペプチドを結合して細胞表面に提示する膜タンパク質。免疫にとって重要な働きを担う。重鎖(α1~3ドメイン+膜貫通領域及び細胞内領域)にβ2ミクログロブリン(β2m)とペプチドが結合する。細胞表面に提示されたペプチドがウイルスなどの異物に由来する場合、これを感知したT細胞が獲得免疫系を活性化することから、MHC-Iは抗原提示の鍵分子である。非古典的MHC-I分子と区別して、古典的MHC-Iと呼ばれる。
- *2 非古典的MHC-I
- 抗原提示で機能する古典的MHC-I分子の重鎖と構造が似ている分子群。哺乳類で多数発見されており、その機能は免疫や抗原提示に限定されず多岐にわたり、いずれも生体内で重要な役割を担っている。
- *3 塩基性パッチ
- 塩基性のアミノ酸であるリジンやアルギニンが集中し、正電荷を持っているタンパク質表面領域。負電荷のタンパク質や生体内分子との相互作用を担う。
- *4 へパラン硫酸
- グリコサミノグリカンの一種で、ウロン酸(D-グルクロン酸あるいはL-イズロン酸)とD-グルコサミンによる二糖単位が数十回繰り返された直鎖状の多糖。硫酸基が含まれており、負電荷を有する。タンパク質がヘパラン硫酸修飾されたヘパラン硫酸プロテオグリカンとして動物組織内に広く分布し、細胞増殖や、炎症制御、傷の治癒などの様々な生理機能に関与している。
お問い合わせ先
北海道大学大学院薬学研究院
教授 前仲 勝実(まえなか かつみ)
AMED事業
日本医療研究開発機構(AMED)創薬戦略部医薬品研究課
配信元
北海道大学総務企画部広報課
昭和薬科大学総務課
日本医療研究開発機構(AMED)経営企画部企画・広報グループ