2021-03-06 分子科学研究所
ミントに含まれるメントールや、クスノキに含まれるカンファーという成分は、モノテルペン化合物と呼ばれ、精油やかゆみ止めなどに広く使われています。メントールは冷たい温度で活性化するTRPM8というイオンチャネルを活性化するため、私たちは「冷たい」と感じますが、メントールはTRPA1やTRPV3という異なるイオンチャネルにも作用します。メントールが作用する構造はTRPM8, TRPA1では明らかになっていましたが、TRPV3では分かっていませんでした。今回、自然科学研究機構 生理学研究所/生命創成探究センターの富永真琴教授は生命創成探究センター/分子科学研究所の奥村久士准教授、伊藤 暁助教との共同研究で、TRPV1, TRPV3と呼ばれるイオンチャネルにおけるモノテルペンの作用標的を明らかにしました。TRPVチャネルの活性化機構の解明やそれらを標的とした薬剤開発に貢献できると推定されます。本研究結果は、Communications Biology(Nature 姉妹紙)に掲載されました。
プレスリリース内容
我々はミントを食べてスーッと冷たく感じたり、クスノキに含まれるカンファ―(樟脳)を皮膚に塗ると清涼感を感じたりしますが、これは冷たい温度で活性化するTRPM8というイオンチャネルが、メントールやカンファーによっても活性化されるからです。このように温度感受性TRPチャネルは温度だけでなく、多くの植物由来成分で活性化されます。メントールは冷たい温度で活性化するTRPM8の他にも、温かい温度で活性化されるTRPV3などにも作用します。また、カンファーもTRPM8のほかに、43度以上の痛みをもたらす熱刺激やカプサイシンで活性化するTRPV1などにも作用します。このように、メントールやカンファーといったモノテルペンは複数の温度感受性TRPチャネルに作用しますが、メントールの場合、TRPM8を最もよく活性化するので、我々は「冷たい」と感じるのです。
温度感受性TRPチャネルは多くの生物の生存にとって重要であるため、多くの研究が行われています。構造的には、6回の細胞膜貫通領域をもつサブユニットが4つ集まって機能的な蛋白質をかたちづくっていることが知られているほか(図1左)、2017年にノーベル化学賞が授与された「低温電子顕微鏡を用いた単粒子解析法」によって原子レベルの構造が明らかになっています(図1右)。TRPチャネルが活性化するメカニズムについては、メントールやカンファーがTRPM8に作用する仕組みは明らかになっていますが、TRPV3をどのように活性化するのか、どのアミノ酸残基が重要なのかは分かっていませんでした。
図1 TRPV3の1つのサブユニットの構造モデルとリボン図
TRPV3の1つのサブユニットの膜トポロジーモデル(左)。低温電子顕微鏡解析によって明らかになっているTRPV3の構造のリボン図(右)。第4,第5膜貫通ドメインの間のリンカーにある2つのアミノ酸残基、567番目のアルギニン (R567)と573番目のグリシン (G573)に着目しました
そこで研究グループは、まず初めに、イオンチャネルのアミノ酸を人工的に入れ替えることで、どのアミノ酸残基がTRPV3の活性化に重要かを調べる変異体解析を行いました。研究グループが注目したのは、第4および第5膜貫通ドメインの間のリンカーにある2つのアミノ酸残基、567番目のアルギニンと573番目のグリシンです(図1左)。実際に573番目のグリシンをセリンに替えると、メントール やカンファーによって活性化されなくなりました(図2)。この結果から、573番目のグリシンがメントールによる活性化に重要であることが分かります。また、567番目のアルギニンをリジンやフェニルアラニン等に替えて検討した結果、メントールによる活性化は見られなくなり、メントールによる活性化にアルギニンが重要であることが分かりました。さらにカンファーについては、アルギニンの正電荷がTPRV3の活性化に重要であることも分かりました。
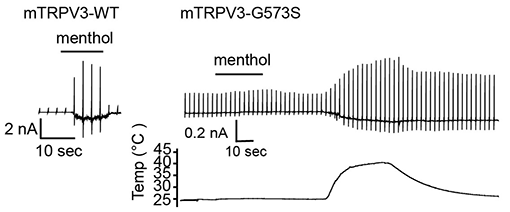
図2 パッチクランプ法を用いたマウスTRPV3野生型と変異体の電流解析
野生型マウスTRPV3 (mTRPV3-WT)はメントール (menthol)で活性化しますが、573番目のグリシンをセリンに替えた変異体 (mTRPV3-G573S)は活性化しません。しかし、mTRPV3-G573Sでは温度刺激による活性化能は保たれています。
変異体解析で明らかになったアルギニンとグリシン残基がどのようにTRPV3の活性化に関わっているかを確認するために、TRPV3の原子レベルでの構造をもとに結合モデルを作成して(図3)、コンピュータを使って分子動力学シミュレーションを行いました。その結果、メントールやカンファーはマウスTRPV3の567番目のアルギニンに直接結合することが確かめられました(図4)。さらに573番目のグリシンは、アルギニンが結合した後のイオンチャネルの活性化に関わっていることが分かりました。
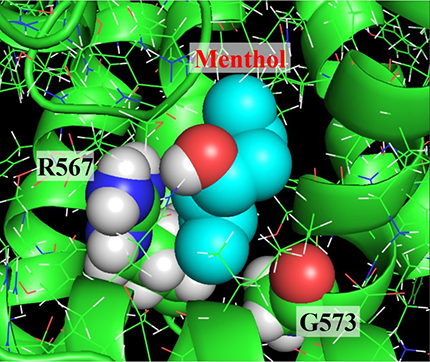
図3 TRPV3原子モデルをもとにしたメントール (menthol)の結合モデル
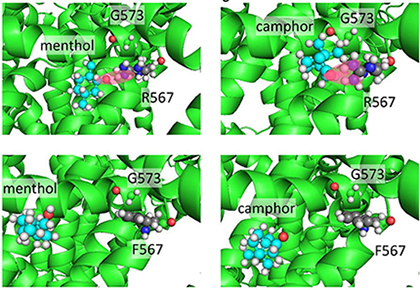
図4 分子動力学シミュレーションによるメントールとカンファーのマウスTRPV3への結合解析
メントール (menthol)やカンファー (camphor)とアルギニン(R567)との距離は近い状態です(赤い楕円で示す)が、アルギニンをフェニルアラニン (F567)に置換すると離れていき、結合ができなくなっていることが分かります。
なお、このグリシンやアルギニン残基は、カプサイシンや熱い温度によって強く活性化するTRPV1にも存在しています。そこでTRPV1のアルギニンやグリシンがメントールに対してどのように反応するかを調べたところ、驚くべきことに、野生型のTRPV1もメントールで活性化することが分かりました。また、TPRV1のアルギニンやグリシンを他のアミノ酸に替えてみたところ、活性化されなくなりました。これらの結果から、TRPV1, TRPV3で共通するアルギニンやグリシン残基がモノテルペンの作用に関わっていることが明らかになったのです。
モノテルペンは小さな脂質であり、低温電子顕微鏡での結合位置の特定が難しいことが知られています。今回、変異体を用いた電気生理学的解析と分子動力学シミュレーションを用いてモノテルペンの作用標的が明らかになったことで、TRPVチャネルの活性化機構の解明やそれらを標的とした薬剤開発に貢献できるものと期待されます。
本研究は文部科学省科学研究費補助金の補助を受けて行われました。
今回の発見
- マウスTRPV3でモノテルペンが作用する2つのアミノ酸残基(アルギニンR567とグリシンG573)を発見しました。
- その2つのアミノ酸残基がラットTRPV1のモノテルペンによる活性化にも関わっていることが分かりました。
- 分子動力学シミュレーション法を用いて、R567が直接モノテルペンに結合することが分かりました。
この研究の社会的意義
今回の研究から、TRPVチャネルの活性化機構のさらなる解明やそれらを標的とした薬剤開発に貢献できるものと期待されます。
論文情報
掲載誌:Communications Biology(2021年3月5日)
論文タイトル:
Structural basis for promiscuous action of monoterpenes on TRP channels
著者:Thi Hong Dung Nguyen, Satoru G. Itoh, Hisashi Okumura, Makoto Tominaga
お問い合わせ
<研究について>
生理学研究所 細胞生理研究部門
生命創成探究センター 温度生物学研究グループ
教授 富永真琴 (とみなが まこと)
生命創成探究センター 生命分子動態シミュレーション研究グループ
分子科学研究所 計算分子科学研究部門
准教授 奥村久士(おくむら ひさし)、助教 伊藤暁(いとう さとる)
<広報に関すること>
自然科学研究機構 生理学研究所 研究力強化戦略室