2022-07-01 東京大学
1.発表者:
山口 哲志(東京大学 大学院工学系研究科 化学生命工学専攻 准教授)
山平 真也(元:東京大学 大学院工学系研究科 化学生命工学専攻 特任研究員、現所属:聖路加国際大学 医科学研究センター 卓越研究員)
2.発表のポイント:
◆光を当てる前は分子同士が自己集合(注1)することで細胞と付着しないが、光を当てた後は自己集合がほどけて細胞と付着するようになる分子を開発した。
◆細胞の接着性(注2)に関わらずどんな種類の細胞も光を当てた場所にだけ瞬時に付着でき、光照射と細胞の付着を繰り返すことで、複数種類の細胞を精緻に配置できた。
◆がん細胞と免疫細胞(注3)のペアを並べ、免疫細胞のがん細胞傷害性を一つずつ観察できるため、免疫の診断や新薬の開発、治療用免疫細胞の探索への応用が期待される。
3.発表概要:
近年の細胞工学(注4)の進歩により、望みの種類の細胞を手に入れることが簡単になった。そこで、それらの細胞を治療や診断、創薬に活用するために、基材の表面に正確に配置する技術が必要とされている。
今回、東京大学大学院工学系研究科化学生命工学専攻の山口哲志准教授、山平真也元特任研究員(現:聖路加国際大学卓越研究員)らの研究グループは、親水性のポリマーに二本の脂質が結合し、光照射によってその内の一本の脂質が切断される分子を開発した(図1A)。この分子を表面に修飾した基材には細胞が全く付着しなくなるが、光を照射すると、細胞を付着するようになることを発見した。光のパターンを照射すると、そのパターンに応じて細胞を付着でき(図1B)、光照射と細胞の付着を繰り返すことで、複数種類の細胞を配置できた(図2A)。これまで報告されている同様の表面では、細胞の接着性を利用するものしかなく、接着性を持たない浮遊細胞(注5)には使えなかった。一方、今回開発した技術では、接着性に関わらず、細胞を付着できた(図2B)。そのため、浮遊細胞であるヒトの免疫細胞を等間隔に並べることもでき、その横に隣接して配置したがん細胞を殺す能力を一つずつ調べることに成功した(図2C,D)。この成果は、異なる細胞同士の相互作用を一つずつ調べて、そのバラつきや特徴のある細胞の検出を可能にすることを示しており、がんや感染症、神経疾患などの幅広い病気の診断や治療法の開発に貢献することが期待される。
本研究成果は、2022年6月29日(米国東部夏時間)に米国化学会誌「Journal of the American Chemical Society」のオンライン版に掲載された。
4.発表内容:
近年、複数種類の細胞を基材表面の望みの位置に正確に配置する技術が注目され、盛んに研究されている。再生医療や「Body on a Chip(ボディ・オン・チップ)」(注6)などにおいては、生体内の組織と同様の機能を再現するために、複数種類の細胞から成る複雑な構造を基材上に形成する必要がある。また、複数種類の細胞を配置する技術は、免疫や神経伝達などの細胞間相互作用によって制御されている生命現象を研究するために極めて便利な技術である。従って、細胞生物学の基礎研究から創薬、再生医療といった幅広い研究分野で必要とされている。
このような背景から、これまでに、光に応答して細胞の付着性が変わる表面が盛んに開発されてきた。しかし、従来の表面は、光に応答して細胞膜上の接着因子と結合する表面ばかりで、接着因子を細胞表面に持っている接着性の細胞にしか応用できない。従って、浮遊性の血液細胞や免疫細胞、弱接着性のがん細胞などを配置できなかった。また、細胞接着を利用する従来法では、一種類の細胞を付着させるのに数時間以上かかり、複数種類の細胞を配置するには長時間が必要であった。
今回、本研究グループは、細胞の接着性を利用しない光応答性の細胞付着表面を開発した。まず、親水性のポリマーであるポリエチレングリコール(PEG)の片方の末端に脂質であるオレイル鎖が二本結合し、もう片方の末端で基材表面に修飾できる分子を合成した(図1A左)。この分子の一本のオレイル鎖は、波長が350 ~ 405ナノメートルの光(紫外光から青色光の一部まで)を照射すると切断されるように設計した。この分子を高密度に修飾した表面では、二本の脂質部分が水中で自己集合し、細胞の付着を妨げるPEG部分が表面に出る(図1A右)。一方、光照射によって脂質を一本切断すると、残った方の脂質が表面に露出し、細胞表面の細胞膜と強く相互作用することを明らかにした(図1A右)。この表面は、接着因子ではなく、細胞の表面には必ず存在する細胞膜と結合するため、昆虫細胞からヒトの免疫細胞に至るまで、細胞の接着性に関わらずどんな細胞も瞬時に付着できた。また、光照射と細胞の付着を繰り返すことで、短時間で複数種類の細胞を配置することに成功した(図2A,B)。これらの特徴を利用して、ヒトの血液検体に含まれるナチュラルキラー細胞(NK細胞)(注7)を1細胞ずつ等間隔に並べ、その横に隣接するように白血病細胞を配置し、直ちに両者の相互作用を経時観察した(図2C)。その結果、NK細胞が白血病細胞を殺す様子を最初から最後までリアルタイムで顕微鏡観察でき、その細胞ペア一つずつの観察画像データの機械学習によって、白血病細胞を殺傷するNK細胞と殺傷しないNK細胞を自動分類できた(図2D)。さらに、異なるメカニズムで細胞死を誘導するNK細胞の集団を識別することにも成功した(図2D)。
がんや感染症の治療法として、免疫細胞によってがん細胞や感染細胞を選択的に殺傷して治癒する免疫療法が注目されている。本技術は、がん細胞傷害性の高い免疫細胞を識別することができるため、治療用のTCR-T細胞(注8)の選別や、CAR-T細胞(注9)の品質管理に貢献することが期待される。また、特徴的な細胞間相互作用を示す細胞を1細胞レベルで識別できるため、その細胞表層のタンパク質を調べることで、新しい治療や診断用の標的分子の発見にもつながると期待される。
本研究は、JST「未来社会創造事業(課題番号:19217334)」(研究代表:山口哲志)、JSTさきがけ「統合一細胞(課題番号:16815021)」(研究者:山口哲志)、科研費「若手研究B(課題番号:19k15366)」(研究代表:山平真也)、文部科学省「卓越研究員事業(課題番号:16812307)」(研究者:山平真也)、JSTさきがけ「統合一細胞(課題番号:15654934)」(研究者:山下隼人)の支援により実施された。
5.発表雑誌:
雑誌名:「Journal of the American Chemical Society」(オンライン版:6月29日)
論文タイトル:Photoactivatable materials for versatile single-cell patterning based on the photocaging of cell-anchoring moieties through lipid self-assembly
著者:Shinya Yamahira,* Ryuji Misawa, Takahiro Kosaka, Mondong Tan, Shin Izuta, Hayato Yamashita, Yuji Heike, Akimitsu Okamoto, Teruyuki Nagamune, Satoshi Yamaguchi*
DOI番号:10.1021/jacs.2c02949
URL:https://pubs.acs.org/doi/10.1021/jacs.2c02949
6.研究グループの構成:
山平 真也(元:東京大学 大学院工学系研究科 特任研究員、現所属:聖路加国際大学 医科学研究センター 卓越研究員)
三澤 龍志(研究当時:東京大学 大学院工学系研究科 修士課程)
小阪 高広(東京大学 大学院工学系研究科 博士課程)
談 莫東(研究当時:東京大学 大学院工学系研究科 博士課程)
泉田 森(研究当時:東京大学 大学院工学系研究科 修士課程)
山下 隼人(大阪大学 大学院基礎工学研究科附属極限科学センター 助教)
平家 勇司(研究当時:聖路加国際大学 公衆衛生大学院 教授/聖路加国際大学 医科学センター センター長)
岡本 晃充(東京大学 大学院工学系研究科 教授/東京大学 先端科学技術研究センター 教授)
長棟 輝行(研究当時:東京大学 大学院工学系研究科 教授、現所属:総合研究奨励会 コーディネーター/東京大学名誉教授)
山口 哲志(東京大学 大学院工学系研究科 准教授)
7.用語説明:
(注1)自己集合:
分子が自発的に集合し、構造体を形成する現象。近年、材料科学の分野で盛んに研究が行われている。本研究では、光を当てる前に、開発した分子の疎水性の脂質部分が基材表面の水中で自発的に集合して、ナノメートルサイズの構造体を形成していることを、共同研究者である大阪大学の山下隼人助教が原子間力顕微鏡を用いて観察した。
(注2)細胞の接着性:
細胞が細胞外マトリクスや他の細胞、基材表面などと付着する性質のこと。インテグリンなどの細胞膜上に存在するタンパク質(接着因子)を介して付着する。
(注3)免疫細胞:
白血球の一種で、感染、病気、あるいは望まれない侵入生物を回避する「免疫」を担う細胞。体内で病原性の分子や細胞を分解したり、殺傷したりする。
(注4)細胞工学:
人工的な操作によって細胞を加工したり、培養したりする技術。
(注5)浮遊細胞:
浮遊した状態でも増殖する細胞。培養基材などに強く接着できない。血液細胞など、医療や創薬、有用物質生産に関わる細胞の多くを含む。
(注6)Body on a Chip(ボディ・オン・チップ):
手のひらに載るほどのサイズのチップの上に人体を再現したもの。各臓器由来の細胞をチップ上に配置し、ヒトや実験動物を用いることなく、薬物の代謝や効果を調べることができる。
(注7)ナチュラルキラー細胞(NK細胞):
全身を巡回しながら、がん細胞やウイルス感染細胞などを見つけ次第殺傷する細胞。生まれながらに備わっているからだの防衛機構である自然免疫に重要な役割を担い、感染症の重症化に関わっていることも報告されている。
(注8)TCR-T細胞:
がん細胞を認識するT細胞受容体(TCR)遺伝子をT細胞に導入して強制発現させ、がん殺傷効果を高めたTCR遺伝子改変T細胞のこと。患者のがん細胞を認識するTCRの選別や品質管理に膨大な時間と労力がかかり、高額な費用が必要となるという課題がある。
(注9)CAR-T細胞:
がん細胞を認識する抗体とリンパ球活性化分子との融合タンパク質(CAR)遺伝子をT細胞に導入して強制発現させ、がん殺傷効果を高めた遺伝子改変T細胞のこと。TCR-T細胞と同様の課題がある。
8.添付資料:
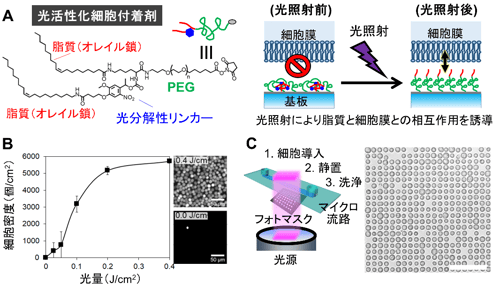
図1 (A)光活性化細胞付着剤の構造式と基材表面上で光に応答して細胞膜と相互作用する機構の概念図。(B)光照射量と付着する細胞の密度の関係と、0 J/cm2と0.4 J/cm2の光を照射した表面に付着した血球細胞の蛍光顕微鏡画像。(C)1細胞の大きさの光のパターンを照射して作成した1細胞アレイの顕微鏡画像。
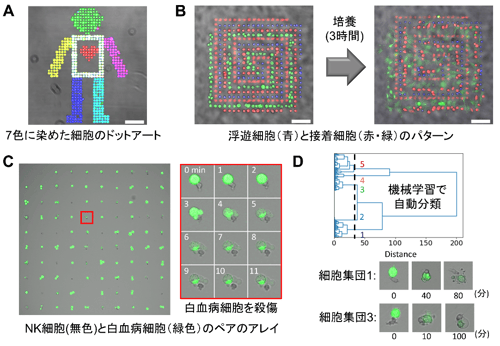
図2 (A)光活性化細胞付着剤を修飾した表面上で3色に染め分けた血球細胞を順次配置して作成したドットアートの蛍光顕微鏡画像。(B)複数種類の浮遊細胞と接着細胞を配置した細胞パターンの培養前後での蛍光顕微鏡画像。縮尺は100 μm。(C)NK細胞と白血病細胞(緑色蛍光染色を施したK562細胞)とを1細胞ずつ隣接させて並べた際の蛍光顕微鏡画像。赤枠内は、白血病細胞が殺傷される様子の経時変化の拡大図。(D)細胞ペアの経時顕微鏡画像データを機械学習で自動分類した際の樹形図。分類された細胞集団1(アポトーシス様細胞死)と細胞集団3(ネクローシス様細胞死)の典型的な経時変化画像。