2023-05-11 自然科学研究機構
概要
齊藤修 長浜バイオ大学バイオサイエンス学部教授、堀翔悟 同助手と久保義弘 自然科学研究機構生理学研究所教授らの研究グループは、涼しい環境を好むサンショウウオなどの有尾両生類が持つ熱さを感じるセンサーTRPV1の特徴を明らかにしました。この高温のセンサーは、ヒトやマウスなど多くの動物に比べ10℃近くも低い温度から活性化される特別な性質があり、有尾両生類という動物の生態を良く説明することが分かりました。そして、更にこの特性はセンサータンパク質のアミノ末端の2個のアミノ酸残基の変化で獲得されたものであることを突き止めました。
これらの発見は、温度感覚を生み出すセンサーの活性化機構の解明だけでなく、地球上に生息する動物界で起きてきた多様性獲得の仕組み解明に大きく貢献します。以上の研究成果は英国科学誌Nature Communicationsに令和5年5月11日付けで公開されました。
研究の背景
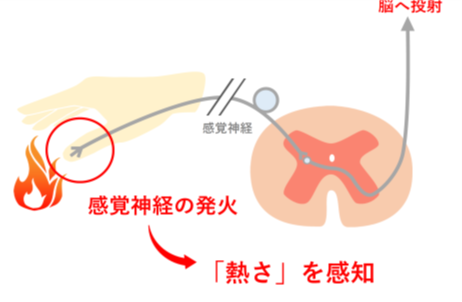
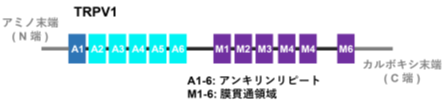
TRPV1:動物は、皮膚表面にある感覚神経の終末で温度を感じて、その情報が神経を通じて脳に伝わり、暑さや寒さを感じます。この感覚神経の終末には温度を感じる受容体(センサー)があります。高温で活性化され熱さの感覚を引き起こす主要なセンサーがTRPV1というイオンチャネルで、2021年にノーベル生理学医学賞を受賞したDavid Julius教授が発見しました。この分子には、N端側にアンキリンリピートという繰り返し配列が6個あり、C端側にチャネルを形成する6個の膜貫通領域があります。そして、多くの動物でこのTRPV1は、43℃以上で活性化することが分かっていました。
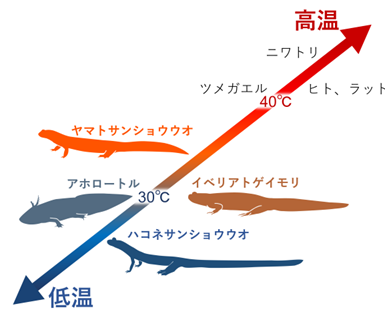
有尾両生類:地球温暖化などの影響を最も受け、世界的に減少しているのが両生類であると言われています。その中でも特に、サンショウウオやイモリの仲間は有尾両生類と呼ばれ、涼しい環境を好む動物とされています。有尾両生類は温帯から寒帯という限られた地域に生息する動物群であり、高温への適応性を欠いていると考えられていました。しかし、これらの有尾両生類がどのような高温センサーを使い、外界の温度を感知しているのかについては全く調べられていませんでした。そこで私たちは、メキシコの涼冷な高原湖原産のアホロートル(ウーパールーパー)、スペインなどに生息するイベリアトゲイモリ、滋賀県長浜市にも分布するヤマトサンショウウオ、山地の渓流に棲むハコネサンショウウオ、これら4種のTRPV1の温度応答性を調べました(写真提供:自然写真家・関慎太郎)。

研究成果
<有尾両生類は何℃から熱いと感じるか>
研究グループは、まず4種の有尾両生類が、何℃から高温を嫌がるのか、その忌避温度を調べました。他の多くの動物の忌避温度は43℃くらいですが、私たちが調べた有尾両生類の忌避温度は、全て明らかに低く、特に最も低温の山地渓流に棲むハコネサンショウウオの忌避温度が最も低いことが分かりました。
<有尾両生類の高温センサーTRPV1は30℃前後で活性化する>
そこで、このような有尾両生類の低い温度での高温忌避行動が、どのような仕組みで起こるのか、動物の主要な高温センサーであるTRPV1の性質を調べました。クローニングして解析すると、4種の有尾両生類のTRPV1は、いずれも活性化温度がかなり低く30℃前後であることが示されました。多くの動物のTRPV1は43℃から反応する為、この温度では全く活性化されません。この結果は、低温を好み涼冷地域に生息するという有尾両生類の生態を良く説明しています。
<TRPV1の活性化温度はN端のANK1の2番目と28番目のアミノ酸残基が決める>
次に有尾両生類のTRPV1が、チャネル分子のどの部位が原因で30℃前後で活性化されるようになっているのかを詳しく調べました。TRPV1分子には、N端側に6個のアンキリンリピート、C端側にチャネルを形成する6個の膜貫通領域があります。活性化温度を変化させる原因部位を探索する実験を進めていった結果、N末側の1個目のアンキリンリピート(ANK1)内の2番目と28番目のアミノ酸残基が重要であることを突き止めました。この二つの部位のアミノ酸残基は、有尾両生類のTRPV1ではQ(グルタミン)とL(ロイシン)またはV(バリン)であり、一方、ラットなどの多くの動物のTRPV1ではR(アルギニン)とK(リジン)になっています。まず、アホロートルのTRPV1を用いて、この2か所のアミノ酸残基をラット型のRとKに交換すると、活性化温度が40℃近くまで大きく上昇し、ラット型温度特性に変化することが分かりました。その上、43℃以上で活性化するラットTRPV1の同じANK1内の2番目と28番目のアミノ酸RとKを逆にアホロートル型のQとLに変化させると、今度は活性化温度が大きく降下しアホロートル型温度特性に変化することが判明しました。
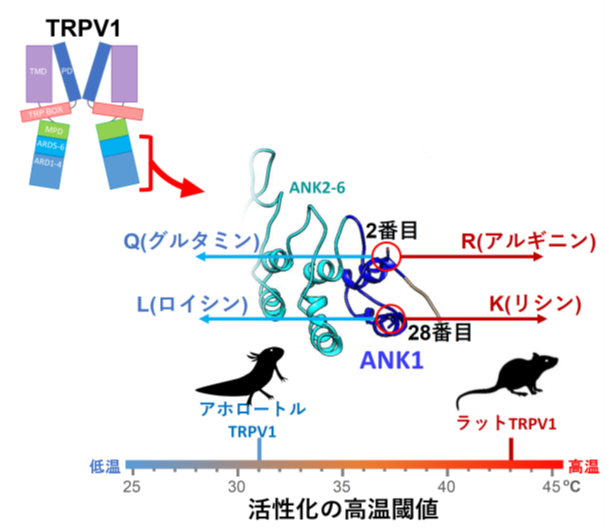
しかもこの仕組みは、有尾両生類共通であり、イベリアトゲイモリ・ヤマトサンショウウオ・ハコネサンショウウオいずれのTRPV1も、同じANK1内の2番目と28番目のアミノ酸残基をラット型のRとKに変化させると、アホロートルTRPV1の結果と同じ様に活性化温度が大きく上昇し、ラット型温度特性に変化しました。つまり、高温を嫌う有尾両生類とラットのTRPV1は大きくその活性化温度が違い、有尾両生類は30℃前後から、ラットは43℃から活性化されますが、この違いはN末近傍にあるたった2個のアミノ酸残基の違いにより起こっていることが判明しました。
<TRPV1のN端ANK1の2か所のアミノ酸残基が活性化温度を決める仕組み>
次に、研究グループは、TRPV1のANK1の2番目と28番目のアミノ酸の選択だけで、どのようにして活性化する温度が大きく変わるのか、その機構解明に取り組みました。
最近、ラットTRPV1のクライオ電子顕微鏡像から立体構造と高温活性化のモデルが示されていました(Nature Struct.Mol.Biol.28:554,2021)。主張された高温活性化モデルでは、TRPV1は閉じた状態から中間状態を経て開口状態へと遷移すると仮定されています。
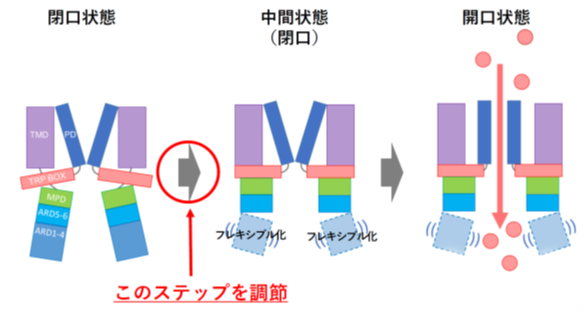
このモデルでは、まず閉じた状態からの第一ステップで、温度上昇によりN端のアンキリンリピート部で構造をとらなくなるフレキシブル化が起こり、更にN端の基部が回転して中間状態となります。次に中間状態から開口までの第二ステップでは、外側のイオン透過路が再配置し、更に第6膜貫通域とその周辺のヘリックスが再配置することでゲートが開き、開口状態となると主張されました。このモデルに従うと、本研究で見出したANK1の点変異はN端のフレキシブル化に影響を与え、高温活性化の初期過程の起こり易さを変化させることで活性化温度を変えるのだと考えらます。
そこで、構造の安定性と同定した2点のアミノ酸変異の関係を知る為、既に決定されたラットTRPV1の立体構造からアホロートルTRPV1の構造を予想し、その構造からANK1の2番目と28番目のアミノ酸残基を変えた場合の安定性変化をPC上で計算し、更に実際の各アホロートルTRPV1変異体の活性化温度を実験的に計測しました。すると、アミノ酸変異でN末構造が安定化すると活性化温度は上がり、不安定化すると活性化温度が下がる、という関係が示されました。
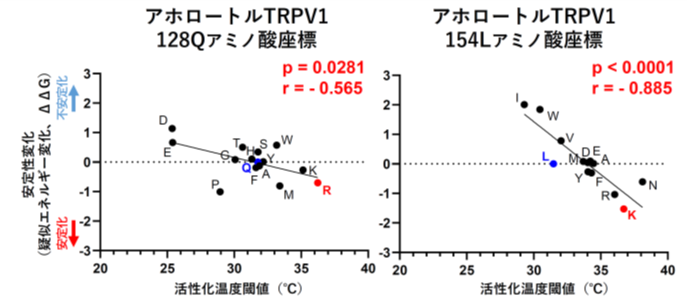
それでは、TRPV1のN端部はANK1の2番目と28番目のアミノ酸残基の選択だけで、本当にタンパク質レベルで熱安定性が変化するのか、実際にラットTRPV1のN端部のタンパク質の組換えタンパク質を作り、これら2点のアミノ酸残基をアホロートル型のQとLにした場合に、安定性がどう変化するのか解析しました。結果、ラットTRPV1のN端タンパクは、やはりこれら2点の変異だけで顕著に熱安定性が低下しました。つまり、有尾両生類で見つかったTRPV1の2か所のアミノ酸変異部は、N端の熱安定を決定する重要な部位であることが明らかになりました。
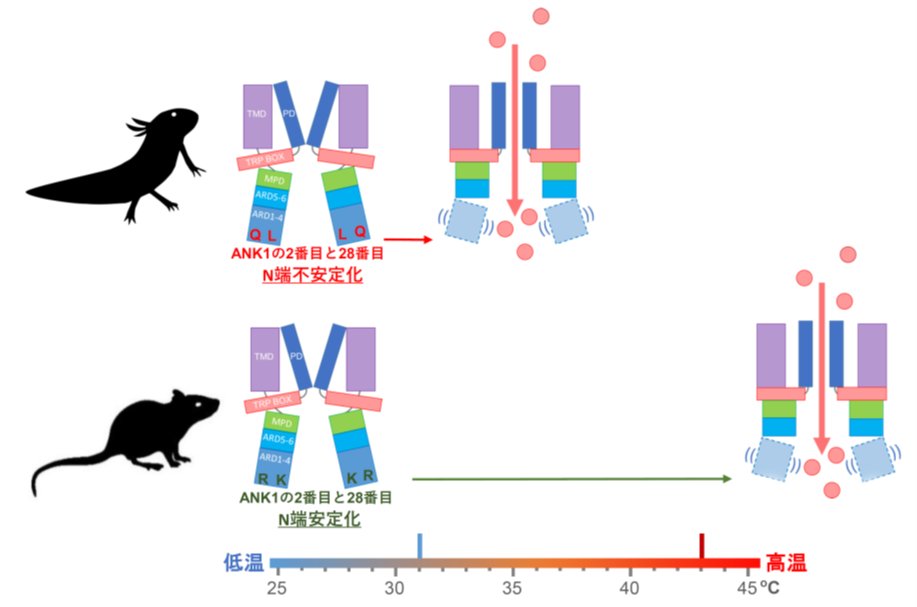
このように私たちは、ANK1の2番目と28番目の2点の座標がTRPV1チャネルのN端の安定性を支配し、これにより、「高温センサーTRPV1の開き易さが変わり、何℃で開口するか」が決まっていることを世界で初めて明らかにしました。そして、この部位への変異の獲得が、涼しい環境を好む有尾両生類の低温生息地選択と適応に大きく寄与していると考えられました。
この研究の社会的意義
近年、温暖化により暑くなる日が増えています。この温暖化により多くの両生類が数を減らしていますが、特に涼しい環境に棲むサンショウウオなどの有尾両生類は大きな影響を受けていると考えられます。これらの動物がどの様な仕組みで外界温度を感じているのかを知ることは、温暖化による動物への真の影響を理解し、予測し、そして種の保全につなげてゆく為の有益な情報になります。
また、本研究の対象である高温センサーのTRPV1は、ヒトにも共通な“痛みのセンサー”でもあります。その為、本研究のようなTRPV1の活性化の仕組みや、その感受性の変化が起きる仕組みを明らかにすることは、ヒトの神経障害性など様々な「痛み」に関係した疾患の治療や新薬開発、更に遺伝マーカーの開発に繋がる突破口になる可能性があります。
研究グループ・論文情報
長浜バイオ大学・バイオサイエンス学部
齊藤修 教授、白井剛 教授、堀翔悟 助手
自然科学研究機構・生理学研究所
久保義弘 教授、立山充博 准教授
Nature Communications
Two Single-Point mutations in Ankyrin Repeat One Drastically Change the Threshold Temperature of TRPV1
Shogo Hori, Michihiro Tateyama, Tsuyoshi Shirai, Yoshihiro Kubo and Osamu Saitoh
本件に関する問い合わせ先
齊藤 修(長浜バイオ大学アニマルバイオサイエンス学科・教授)
リリース元
自然科学研究機構 生理学研究所