2023-06-15 理化学研究所,東京大学,山梨大学,杏林大学
理化学研究所(理研)脳神経科学研究センター 神経動態医科学連携研究チームの島 康之 上級研究員(研究当時)、中冨 浩文 チームリーダー(杏林大学 医学部 脳神経外科学 教授)、太田 仲郎 客員研究員、脳神経医科学連携部門 岡部 繁男 部門長(東京大学大学院 医学系研究科神経細胞生物学分野 教授)、生命医科学研究センター がんゲノム研究チームの笹川 翔太 研究員、中川 英刀 チームリーダー、東京大学大学院 医学系研究科脳神経医学専攻 脳神経外科学分野の齊藤 延人 教授、山梨大学 医学部 生化学講座第一教室の金 然正 特任助教、大塚 稔久 教授らの国際共同研究グループは、ヒトの脳動脈瘤[1]検体から脳動脈瘤の発生に重要な体細胞遺伝子変異[2]を同定し、遺伝子導入によるマウス脳動脈瘤新生・抑制モデルを初めて樹立しました。
本研究成果は、開頭手術か血管内カテーテル治療しかない脳動脈瘤治療の現状に、薬物療法という第三の選択肢の可能性を開くと期待できます。
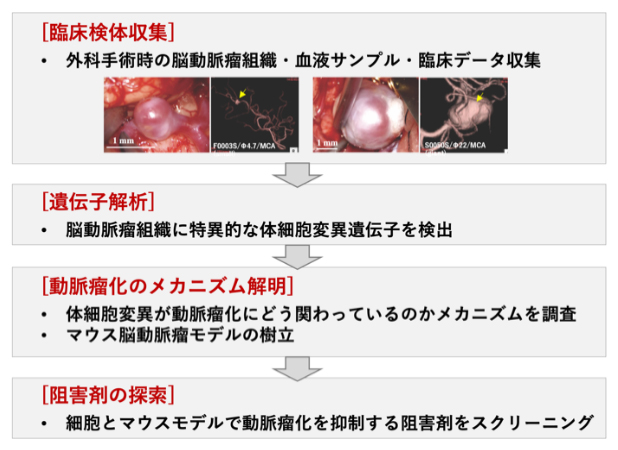
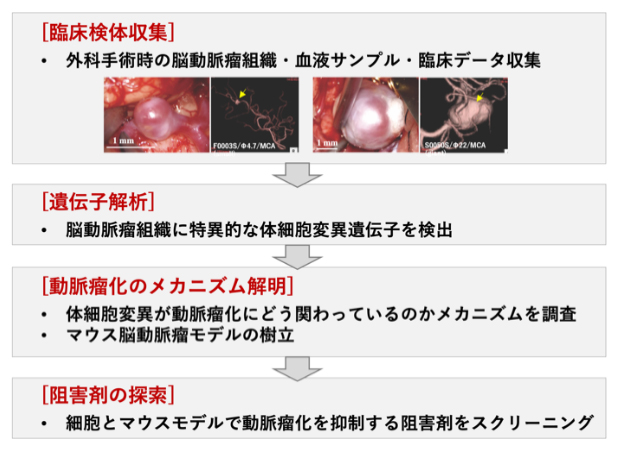
今回、国際共同研究グループは、外科手術時に摘出された脳動脈瘤の遺伝子を解析し、405個の遺伝子に体細胞遺伝子変異を同定しました。このうち90%以上の検体で変異が確認された16個の遺伝子は、炎症反応や腫瘍形成に関わる「NF-κBシグナル伝達経路[3]」に関連しており、そのうちの6個の遺伝子の変異が嚢状動脈瘤[1]と紡錘状動脈瘤[1]の両方に共通することを発見しました。さらに、この6遺伝子の中で最も頻度の高かった「血小板由来成長因子受容体β(PDGFRβ)[4]」の遺伝子変異をマウスに導入し、PDGFRβ遺伝子の変異によって実際に紡錘状動脈瘤様の拡張が起こること、その動脈瘤化をチロシンキナーゼ[5]阻害剤の全身投与で抑制できることを証明しました。
本研究は、科学雑誌『Science Translational Medicine』オンライン版(6月14日付:日本時間6月15日)に掲載されました。
本研究の概略
背景
脳動脈瘤は、破裂によりくも膜下出血[6]を引き起こしたり、徐々に膨らみ大脳や脳幹部を圧迫したりするなど、生命を脅かす最も危険な脳卒中疾患[7]の一つです。年齢、性別、飲酒などに加え、家族歴が非常に重要なリスクファクターであることが知られていますが、家族性脳動脈瘤と分かっているケースは全体の10%にすぎません。日本人の約5%が未破裂脳動脈瘤に罹患しますが、その発生過程や破裂してくも膜下出血へ至る病理病態についてはこれまでほとんど知見がありませんでした。子に遺伝する可能性のある胚細胞変異[2]やその他の遺伝的リスクファクターと脳動脈瘤発生の関係については、最近ようやく大規模なゲノムワイド関連解析[8]が始まったばかりです。
また、後天的に発生する体細胞遺伝子変異と脳動脈瘤発生の関係についての情報はさらに限られています。これまでの報告の大半は血管奇形に関するもので注1)、脳動脈瘤発生との直接的な因果関係を示すがん関連遺伝子についての報告はほとんどなく注2)、全く形状の異なる脳動脈瘤である「嚢状動脈瘤」(脳動脈瘤全体の90%以上、風船のような形)とより稀な「紡錘状動脈瘤」(ラグビーボールのような血管拡張で脳動脈瘤全体の10%弱)それぞれに体細胞遺伝子変異がどう関与しているかは、これまで明らかにされていませんでした。
現在、脳動脈瘤の治療法は開頭手術または血管内カテーテル治療という二択しかない状況です。特に巨大・大型血栓化紡錘状脳底動脈瘤[9]は、特別な治療をしなかった場合、予後は極めて不良です。いったん発症してしまうと、破裂、脳幹梗塞[10]、脳幹機能不全[11]によって、平均5.5年で91%が死亡、残る9%も重度の後遺症を患うことが知られています注3)。確立した外科的治療はなく、さまざまな外科的処置を組み合わせても、治療後自立して日常生活ができるケースは65~73%、予後不良は3~15%、死亡は20~24%という状況です注4)。
本研究では、紡錘状動脈瘤と嚢状動脈瘤の病態に関する新たな知見を取得すべく研究に取り組みました。
注1)Nikolaev SI, Vetiska S, Bonilla X, Boudreau E, Jauhiainen S, Rezai Jahromi B, Khyzha N, DiStefano PV, Suutarinen S, Kiehl TR, Mendes Pereira V, Herman AM, Krings T, Andrade-Barazarte H, Tung T, Valiante T, Zadeh G, Tymianski M, Rauramaa T, Ylä-Herttuala S, Wythe JD, Antonarakis SE, Frösen J, Fish JE, Radovanovic I. Somatic Activating KRAS Mutations in Arteriovenous Malformations of the Brain. N Engl J Med. 2018 Jan 18;378(3):250-261. doi: 10.1056/NEJMoa1709449. Epub 2018 Jan 3. PMID: 29298116; PMCID: PMC8161530.
注2)Karasozen Y, Osbun JW, Parada CA, Busald T, Tatman P, Gonzalez-Cuyar LF, Hale CJ, Alcantara D, O’Driscoll M, Dobyns WB, Murray M, Kim LJ, Byers P, Dorschner MO, Ferreira M Jr. Somatic PDGFRB Activating Variants in Fusiform Cerebral Aneurysms. Am J Hum Genet. 2019 May 2;104(5):968-976. doi: 10.1016/j.ajhg.2019.03.014. Epub 2019 Apr 25. PMID: 31031011; PMCID: PMC6506794.
注3)Nakatomi H, Kiyofuji S, Ono H, Tanaka M, Kamiyama H, Takizawa K, Imai H, Saito N, Shiokawa Y, Morita A, Flemming KD, Link MJ. Giant Fusiform and Dolichoectatic Aneurysms of the Basilar Trunk and Vertebrobasilar Junction-Clinicopathological and Surgical Outcome. Neurosurgery. 2020 Dec 15;88(1):82-95. doi: 10.1093/neuros/nyaa317. PMID: 32745190; PMCID: PMC7891276.
注4)Kodama N, Suzuki J. Surgical treatment of giant aneurysms. Neurosurg Rev. 1982;5(4):155-60. doi: 10.1007/BF01742678. PMID: 7167224.
研究手法と成果
国際共同研究グループはまず、次世代シークエンサー[12]を用いて、外科手術時に摘出されたヒトの脳動脈瘤検体(65症例)の網羅的な遺伝子解析を行い、405個の遺伝子に体細胞遺伝子変異(以下、変異)が起きていることを発見しました。PDGFRβ遺伝子以外の遺伝子と脳動脈瘤との関連性が確認されたのは初めてです。また、パスウェイ解析[13]を含むさまざまな遺伝子相関解析法を駆使して405個の遺伝子同士の関係性を分析し、その中の112個の遺伝子の変異が相互に脳動脈瘤の発生に関与していることを見いだしました。そして、これらの遺伝子変異の多くががん関連遺伝子であること、特に高頻度(解析した検体の92%)で変異が見られた16個の遺伝子が炎症反応や腫瘍形成に関わる「NF-κBシグナル伝達経路」に関連していることを見いだしました(図1)。また、これら16遺伝子のうち6個の遺伝子には、紡錘状動脈瘤と嚢状動脈瘤の両方に共通で変異が見られました(図1)。
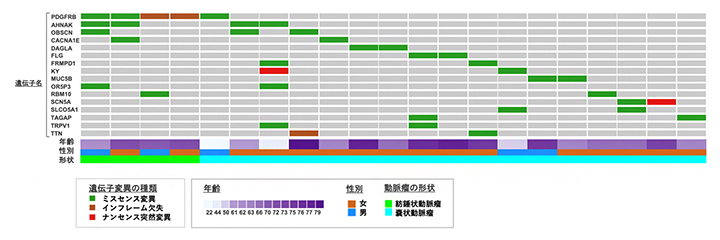
図1 脳動脈瘤に特異的な体細胞遺伝子変異が高頻度で見られた16個の遺伝子とその症例
脳動脈瘤に特異的な体細胞遺伝子変異のうち、16個の遺伝子に関わる動脈瘤症例を示す。16遺伝子は炎症反応や腫瘍形成に関わるNF-κBシグナル伝達経路に関連しており、これらの多くに緑で示すミスセンス変異(コドン内の塩基置換により、異なるアミノ酸に置き換わる変異)が見られた。そのうち6個の遺伝子(PDGFRB、AHNAK、OBSCN、CACNA1E、OR5P3、RBM10)には、紡錘状動脈瘤と嚢状動脈瘤の両方で変異が確認された。
さらに、最も難治性の脳動脈瘤にはPDGFRβ遺伝子の変異が選択的に発生していることが明らかになりました。脳動脈瘤検体の臨床データと遺伝子解析の結果を照らし合わせたところ、予後不良の紡錘状動脈瘤11症例のうち4症例(約36%)がPDGFRβ遺伝子の変異を伴っていました(図2左)。さらに、これまで変異に関する報告がなかった嚢状動脈瘤のうち、最も難治性である20mm以上の大型・巨大嚢状動脈瘤(最大径10mm以上は大型、最大径25mm以上は巨大と定義される)では、3症例中2症例(約67%)にPDGFRβ遺伝子の変異が起きていました(図2右)。
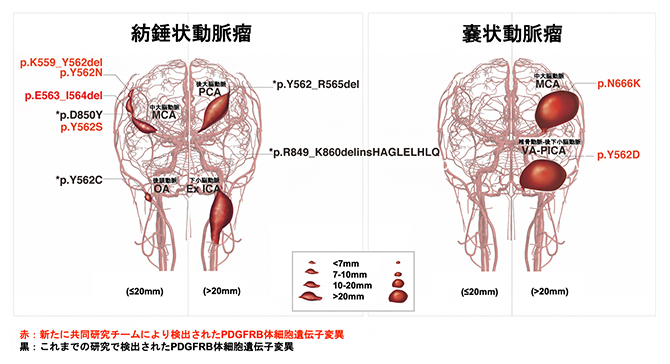
図2 脳動脈瘤の位置とPDGFRβ遺伝子変異の関係
今回、PDGFRβ遺伝子(PDGFRB)変異は6症例で確認され、赤字で示す6種類の変異型が新たに同定された。PDGFRβ遺伝子変異は最も難治性の脳動脈瘤に選択的に発生しており、紡錘状動脈瘤と嚢状動脈瘤の両方で見られ、前方および後方循環系にわたる広範囲で確認された。
次に、変異のある動脈瘤検体のどの細胞にPDGFRβ遺伝子変異が起きているかを調べた結果、動脈瘤の外膜側にある、血管壁の幹細胞と考えられるペリサイト[14]に変異が多いことを確認しました。PDGFRβは受容体チロシンキナーゼ[5]の一種で、変異が起きると自己リン酸化[15]が亢進され活性化し、シグナル伝達経路の下流に位置する遺伝子の発現に影響するといわれています。こうした自己リン酸化を伴ったペリサイトの増殖・肥厚は、PDGFRβ遺伝子変異のある紡錘状、嚢状動脈瘤の両タイプの脳動脈瘤組織で確認されました(図3)。また、これらの検体では、PDGFRβ遺伝子および炎症に関わる遺伝子の発現も亢進していることが分かりました(図4)。
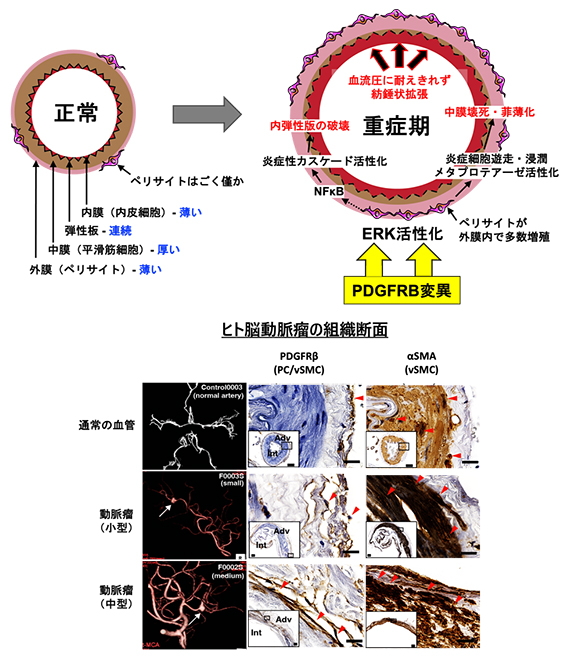
図3 変異陽性動脈瘤のPDGFRβの発現亢進
一般的にPDGFRβは血管壁のペリサイトおよび血管平滑筋に発現する(上)。変異が入ると細胞内のERK/AKT/ERKカスケードの活性化、ペリサイトの外膜側での増殖・浸潤、プロテアーゼの活性化、中膜平滑筋の破壊が起こる。同時に、NF-kBを介した炎症性カスケードも活性化され中膜のみならず弾性板も破壊される。さらに重症期の血管は、血管内腔からの重圧に耐えきれないため、紡錘状拡張・動脈瘤化が促進される(下)。赤矢印は、中膜を構成するSMA陽性の平滑筋細胞(右)、異常に外膜内で増殖したPDGFRβ陽性のペリサイト(中央)を示す。メインパネルスケール:20µm、インレットスケール:100µm。
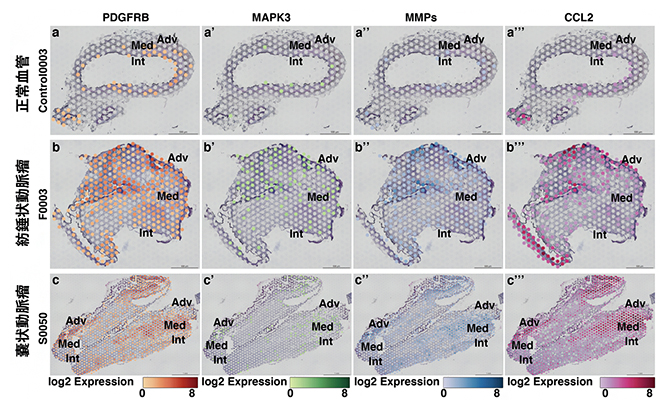
図4 動脈瘤壁内のPDGFRβ遺伝子および炎症に関わる遺伝子の発現上昇
PDGFRβ遺伝子変異が見られた脳動脈瘤検体の切片を作製し、Visium空間的遺伝子解析法を用いて、組織の位置情報と遺伝子の発現パターンの関係を解析した。PDGFRβ遺伝子が変異し発現が上昇している箇所では、紡錘状・嚢状ともに炎症に関わる遺伝子(MAPK3、MMPs、CCL2)の発現が亢進していた。
この結果を受け、PDGFRβ遺伝子変異によって亢進されるシグナル伝達を阻害する薬剤を探索しました。PDGFRβを含む受容体チロシンキナーゼをターゲットとした多数の阻害剤ががん治療を目的に開発されていることに着目し、PDGFRβ遺伝子が変異したヒト細胞株に、腎がん治療薬のチロシンキナーゼ阻害剤であるスニチニブ[5]を投与したところ、この阻害剤が自己リン酸化活性を抑えることを見いだしました。
最後に、ヒトで検出されたPDGFRβ遺伝子の変異が、マウスでも脳動脈瘤化を誘発するかを検証するため、PDGFRβ遺伝子の変異型(p.K559_R562del[559番目のリシンから562番目のアルギニンまでが欠失した変異])をウイルスベクターで脳動脈血管壁に導入しました。すると、変異型遺伝子導入の28日後にはマウス脳底動脈に紡錘状動脈瘤様の変化(血管径拡張)が起こることを確認しました(図5中)。さらに、このマウスモデルにおいて、スニチニブの投与によって動脈瘤化が抑制できることが分かりました(図5右)。このようにして、遺伝子導入によるマウス脳動脈瘤新生・抑制モデルを初めて樹立しました。
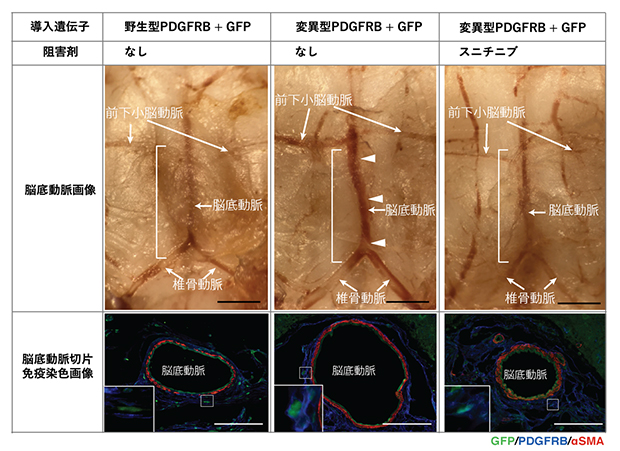
図5 マウス紡錘状動脈瘤モデルでの血管径拡張とスニチニブ投与による動脈瘤化の抑制
ウイルスベクターを介してPDGFRβ遺伝子の変異型を導入したマウスでは、脳底動脈の血管径拡張と形態変化が見られた(中)。野生型のPDGFRβ遺伝子を導入したマウスでは、同様の変化は見られなかった(左)。さらに、チロシンキナーゼ阻害剤であるスニチニブを投与したマウスでは、PDGFRβの変異型遺伝子を導入した場合でも血管拡張と形態変化は見られなかった(右)。GFPは緑色蛍光タンパク質で、強制遺伝子導入した細胞、αSMAはα平滑筋アクチンを示す。
今後の期待
今回脳動脈瘤検体で変異が多く見られた16個の遺伝子の多くはがん関連遺伝子であり、この中には既に固形がんで発生原因として同定され、分子標的薬・低分子化合物の開発が進んでいる遺伝子が存在します。従って、こうしたがんゲノム医療[16]において治療効果が期待される薬が、脳動脈瘤の発生・増大・破裂予防に対しても治療効果を持つ可能性があります。今後、本研究で示されたスニチニブ投与による動脈瘤化阻害効果が、大型哺乳動物、そして臨床試験で検証された場合、全く新しい脳動脈瘤治療薬の実用化につながることが期待できます。
そうすれば、これまでは開頭手術または血管内カテーテル治療しかなかった動脈瘤治療の現場において、薬物療法という第三の選択肢の可能性が開かれることから、本研究成果の社会的意義は非常に大きいと考えられます。
補足説明
1.脳動脈瘤、嚢状動脈瘤、紡錘状動脈瘤
脳動脈瘤は脳血管の正常構造が破綻し、血流が入り込み膨らんだ部位のこと。膨らみが大きくなり血管壁が破れ出血すると、くも膜下出血となる。嚢状動脈瘤は、動脈分岐部での風船状の拡張を特徴とする動脈瘤で、脳動脈瘤全体の90%以上を占める。紡錘状動脈瘤は、大動脈の紡錘形(ラグビーボールのような形)の膨らみを特徴とする動脈瘤である。
2.体細胞遺伝子変異、胚細胞変異
体細胞遺伝子変異は、一部の体細胞が分化や生育の過程で獲得した遺伝子変異であり、がんなどの腫瘍性病変の発生の原因となる。一方で、胚細胞変異は、生殖細胞(女性の卵細胞と男性の精子細胞)で起こる遺伝子変異のことで、子孫に遺伝する可能性がある。
3.NF-κBシグナル伝達経路
炎症反応や腫瘍形成、アポトーシス(異常を起こした細胞を取り除くためのプログラム化された細胞死)などに関与する、細胞内の一連のシグナル伝達プロセスのこと。NF-κBは炎症反応に関わる転写因子の役割を持つタンパク質複合体である。
4.血小板由来成長因子受容体β(PDGFRβ)
主に心血管系の細胞増殖や遊走を調節する増殖因子である血小板由来成長因子(PDGF)が結合する受容体チロシンキナーゼ。受容体とは細胞外からのシグナル分子を選択的に受容するタンパク質、キナーゼとはリン酸基をターゲット分子に転移し、リン酸化する酵素のことをいう。PDGFRはPlatelet-Derived Growth Factor Receptorの略。
5.チロシンキナーゼ、受容体チロシンキナーゼ、スニチニブ
チロシンキナーゼは、アミノ酸の一種であるチロシンをリン酸化する酵素。受容体チロシンキナーゼは、細胞表面において、細胞外からのシグナル伝達分子を選択的に受け取り、受容体自身のチロシンを自己リン酸化する酵素のこと。このリン酸化によってさまざまな細胞内シグナル伝達経路が活性化され、通常の細胞の成長・増殖だけではなく、がん細胞の増殖において重要な役割を果たすことが示されている。スニチニブは、PDGFRβを中心とした複数の受容体チロシンキナーゼを阻害する薬剤であり、腎がんの治療に使われている。
6.くも膜下出血
脳血管の破裂により、血液が急激にくも膜下腔に流入した状態のこと。最も多い原因は、脳動脈瘤破裂である。
7.脳卒中疾患
脳梗塞(脳血管の詰まり)、脳出血(脳血管の破裂)、くも膜下出血(脳血管の破裂によるくも膜下腔への血液流入)が主な原因となり、脳に障害を起こす病気のこと。
8.ゲノムワイド関連解析
集団に存在する疾患などの形質とDNA多型(DNA配列の個体差)をゲノム全体にわたって調べ、検出されたDNA多型の頻度と対象とする形質との関係を統計的に解析する方法のこと。
9.巨大・大型血栓化紡錘状脳底動脈瘤
動脈瘤の最大径が10mm以上は大型動脈瘤、25mm以上のものを巨大動脈瘤と呼ぶ。動脈瘤壁内に血栓を伴ったものは血栓化動脈瘤と呼ばれ、動脈瘤の増大や破裂リスクを伴う場合がある。脳底動脈に発生した巨大・大型血栓化紡錘状脳底動脈瘤は増大・破裂リスクが高く、脳幹部への物理的圧迫、瘤の破裂によって致命的となるリスクが高い疾患である。
10.脳幹梗塞
脳の一番奥にある脳幹で起こる脳梗塞のこと。脳梗塞は、血栓や狭窄などにより血管が閉塞して起こる病気である。
11.脳幹機能不全
脳幹は、呼吸・循環など生命維持に不可欠な機能を担っている。脳幹機能不全に至ると意識障害、呼吸停止、心停止など重篤な状態に陥る。
12.次世代シークエンサー
DNAの塩基配列を解析する装置のこと。同時に複数のサンプルの配列を高速で決定できる。
13.パスウェイ解析
発現の増加や減少が見られる遺伝子群が、どのパスウェイ(複数の生体分子の相互作用から構成される生物学的な過程・経路)に多く含まれていたかを調べる解析方法のこと。
14.ペリサイト
血液と脳を分ける血液脳関門の一部で、バリア機能の維持と脳血流の制御を行う脳血管の外側を覆う細胞のこと。
15.自己リン酸化
プロテインキナーゼ(タンパク質をリン酸化する酵素)がキナーゼ自身にリン酸基を付加する化学反応のこと。
16.がんゲノム医療
がんの組織の遺伝子検査を行い、一人一人の遺伝子および関連する体質や病状に合わせて行う個別化医療のこと。
国際共同研究グループ
理化学研究所
脳神経科学研究センター
神経動態医科学連携研究チーム
チームリーダー 中冨 浩文(ナカトミ・ヒロフミ)
(杏林大学 医学部 脳神経外科学 教授)
上級研究員(研究当時)島 康之(シマ・ヤスユキ)
テクニカルスタッフⅠ(研究当時)小山 理恵子(オヤマ・リエコ)
客員研究員 太田 仲郎(オオタ・ナカオ)
(札幌禎心会病院 脳神経外科 副部長)
脳神経医科学連携部門
部門長 岡部 繁男(オカベ・シゲオ)
(東京大学大学院 医学系研究科 神経細胞生物学分野 教授)
研究基盤開発部門 生体物質分析支援ユニット
ユニットリーダー(研究当時)俣賀 宣子(マタガ・ノブコ)
副センター長 上口 裕之(カミグチ・ヒロユキ)
(神経細胞動態研究チーム チームリーダー)
生命医科学研究センター がんゲノム研究チーム
研究員 笹川 翔太(ササガワ・ショウタ)
チームリーダー 中川 英刀(ナカガワ・ヒデワキ)
テクニカルスタッフⅠ 前嶋 和紘(マエジマ・カズヒロ)
客員研究員 藤田 征志(フジタ・マサシ)
山梨大学 医学部 生化学講座第一教室
教授 大塚 稔久(オオツカ・トシヒサ)
特任助教 金 然正(Yeon-Jeong Kim)
札幌禎心会病院
脳疾患研究所
所長 上山 博康(カミヤマ・ヒロヤス)
脳卒中センター
センター長 谷川 緑野(タニカワ・ロクヤ)
脳神経外科
部長 野田 公寿茂(ノダ・コスモ)
順天堂大学大学院 医学研究科 気分障害分子病態学講座
主任教授 加藤 忠史(カトウ・タダフミ)
特任准教授 窪田 美恵(クボタ・ミエ)
研究員 川上 博哉(カワカミ・ヒロヤ)
神戸薬科大学 医療薬学研究室
教授 力武 良行(リキタケ・ヨシユキ)
特任助教 田中 亨(タナカ・トオル)
東京薬科大学 薬学部 個別化薬物治療学教室
教授 降幡 知巳(フリハタ・トモミ)
東京大学
医科学研究所
附属先端医療研究センター 先端がん治療分野
特任教授 田中 実(タナカ・ミノル)
アイソトープ総合センター
教授 和田 洋一郎(ワダ・ヨウイチロウ)
教授 秋光 信佳(アキミツ・ノブヨシ)
特任研究員 小林 美佳(コバヤシ・ミカ)
特任講師 田久保 直子(タクボ・ナオコ)
特任助教 尾関 温子(オゼキ・アツコ)
特任研究員(研究当時)シャオニン・スン(Xiaoning Sun)
大学院新領域創成科学研究科
メディカル情報生命専攻
複雑形質ゲノム解析分野
教授 鎌谷 洋一郎(カマタニ・ヨウイチロウ)
クリニカルシークエンス分野
教授 松田 浩一(マツダ・コウイチ)
大学院医学系研究科
分子細胞生物学専攻
代謝生理化学分野
教授 栗原 裕基(クリハラ・ヒロキ)
脳神経医学専攻 脳神経外科学分野
教授 齊藤 延人(サイトウ・ノブヒト)
杏林大学 医学部 脳神経外科学
教授 永根 基雄(ナガネ・モトオ)
病理学
教授 柴原 純二(シバハラ・ジュンジ)
筑波大学 トランスボーダー医学研究センター
センター長 高橋 智(タカハシ・サトル)
慶應義塾大学 医学部
臨床遺伝学センター
教授 小崎 健次郎(コサキ・ケンジロウ)
生理学教室
教授 岡野 栄之(オカノ・ヒデユキ)
株式会社 Rhelixa
代表取締役 仲木 竜(ナカキ・リョウ)
シンシナティ小児病院(財団グループ)(米国)医学部 神経生物学
教授 中福 雅人(ナカフク・マサト)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業基盤研究(C)「脳動脈瘤発生における血管壁を場とした炎症性カスケードの意義(19K09499、研究代表者:中冨浩文)」による助成を受けて行われました。
原論文情報
Yasuyuki Shima, Shota Sasagawa, Nakao Ota, Rieko Oyama, Minoru Tanaka, Mie Kubota-Sakashita, Hirochika Kawakami, Mika Kobayashi, Naoko Takubo, Atsuko Ozeki, Xiaoning Sun, Yeon-Jeong Kim, Yoichiro Kamatani, Koichi Matsuda, Kazuhiro Maejima, Masashi Fujita, Kosumo Noda, Hiroyasu Kamiyama, Rokuya Tanikawa, Motoo Nagane, Junji Shibahara, Toru Tanaka, Yoshiyuki Rikitake, Nobuko Mataga, Satoru Takahashi, Kenjiro Kosaki, Hideyuki Okano, Tomomi Furihata, Ryo Nakaki, Nobuyoshi Akimitsu, Youichiro Wada, Toshihisa Ohtsuka, Hiroki Kurihara, Hiroyuki Kamiguchi, Shigeo Okabe, Masato Nakafuku, Tadafumi Kato, Hidewaki Nakagawa, Nobuhito Saito, and Hirofumi Nakatomi, “Increased PDGFRB and NF-κB signaling caused by highly prevalent somatic mutations in intracranial aneurysms” for publication in Science Translational Medicine”, Science Translational Medicine, 10.1126/scitranslmed.abq7721
発表者
理化学研究所
脳神経科学研究センター 神経動態医科学連携研究チーム
上級研究員(研究当時)島 康之(シマ・ヤスユキ)
チームリーダー 中冨 浩文(ナカトミ・ヒロフミ)
(杏林大学 医学部 脳神経外科学 教授)
客員研究員 太田 仲郎(オオタ・ナカオ)
脳神経医科学連携部門
部門長 岡部 繁男(オカベ・シゲオ)
(東京大学大学院 医学系研究科 神経細胞生物学分野 教授)
生命医科学研究センター がんゲノム研究チーム
研究員 笹川 翔太(ササガワ・ショウタ)
チームリーダー 中川 英刀(ナカガワ・ヒデワキ)
東京大学大学院 医学系研究科 脳神経医学専攻 脳神経外科学分野
教授 齊藤 延人(サイトウ・ノブヒト)
山梨大学 医学部 生化学講座第一教室
特任助教 金 然正(Yeon-Jeong Kim)
教授 大塚 稔久(オオツカ・トシヒサ)
報道担当
理化学研究所 広報室 報道担当
東京大学医学部附属病院 パブリック・リレーションセンター
山梨大学 総務企画部総務課広報企画室
杏林学園 広報室