2024-01-05 理化学研究所
理化学研究所(理研)生命機能科学研究センター 栄養応答研究チームの小坂元 陽奈 基礎科学特別研究員、小幡 史明 チームリーダーらの共同研究チームは、ショウジョウバエ[1]を用いた研究で表皮での局所的なチロシン[2]分解が高タンパク質食への適応を可能にする機構を発見しました。
本研究成果は、チロシン代謝に関係する疾患機構の解明や病原菌を媒介する吸血昆虫の人為的コントロールに貢献すると期待されます。
チロシンは、神経伝達物質やメラニン[3]の前駆体となる重要なアミノ酸である一方、過剰に蓄積すると細胞に悪影響があります。そのため、体内のチロシン量は厳密に制御されており、大部分が常時分解されエネルギーとして使用されていることが知られています。しかし、チロシン分解代謝の制御機構についての理解は十分でありませんでした。
今回、共同研究チームは、ショウジョウバエのチロシン分解が表皮組織で特異的に行われていることを見いだしました。チロシン分解は、タンパク質摂取量に伴って変化するチロシン量の増減を感知することで、低タンパク質・高タンパク質摂取それぞれの状況に応じて異なる機構で制御されていることが分かりました。また、表皮でのチロシン分解ができない変異体ではタンパク質摂取過多のストレスに耐えられず、発生できなくなることが明らかとなりました。
本研究は、科学雑誌『Development』オンライン版(1月2日付)に掲載されました。
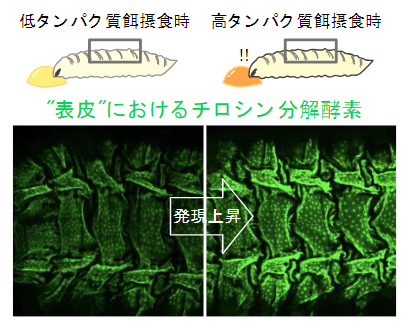
タンパク質摂食量に応答して表皮で変化するチロシン代謝酵素の発現
背景
生物は、栄養環境の変動に適応するために代謝応答を変化させることができます。栄養感知と代謝変化には多数の臓器が関わっており、主な代謝組織である肝臓や脂肪組織、食餌成分と直接接して栄養成分を検出する腸、全身に向けて代謝適応の指令を出す脳などの関与メカニズムについて知見が蓄積してきています。しかし、その他の末梢組織における代謝恒常性維持機構については未解明な部分が多く残されています。
表皮は外界から生物を保護するためのバリアであり、外骨格を持つ昆虫にとっては体のサイズを規定する組織です。広い表面積を持つ表皮は、効率的に体液成分の変化を読み取り栄養状態を感知するのにも適した組織であるため、「表皮における栄養感知機構」があるのではないかと考えられます。少なくとも表皮において、栄養依存的なシグナル伝達機構が機能し細胞の大きさが決定されることが知られていますが、栄養素の変化を感知する仕組みや、この組織が全身的な代謝恒常性に寄与する可能性についてはこれまで検証されていませんでした。
本研究では、モデル生物であるショウジョウバエを用いて、食餌変化に対する表皮の代謝応答のメカニズムや、その意義の解明を試みました。
研究手法と成果
本研究ではまず、表皮が栄養環境の変化にどのように応答するかを明らかにするため、食餌中タンパク質量を変化させたときにショウジョウバエ幼虫の体表組織で発現する遺伝子の転写応答をRNAseq[4]によって網羅的に解析しました。その結果、タンパク質摂取量が増えるに従って、芳香族アミノ酸[2]のフェニルアラニン[2]やチロシンの分解を担う遺伝子の発現が上がることを見いだしました(図1A)。この分解経路は多段階の酵素反応によって担われますが、その多くがタンパク質摂取量に鋭敏に応答しました。特に発現変動の大きかったチロシン分解酵素4-ヒドロキシフェニルピルビン酸ジオキシゲナーゼ(Hpd)[5]に着目し、その発現を簡便に可視化できる蛍光レポーター系統[6]を作製しました。このレポーター系統を用いることで、タンパク質摂取量に応じて幼虫体表でHpdの発現が変化する様子を蛍光強度の変化として簡便に捉えることができるようになりました(図1B)。
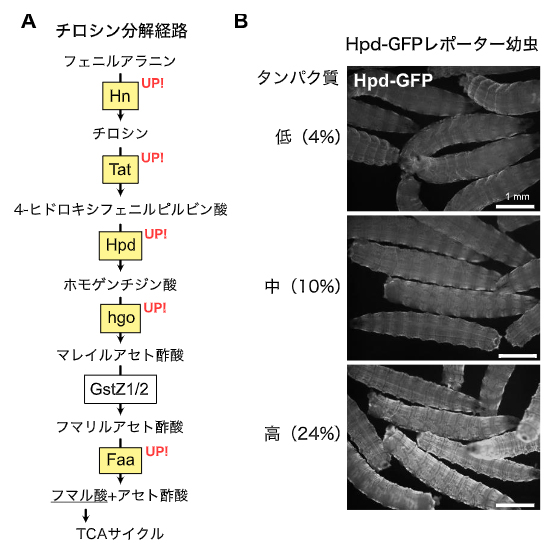
図1 チロシン分解酵素群、特にHpdの発現上昇
A)チロシン分解経路とそのタンパク質摂取量に対する変化。RNAseqの結果、幼虫の表皮において黄色で示した酵素群の発現が上昇した。
B)Hpd-GFPレポーターのタンパク質摂取量に対する蛍光変化。タンパク質量が増加するに従ってGFP蛍光の上昇が見られた。また、その発現部位が体表に出ていることを確認した。
詳細な発現パターン解析から、Hpdの発現は表皮にのみ限局しており、腸や脂肪組織、脳などには発現していないことが分かりました(図2A)。このような表皮での特異的なアミノ酸代謝については、これまであまり報告がなかったため、Hpdの制御機構を調べることで表皮での栄養応答の仕組みに迫ろうと考えました。
タンパク質摂取量の変化は、体内のアミノ酸量を変化させていると想定されます。そこで次に、Hpdの発現変動がどのアミノ酸に応答して起こるのかを検証しました。その結果、食餌にチロシンを添加したときのみHpdの発現が上昇し、他のアミノ酸添加では変化しませんでした(図2B)。このことから、チロシン量を感知した表皮が、Hpdを誘導するメカニズムを有していることが示唆されました。
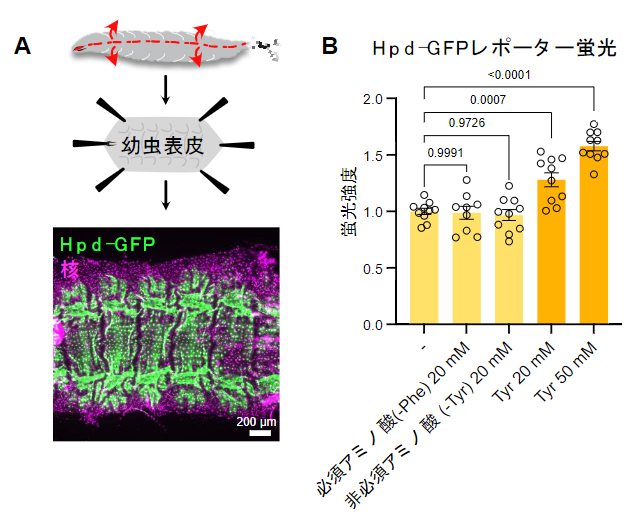
図2 Hpdの表皮での発現パターンとチロシン添加への応答
A)幼虫表皮におけるHpd-GFPレポーターの発現パターン。幼虫を腹側で切り開いてシート状に広げ、発現部位の詳細な観察を行い、表皮にのみHpdが発現していることを見いだした。
B)アミノ酸摂取によるHpd-GFPレポーター蛍光の変化。対照群(-)に比べて、フェニルアラニン(Phe)(チロシンの前駆体)以外の必須アミノ酸、あるいはチロシン(Tyr)以外の非必須アミノ酸を20mM加えてもレポーター蛍光は上昇しなかったが、チロシン(20mM、50mM)を加えると用量依存的に蛍光が上昇した(単位mMはmmol/L(ミリモル毎リットル))。
このようなチロシンによるHpd誘導の生理的な意義を明らかにするために、Hpdの機能を抑制した個体に高タンパク質の餌を摂取させたときの体内のチロシン量を分析しました。その結果、本来ならばタンパク質摂取量が変化しても体内チロシン量を保てるはずが、Hpd抑制個体ではチロシンレベルが大幅に上昇することが分かりました(図3A)。さらに、タンパク質摂取量の増加に応じて幼虫の致死率が上がることも見いだしました(図3B)。また、Hpd誘導に関わる分子メカニズムについて遺伝学的な解析を行った結果、AMPK[7]というタンパク質リン酸化酵素とFoxO[8]という転写因子がHpd誘導を担っていることが判明しました(図4)。これらは一般に栄養飢餓時に活性化すると考えられていた因子ですが、本研究によりタンパク質過多のストレスによっても誘導されることを見いだしました。一方、低タンパク質下でのHpd抑制メカニズムには、インスリンシグナル経路[9]が関与することも示唆され、チロシン量に応じた複雑な栄養応答機構が明らかになりました(図4)。
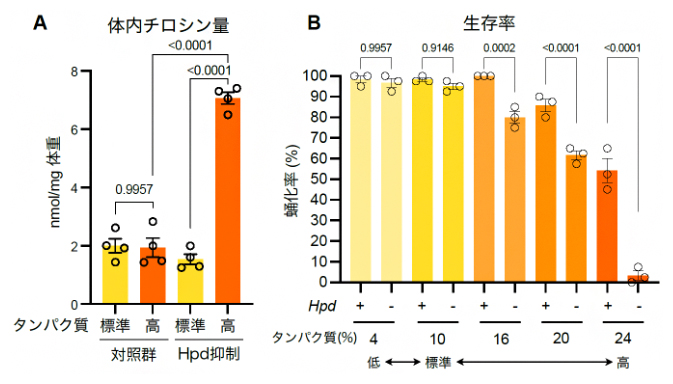
図3 Hpd誘導によるタンパク質過多ストレスの回避
A)タンパク質摂食時の体内チロシン量の変化。Hpdの発現を抑制すると、本来タンパク質摂取量が増えても一定に保たれるはずの体内チロシン量が大幅に増加する。
B)Hpd欠損個体におけるタンパク質過多ストレス下での生存率。Hpd欠損個体では、タンパク質摂取量が増えるに従って幼虫が蛹(さなぎ)になる比率が著しく低下する。
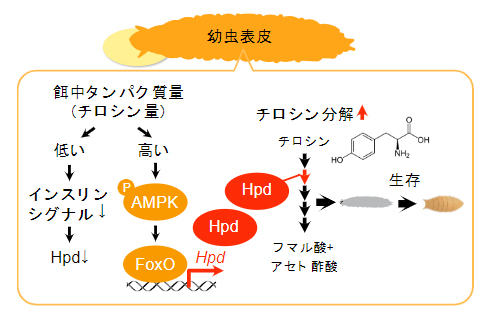
図4 表皮でのHpd誘導メカニズムのまとめ
幼虫の表皮においてチロシン分解機構が特異的に機能しており、タンパク質摂取量が増えるに従って増加する体内チロシン量を感知してチロシン分解を促進する。チロシン分解酵素の一つであるHpdはAMPKとFoxOによって制御されており、この発現上昇がタンパク質過多ストレスを回避して適応生存するのに欠かせない。
今後の期待
チロシンの分解は、吸血昆虫が血液中の多量のアミノ酸に対処するために重要であることが知られています。本研究はこのチロシン分解機構が表皮で特異的に行われていることや、その制御機構を明らかにしました。Hpdの機能は通常レベルのタンパク質を摂取している場合には生存に必須ではない一方で、高タンパク質食を摂取している場合にはなくてはならないものです。従って、Hpdやその制御機構をかく乱することで、病原体を媒介する性質を持つ吸血昆虫の生存を特異的に抑制し、病気の感染拡大を防ぐことにもつながる可能性があります。
また、チロシン分解経路の発現が低下している患者はがんの予後が悪い、あるいは化学療法に対する抵抗性があるといった報告もあり、適切なチロシン分解の制御はヒトの健康にとっても重要であると考えられます。本研究で解明したチロシン分解機構を薬剤などの使用によりうまく制御することで、効率的な疾患治療の可能性が開けると期待されます。
補足説明
1.ショウジョウバエ
ショウジョウバエは、体長2~3mm前後の大きさで、飼育が容易であり、遺伝学的な解析に優れていることから、さまざまな研究分野でモデル生物として用いられている。合成餌の利用が可能であり、栄養代謝生理学のモデルとしても重宝されている。
2.チロシン、芳香族アミノ酸、フェニルアラニン
チロシンは、非必須(可欠)アミノ酸の一つ。必須アミノ酸であるフェニルアラニンから合成される(図1A参照)。芳香族アミノ酸は残基に芳香族基を持つアミノ酸で、チロシン、フェニルアラニンの他、トリプトファン、ヒスチジンがある。
3.メラニン
チロシナーゼなどの酵素によりチロシンから生成される。
4.RNAseq
細胞や組織から抽出したRNAからcDNA(逆転写の結果得られたDNA)を合成し、次世代シーケンサーを用いてその細胞・組織で存在しているRNAの配列や量の情報を網羅的に解析する手法。
5.4-ヒドロキシフェニルピルビン酸ジオキシゲナーゼ(Hpd)
チロシン分解の二段階目を担う酵素。不可逆的に4-ヒドロキシフェニルピルビン酸をホモゲンチジン酸に変換する。ヒトでは主に肝臓で発現している。
6.蛍光レポーター系統
蛍光タンパク質の遺伝子をゲノムに組み込むことで、特定の組織や細胞を光らせるようにした系統。本研究では、HpdのC末側に緑色蛍光タンパク質を融合させるゲノム編集を行った。
7.AMPK
AMPKは細胞内シグナル伝達系に関わるタンパク質リン酸化酵素の一つ。細胞内のエネルギー源の枯渇に応答して活性化され、ミトコンドリア代謝の上昇などによりエネルギー産生量を増やすなどの働きを持つ。AMPKは5′-adenosine monophosphate-activated protein kinaseの略。
8.FoxO
フォークヘッド型転写因子ファミリーのサブグループOに属する転写因子。ヒトには四つ(FOXO1、FOXO3、FOXO4、FOXO6)、ショウジョウバエには一つ(FoxO)存在する。ヒトから線虫まで遺伝子構造、機能ともによく保存されており、代謝、寿命、ストレス応答、細胞死に関わるさまざまな遺伝子の転写を直接的に制御することが知られている。FoxOはForkhead box Oの略。
9.インスリンシグナル経路
脊椎動物から無脊椎動物まで広く存在するシグナル経路で、成長・代謝・寿命など多様な機能に関わる。ショウジョウバエでは体液中に分泌されたインスリン様ペプチドが標的細胞の細胞膜上にある受容体に結合し、細胞内にシグナルを伝達することで始まる。
共同研究チーム
理化学研究所 生命機能科学研究センター 栄養応答研究チーム
基礎科学特別研究員 小坂元 陽奈(コサカモト・ヒナ)
チームリーダー 小幡 史明(オバタ・フミアキ)
東京大学 大学院薬学系研究科 遺伝学教室
教授 三浦 正幸(ミウラ・マサユキ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、主に日本医療研究開発機構(AMED)健康・医療の向上に向けた早期ライフステージにおける生命現象の解明「発生期環境による寿命制御機構の解明(研究代表者:小幡史明)」、および日本学術振興会(JSPS)科学研究費助成事業基盤研究(B)「神経の栄養プログラミング機構の解明(研究代表者:小幡史明)」「排出を起点とした代謝恒常性制御機構の遺伝学的解析(研究代表者:小幡史明)」、同研究活動スタート支援「タンパク質飢餓への適応を可能とするチロシンセンシングの分子機構の解明(研究代表者:小坂元陽奈)」、科学技術振興機構(JST)ACT-X「内在及び人工アミノ酸センサーの同定と開発(研究代表者:小坂元陽奈)」の助成により行われました。また、JSPS科学研究費助成事業基盤研究(S)「細胞死を起点とした細胞外コミュニケーションの発動と生理機能(研究代表者:三浦正幸)」、同基盤研究(A)「個体ごとの表現型を決める非細胞死カスパーゼ活性化機構の解明(研究代表者:三浦正幸)」、同挑戦的研究(萌芽)「遺伝情報を拡大する翻訳時のタンパク質多様性産生のメカニズムと生理機能(研究代表者、三浦正幸)」による助成を受けて行われました。
原論文情報
Hina Kosakamoto, Masayuki Miura, Fumiaki Obata, “Epidermal tyrosine catabolism is crucial for metabolic homeostasis and survival against high-protein diets in Drosophila”, Development, 10.1242/dev.202372
発表者
理化学研究所
生命機能科学研究センター 栄養応答研究チーム
基礎科学特別研究員 小坂元 陽奈(コサカモト・ヒナ)
チームリーダー 小幡 史明(オバタ・フミアキ)
報道担当
理化学研究所 広報室 報道担当