腎臓移植の新しい可能性を示唆
2019-02-06 自然科学研究機構 生理学研究所,東京大学 医科学研究所,日本医療研究開発機構,科学技術振興機構
ポイント
- Sall1欠損ラット胚盤胞にマウスES細胞を顕微注入することで、ラットとマウスのキメラ個体が得られ、その体内にはマウスES細胞由来の腎臓が形成された。
- 再生腎のネフロンは、マウスES細胞由来の細胞で構成されていたが、集合管や血管はマウスとラットの両方の細胞からできていた。
- 異種胚盤胞補完法によって糖尿病治療に利用できる膵臓(膵島)の再生成功例はあるが、より複雑な構造を持つ腎臓への適用は世界初。
腎臓移植は、腎不全患者に対する有効な治療法であるものの、慢性的なドナー注1)不足となっているのが現状です。問題解決へ向けて、現在世界的に試験管内でヒト人工多能性幹細胞注2)(induced Pluripotent Stem cells:iPS細胞)から腎臓を作ろうと試みられていますが、立体的、かつ移植に適したサイズの腎臓を作製するまでには至っていません。今回、自然科学研究機構 生理学研究所の後藤 哲平 特任研究員、小林 俊寛 助教、平林 真澄 准教授らの研究グループは、東京大学 医科学研究所の中内 啓光 特任教授らや信州大学 繊維学部の保地 眞一 教授との共同研究によって、「異種胚盤胞補完法注3)」という特殊な方法を用いて、腎臓が欠損したラットの体内に、マウスの胚性幹細胞(Embryonic Stem Cell:ES細胞)に由来する、マウスサイズの腎臓を作製することに世界で初めて成功しました。今回の成果は、異種胚盤胞補完法により腎臓の作製が可能であることを科学的に示しており、この手法によってヒト腎臓が作製され、実際に移植医療の現場で実用される可能性を示しています。
本研究結果は、2019年2月6日(日本時間)「Nature Communications」にオンライン掲載されます。
本研究は文部科学省 科学研究費補助金、日本医療研究開発機構 革新的先端研究開発支援事業 インキュベートタイプ(LEAP)「発生原理に基づく機能的立体臓器再生技術の開発」における分担研究「小動物胚盤胞補完により異種の体内で再生する臓器の機能検証」(研究開発担当者:平林 真澄)、および自然科学研究機構「若手研究者による分野間連携研究プロジェクト」(研究代表者:後藤 哲平)の助成を受けて行われました。なお、本研究成果に関わる基盤的な知見は科学技術振興機構(JST) 戦略的創造研究推進事業 総括実施型研究(ERATO)中内幹細胞制御プロジェクト(研究総括:中内 啓光、平成24年度終了)から得られたものです。
わが国で糖尿病腎症や慢性糸球体腎炎などの疾患により、長期的に透析治療を続けている患者総数は約33万人にも上り、年々増加の傾向にあります。このような慢性腎不全の根本的治療には生体腎移植がもっとも有効とされていますが、腎移植希望患者数は12,000人を超え、ドナーの数が絶対的に不足しています(実際に移植を受けられる患者は総希望者数のわずか1〜2パーセント程度)。この状況を鑑み、慢性的なドナー腎不足の解決に向けて、試験管内でヒト人工多能性幹細胞(induced Pluripotent Stem cell:iPS細胞)から腎臓を作り出す試みが続けられていますが、今日までに立体的、かつ移植に適したサイズの腎臓を作製するには至っていません。今回、自然科学研究機構 生理学研究所の後藤 哲平 特任研究員、小林 俊寛 助教、平林 真澄 准教授らの研究グループは、東京大学 医科学研究所の中内 啓光 特任教授らや信州大学 繊維学部の保地 眞一 教授との共同研究によって、臓器の形成に不可欠な遺伝子(Sall1遺伝子注4))を欠損させた動物個体を作製し、その体内に目的とする臓器ができるはずだったニッチ(「空き」のある場所、の意味)を作りました。このような個体は、生きていくのに必要な臓器が欠けているので出生後は生きていくことができません。そこで着床前の受精卵に、多能性幹細胞であるES細胞やiPS細胞を注入することで、ES細胞やiPS細胞がその“空き”を補完します。すると出生後には、体内でES細胞/iPS細胞由来の臓器を作製することができるのです。この手法は「胚盤胞補完法」といい、本研究グループはすでにこれまでにも膵臓が欠損したマウスの体内でラットのiPS細胞由来の膵臓を作製できることを示していました(論文情報:Kobayashi et al., Cell, 2010)。さらに、膵臓の欠損したラットの体内で、マウスのiPS細胞由来の膵臓を作製し、その細胞の一部を糖尿病に罹患したマウスへ移植することで血糖値を正常化できることを見いだすなど、異種間における胚盤胞補完法によって作製した臓器が、移植医療に貢献できることを実証してきました(論文情報:Yamaguchi et al., Nature, 2017)。
今回本研究グループは、これまでに試みられてこなかった腎臓という大型主要臓器の再生に挑戦し、そして世界で初めて成功しました。この成果は、移植臓器を作製する再生医療の発展に大きく貢献すると期待されます。
これまで膵臓の作製に有効であった「異種胚盤胞補完法」によって、腎臓を欠損させたマウスの体内に、ラットのiPS細胞由来の腎臓を作製しようとした先行研究は失敗に終わってきましたが、なぜ失敗するのか、その理由すらよく分かっていませんでした。今回研究グループは、ラットのES細胞を用いてマウスの胎仔の体内にラットの腎臓を作製する際、腎臓を構成する小器官であり、血液中の水分のろ過や、再吸収を行う腎小体(ネフロン注5))の元となる「後腎間葉注6)」がほとんど作られていないことを発見しました。一方で、ラット胎仔の体内の後腎間葉には、マウスのES細胞由来の細胞が、一定の割合で存在していました(図1)。つまり、マウス胎仔の体内では、ラットのES細胞由来の後腎間葉は作られませんでしたが、ラット胎仔の体内では、マウスのES細胞由来の後腎間葉が作られることが分かったのです。そこで研究グループは、腎臓を欠損させたラットの体内ならば、マウスのES細胞由来の腎臓が作製できるのではないか、と仮説を立てました。
研究グループは、腎臓を作る上で不可欠なSall1遺伝子が欠損したラットの受精卵にマウスのES細胞を数個注入し、ラットとマウス両方の遺伝情報を持つキメラ注7)個体を作製しました。そのような手順で「胚盤胞補完法」を行ったところ、腎臓が欠損したキメラ個体の体内に、マウスES細胞に由来する腎臓を作製(再生)することができました(図2)。
一般的に腎臓は、血液中の老廃物をろ過し、体外に排出を行う臓器です。このろ過の作業は、ネフロンを構成する組織の1つである糸球体で行われます(ろ過された体液を原尿という)。ろ過したての原尿には、栄養分やタンパク質、水分、ナトリウムが含まれ、尿細管で再度血液中へ吸収されます。こうして濃縮された尿が集合管へ集まり、腎盂から尿管を通って最終的に膀胱へ蓄えられます。同時に、尿細管と近接する毛細血管網から、一部の老廃物が直接尿中へと分泌されます。マウスのES細胞から作製された、再生腎臓の組織を詳しく解析したところ、ネフロンを構成する組織のうち、糸球体上皮、近位尿細管、ヘンレループ、遠位尿細管が、マウスのES細胞由来の細胞で構成されていました(図3)。しかし、糸球体の中の血管や、尿細管を取り巻く血管網、原尿を集める集合管、そしてネフロン同士の間を埋める間質組織は、マウスの細胞とラットの細胞が混在したキメラ状態でした。今後は、これらのキメラ状態のままとなっていた組織についても、多能性幹細胞由来の細胞で構成された組織になるよう、さらなる改良が必要です。将来的に、全ての組織が多能性幹細胞由来の細胞で作製することができれば、免疫抑制剤を過度に使用しないで済む、より負担の少ない移植用ドナー腎を作製することにつながります。
異種胚盤胞補完法によって腎臓の作製が可能であることを科学的に証明できました。今後、生命倫理についての議論や、法律の整備が必要となることが予想されますが、将来的に異種胚盤胞補完法によって作製されるヒト腎臓が、移植医療の場へ提供されるようになると期待されます。
![]()
図1 異種キメラ体内においてマウスES細胞はラットES細胞と比較すると後腎間葉に分化しやすい。
異種キメラ体内のSall1を発現する後腎間葉の細胞のうちES細胞から分化した細胞の割合を求めたところ、ラットES細胞由来は全後腎間葉の細胞のわずか4パーセントであったのに対し、マウスES細胞由来は38パーセントであった。これは、マウスES細胞がラットES細胞と比較して、有意に後腎間葉へ分化しやすい(図中のアスタリスクは統計的に有意である)ことを示す。
![]()
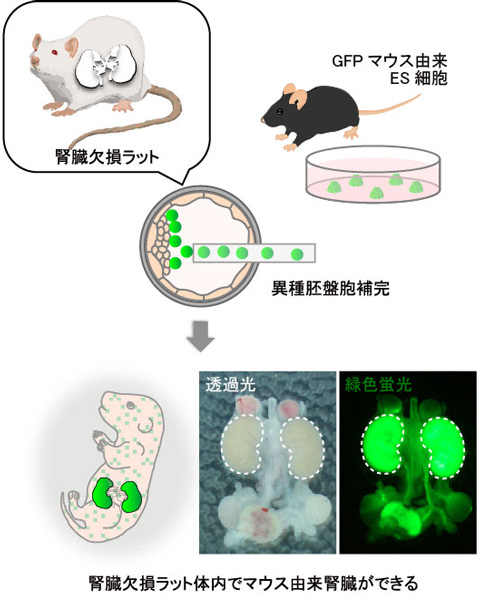
図2 胚盤胞補完法の適用により腎臓欠損ラット体内にマウスES細胞由来の腎臓を作製できた。
腎臓欠損となる運命のラット胚盤胞にGFPマウス注8)由来ES細胞を顕微注入する異種胚盤胞補完を行ったところ、腎臓欠損ラット体内にGFP陽性のES細胞由来の腎臓が形成されていた。図中の点線は腎臓を示す。
![]()
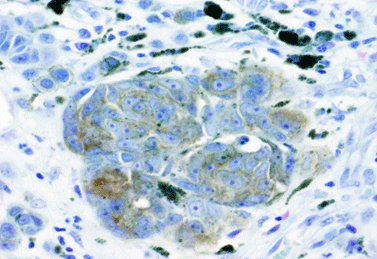
図3 再生腎臓のネフロンはマウスES細胞由来だった。
腎臓におけるネフロンおよび集合管の模式図。異種胚盤胞補完によってSall1遺伝子欠失による腎臓欠損ラット体内で作製されたマウスES細胞由来の腎臓のうち、糸球体上皮細胞、尿細管、ヘンレループ、といったネフロン構成要素がマウスの細胞(緑色で示した)で構成されていた。一方、血管や集合管はマウスの細胞とラットの細胞が混じったキメラ状態だった。
- 注1)ドナー
- 臓器や胚を提供する人や動物。
- 注2)多能性幹細胞
- 人工的に構成された培養条件下で無限の増殖能を持ち、生体の全ての組織の細胞に分化が可能な細胞。多能性幹細胞のうち、受精卵に含まれる細胞を培養した細胞を「胚性幹細胞(ES細胞)」、体細胞に遺伝子を導入することで人工的にES細胞と同等の能力を持った細胞を「人工多能性幹細胞(iPS細胞)」という。
- 注3)胚盤胞補完法
- 臓器がない(作られない)特殊な環境を動物体内に誘導し,この空間を多能性幹細胞の増殖・分化の場として活用し、多能性幹細胞由来の臓器を形成させる方法。
- 注4)Sall1遺伝子(spalt like transcription factor 1)
- 腎臓発生に必須な遺伝子。腎臓以外に肝臓、手指、耳、肛門、脳を含む多くの組織で発現している。
- 注5)ネフロン
- 腎臓の最小機能単位。人では左右両腎臓を合わせて約200万個存在し、各ネフロンでろ過、再吸収、分泌、濃縮が行われ、尿を生成する。
- 注6)後腎間葉
- 腎臓は後腎間葉と尿管芽という2つの胎仔組織の相互作用によって形成され、前者からネフロンが作られる。後腎間葉の中にSall1陽性のネフロン前駆細胞が存在する。
- 注7)キメラ
- 遺伝的背景の異なる2つ以上の細胞によって構成された1つの動物である。受精卵同士を集合させる、あるいは受精卵へ多能性幹細胞を注入することによって作出できる。
- 注8)GFPマウス
- オワンクラゲが持つ緑色蛍光タンパク質(GFP:Green Fluorescent Protein)の遺伝子を導入されたトランスジェニックマウスで、各種細胞のレポーターとして利用されている。
タイトル:“Generation of pluripotent stem cell-derived mouse kidneys in Sall1-targeted anephric rats”
著者名:Teppei Goto, Hiromasa Hara, Makoto Sanbo, Hideki Masaki, Hideyuki Sato, Tomoyuki Yamaguchi, Shinichi Hochi, Toshihiro Kobayashi, Hiromitsu Nakauchi & Masumi Hirabayashi
DOI:10.1038/s41467-019-08394-9
平林 真澄(ヒラバヤシ マスミ)
自然科学研究機構 生理学研究所 行動・代謝分子解析センター 遺伝子改変動物作製室 准教授
小林 俊寛(コバヤシ トシヒロ)
自然科学研究機構 生理学研究所 行動・代謝分子解析センター 遺伝子改変動物作製室 助教
後藤 哲平(ゴトウ テッペイ)
自然科学研究機構 生理学研究所 行動・代謝分子解析センター 遺伝子改変動物作製室 特任研究員
日本医療研究開発機構 基盤研究事業部 研究企画課
科学技術振興機構 研究プロジェクト推進部
自然科学研究機構 生理学研究所 研究力強化戦略室
科学技術振興機構 広報課