2021-09-15 東京大学,日本医療研究開発機構
発表者
宮﨑 徹(東京大学大学院医学系研究科 附属疾患生命工学センター 分子病態医科学部門 教授)
新井 郷子(東京大学大学院医学系研究科 附属疾患生命工学センター 分子病態医科学部門 准教授)
前原 奈都美(東京大学大学院医学系研究科 附属疾患生命工学センター 分子病態医科学部門 助教)
発表のポイント
- 脳梗塞発症に伴い、健常時ほとんど存在しない脳内のapoptosis inhibitor of macrophage(AIM:注1)の発現が急速に高まることを発見した。
- AIMは、マウス脳内の梗塞巣において、壊死した神経細胞や、死細胞から放出され炎症を引き起こすdamage associated molecular patterns(DAMPs:注2)に結合し、それらの除去・不活化を促進することによって、脳梗塞発症後の生存率や神経症状を改善することを見出した。
- マウスの脳梗塞発症後に一日一回組換えAIMタンパク質を経静脈的に投与することで予後の改善がみられたことから、これまで超急性期の血栓溶解療法や脳圧を低下させる対症療法しかなかった脳梗塞に対して、AIMが新しい効果的な治療法となることが期待される。
発表概要
脳梗塞では、虚血による最初の脳神経細胞壊死に続く持続性の無菌性炎症の波及が脳の傷害を拡大し、脳梗塞患者の予後に大きく関与することが近年知られている。しかし、脳梗塞の治療法としては、超早期の血栓溶解療法を除くと、脳圧の低下を目的としたデキストランや濃グリセリン溶液の補液等の対症療法しかなく、前述の無菌性炎症を標的としたものを含め、効果的な治療法はほとんどない。
今回、東京大学大学院医学系研究科の宮﨑徹教授らのグループは、脳梗塞を発症させたマウスを用いた研究により、①脳梗塞発症に伴い、脳内のミクログリアや浸潤したマクロファージ(注3)によってAIMが産生されること、そしてこれは、ヒトの脳梗塞患者の脳内でも同様であること、②AIMは、壊死した脳神経細胞や、無菌性炎症の原因となる、死細胞から放出されたDAMPsに結合し、マクロファージによるこれらの除去を亢進させること、③さらに一部のDAMPsはAIMの結合により炎症惹起能力が抑制(中和)されること、④こうした効果により、AIMは脳内での無菌性炎症を抑制し、脳梗塞後の生存率や神経症状を有意に改善させること、⑤梗塞後1日1回組換えAIMタンパク質を経静脈的に投与すると、梗塞後の予後を有意に改善させること、を明らかにした(図1)。
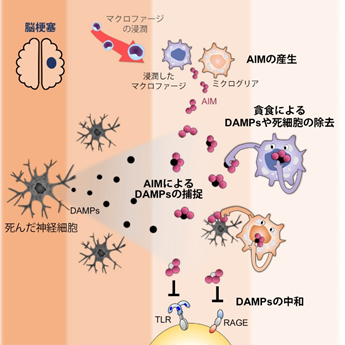
図1:脳梗塞の予後を改善するAIMの機能のまとめ。脳梗塞発症に伴い、脳内のミクログリアと浸潤したマクロファージがAIMを産生する。AIMは梗塞によって死んだ神経細胞から放出された炎症性のDAMPsに結合し、それらの貪食除去を促進するとともに、炎症惹起能力を中和する。こうしたAIMの効果により、脳内の無菌性炎症が抑制され予後が改善する。
これらの発見により、AIMが、今まで効果的な治療法がほぼなかった脳梗塞に対する新しい治療法となりえることが期待され、今後も患者数が増加することが予測される脳梗塞による医療財政への負担を軽減させ得る可能性もあり、その社会的インパクトは大きいと考えられる。
なお、本研究は、国立研究開発法人日本医療研究開発機構革新的先端研究開発支援事業インキュベートタイプ(LEAP)の一環として行われた。本研究成果は、2021年9月14日(米国東部時間)に「Cell Reports」オンライン版で公開されました。
発表内容
脳梗塞は、高い死亡率と重度の障害を残す疾患であり、近年、生活習慣・食習慣の急激な変化に伴い、生活習慣病とともに患者数も上昇している。また最近では、新型コロナ感染症の合併症としても知られている。脳血管が血栓によって閉塞することにより脳神経細胞の壊死を生じ、壊死した神経細胞から放出されるDAMPsによって持続性の無菌性炎症が生じ、周辺の脳組織にも傷害が広がることにより、患者予後を悪化させることが最近の研究から明らかになっている。そこで、梗塞後の無菌性炎症をいかに抑えるかが、脳梗塞の治療法戦略として注目されている(文献1)。しかしながら、脳梗塞の治療法は、超早期の血栓溶解療法を除くと、脳圧低下を目的としたデキストランや濃グリセリン溶液の補液等の対症療法しかなく、前述の無菌性炎症を標的としたものを含め、いまだ効果的な治療法はほとんどないといえる。
東京大学大学院医学系研究科の宮﨑徹教授らのグループが以前発見した血中タンパク質AIM(文献2)は、組織マクロファージの産生する血中タンパク質であり、これまで宮﨑教授のグループを中心に、腎疾患、脂肪肝、肝臓癌、肥満、真菌性腹膜炎、多発性硬化症など様々な疾患に対し抑制的な効果をもち、幅広い疾患に対する新規治療剤となる可能性を、主に動物実験で明らかにしている(文献3ー8)。健康時には、AIMは血中でIgM五量体と結合し不活性型として高い濃度(ヒトで5μg/mL程度)でストックされており、疾患発症に伴いIgM(注4)から解離し、活性型のAIMとして疾患治癒を促進することが知られている(文献9)。
このように、AIMが様々な疾患に対し治療効果を持つ可能性があることから、今回、宮崎教授のグループは、脳梗塞を発症させたマウスを用いて、AIMの脳梗塞に対する効果を検証した。興味深いことに、健常時には、脳内でのAIM産生はほとんどなく、また血中に高濃度で存在するAIMも脳血流関門(BBB)によって遮断されているため、脳組織内にAIMは存在しない。しかし、脳梗塞発症に伴い、脳内のミクログリアや梗塞巣に浸潤したマクロファージによってAIMが産生され、脳内のAIM量は顕著に増加することを確認した(図2)。脳内で産生されたAIMは、梗塞により壊死した神経細胞に結合し、マクロファージによる死細胞デブリの貪食を促進していることが明らかになった。こうした現象は、ヒトの脳梗塞患者の脳内でも起こっていることも見出した。
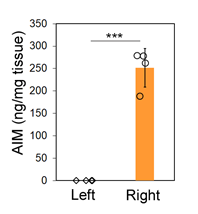
図2:脳梗塞発症に伴う脳内AIM量の増加。脳梗塞を発症した側(Right)と発症していない側(Left)のマウス(梗塞発症7日目)の脳組織を溶解し、ELISA法によりAIM量を測定した。梗塞側では健常側に比べて、AIM量が有意に増加した。
さらに、AIMは様々なDAMPsと結合し、そのマクロファージによる貪食除去を促進することが明らかとなった。実際に、AIMを欠損したマウス(AIMノックアウトマウス)において、梗塞後の脳内のDAMPsが野生型マウスより有意に多く、梗塞後の脳内の炎症が野生型マウスより重度となることを確認した。DAMPsは、マクロファージ細胞表面に存在するToll様受容体(TLR)やRAGE(注5)といった受容体に結合し、インターロイキン1β(IL-1β)やインターロイキン6(IL-6)などの炎症性サイトカインの発現を惹起する(文献1)ことが知られているが、一部のDAMPsでは、AIMと結合することでTLRやRAGEへの結合が抑制されることも分かった。このように、AIMがDAMPs除去を亢進し、またDAMPsの持つ炎症惹起能力を抑制(中和)する結果、梗塞に伴って脳内のAIMが増加する野生型マウスにおいて、AIMノックアウトマウスより梗塞後の生存率は有意に高く、神経症状も改善することが分かった。
さらに、本研究グループは、AIMのDAMPsに対する結合様式についても検討した。その結果、AIMが持つ3つのシステインリッチドメイン(SRCRドメイン)の2番目のドメインに存在するフリーのシステイン残基と、AIMのC末端側の3番目のドメイン内に存在する正に荷電したアミノ酸のクラスターの2か所でDAMPsに安定的に結合していることが明らかになった。興味深いことに、その2か所の結合部位は、以前明らかにしたIgM五量体との結合に用いられる部位と同じであり(文献9)、それゆえ、IgM五量体に結合したAIMは、DAMPsに結合できない不活性型であることが判明した。
最後に、本研究グループは、AIMの経静脈的投与が脳梗塞に対して治療効果を持つかについてマウスを用いて検討した。健常時には、血中のタンパク質の脳組織への移動はBBBにより遮断されているが、脳梗塞後一定時間は、BBBが傷害を受けており、タンパク質の移動が可能になることが知られている(文献10)。そこで、野生型マウスおよびAIMノックアウトマウスに脳梗塞を発症させ、翌日から一日一回500μgの組換えAIMを投与したところ、投与した組換えAIMはBBBを越えて脳内に到達し、DAMPsの減少と炎症の低下を誘導した。その結果、発症7日目における生存率と神経症状が、両方のマウスで顕著に改善した(図3)。以上のように、AIMはDAMPsによる無菌性炎症を抑制することによる、脳梗塞の新しい治療法として期待できることが示唆された。
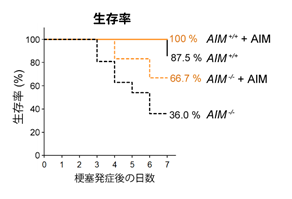
図3:AIMによる脳梗塞後の生存率の改善。野生型マウス(AIM+/+)およびAIM欠損マウス(AIM-/-)に脳梗塞を発症させ、500μgの組換えAIMもしくは同容量のphosphate buffer saline(リン酸緩衝食塩水、コントロール)を一日一回経静脈的に投与した。発症7日目までの生存率を示す。
図2、3は本論文より改訂引用。
文献
- Gülke, E. et al. Ther. Adv. Neurol. Disord. 11: 1756286418774254(2018).
- Miyazaki, T. et al. J. Exp. Med. 189: 413-422(1999).
- Arai, S. et al. Cell Rep. 3: 1187-1198(2013).
- Arai, S. et al. Nat. Med. 22: 183-193(2016).
- Kurokawa, J. et al. Cell Metab. 11: 479-492(2010).
- Maehara, N., et al. Cell Rep. 9: 61-74(2014).
- Tomita, T. et al. Sci. Rep. 25: 6450(2017).
- Wang, C. et al. Cell. 163: 1413-1427(2015).
- Hiramoto, E. et al. Science Adv. 4: eaau1199(2018).
- Choi, K.H. et al. Oncotarget. 7: 67857-67867(2016).
発表雑誌
- 雑誌名
- Cell Reportsオンライン版(2021年9月14日)
- 論文タイトル
- AIM/CD5L attenuates DAMPs at the injured brain and thereby ameliorates ischemic stroke
- 著者
- Natsumi Maehara, Kaori Taniguchi, Ami Okuno, Hideaki Ando, Aika Hirota, Zhiheng Li, Ching-Ting Wang, Satoko Arai* & Toru Miyazaki* (すべて東京大学)
- DOI番号
- 10.1016/j.celrep.2021.109693
用語解説
- (注1)AIM(Apoptosis Inhibitor of Macrophage)
- 当初マクロファージから分泌され、細胞のアポトーシス(細胞死)を抑制する分子として東京大学大学院医学系研究科の宮﨑徹教授が発見したもの。CD5Lとも呼ばれる。その後の研究で、作用する細胞の種類などの違いによりアポトーシス抑制以外にもさまざまな作用があることが明らかになった。
- (注2)DAMPs(damage associated molecular patterns)
- 損傷組織また壊死に向かっている細胞から放出される分子構造(微粒子)で、自然免疫、獲得免疫、また炎症反応の誘導に関与する。脳梗塞の増悪に関与する主なDAMPsとして、PRDX1(Peroxiredoxin-1)、HMGB1(high mobility group box 1)、S100A(S100-Calcium-Binding Protein A)などが知られている。
- (注3)マクロファージ
- 白血球の1種。生体内をアメーバ様運動する遊走性の食細胞で、死んだ細胞やその破片、体内に生じた変性物質や侵入した細菌などの異物を捕食して消化し、清掃屋の役割を果たす。ミクログリアは中枢神経系グリア細胞の一つで、胎生期卵黄嚢で発生する前駆細胞を起源とする、脳内常在性マクロファージである。
- (注4)IgM
- 免疫グロブリンM。IgGやIgAなどと共に血中に存在する抗体の一種であり、抗体産生過程の最も初期に現れる抗体である。血中濃度は100~150 mg/dL。
- (注5)TLR(toll-like receptor)、RAGE(Receptor for Advanced Glycation End Products)
- RAGEは終末糖化産物の受容体であり、マクロファージなどの細胞表に発現しており、TLRと同様にDAMPsと結合することによって、IL-1βやIL-6などの炎症性サイトカインの発現を誘導し炎症を惹起する。
お問い合わせ先
研究に関するお問い合わせ
東京大学大学院医学系研究科 附属疾患生命工学センター 分子病態医科学部門
教授 宮﨑 徹(みやざき とおる)
AMED事業に関するお問い合わせ
日本医療研究開発機構(AMED)シーズ開発・研究基盤事業部 革新的先端研究開発課