夜行性の桿体細胞の核内構造は細胞核の動的変形によって昼行性型の核内構造から導かれる
2019-08-29 広島大学,科学技術振興機構
ポイント
- 夜行性哺乳類の光受容細胞の大々的な核構造の再編成が起きる仕組みを解明。
- Phase-fieldの数理手法と実験の新規融合アプローチによって、細胞核の動的変形が核構造の再編成を引き起こすことを発見。
- 細胞の物理的性質や、細胞核内DNAの空間構造制御機構の解明に期待。
JST 戦略的創造研究推進事業において、広島大学 大学院統合生命科学研究科の李 聖林 准教授と落合 博 講師らは、夜行性の哺乳類の桿体細胞注1)が持つクロマチンの空間構造形成に細胞核の動的変形が重要に関わることを解明しました。
夜行性の哺乳類であるマウスの桿体細胞が持つクロマチンの空間構造形成は昼行性の哺乳類の桿体細胞が持つクロマチンの空間構造から再構築(リモデリング)されることが知られていましたが、その仕組みは大きな謎として残っていました。その謎を、新しい数理モデリングアプローチ手法を用いて理論で提案し、生体内外の実験でその仮説を証明することに成功しました。
本研究では、非常に複雑な仕組みに基づいていると考えられてきたクロマチン構造のリモデリング現象が、細胞の自然な物理的現象とも言える細胞の動的挙動に由来する細胞核のランダムな動的変形が関与していることを見いだしました。
本研究は、名古屋大学の小坂田 文隆 准教授と共同で行いました。
本研究成果は、2019年8月28日(米国東部夏時間)に科学誌「PLOS Computational Biology」のオンライン版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 個人型研究(さきがけ)
研究領域:「社会的課題の解決に向けた数学と諸分野の協働」(研究総括:國府 寛司 京都大学 大学院理学研究科 教授)
研究課題名:「動的変形空間による細胞機能決定機構の解明及びIn vitro実験への検証」
研究者:李 聖林(広島大学 大学院理学研究科 准教授)
研究実施場所:広島大学
研究期間:平成28年10月~令和2年3月
上記研究課題では、空間(ドメイン)の動的変形が遺伝子あるいは生体分子の空間パターン形成を制御することを明らかにし、細胞の物理・幾何学的性質により細胞機能が制御できる可能性を提示することを目指します。遺伝子あるいは生体分子の動態をそれらが置かれている環境(細胞核または細胞)との関連性に注目していく本研究は、遺伝子操作を使わずに細胞機能を制御可能にする新しい枠組みを数学的手法から提案し、In vitro実験で検証していきます。
<研究の背景と経緯>
細胞周期のうち細胞が分裂をしていない間期においてゲノムDNAは3次元的に折りたたまれ、細胞種特異的な核構造を形成し、転写を含む種々の核内イベントに深く関与していることが知られています。真核生物におけるほとんどの細胞種では、ヘテロクロマチン領域注2)が核膜周辺に局在しており、これを標準型核構造(conventional nuclear architecture)と呼びます。興味深いことに、マウスを含む夜行性哺乳類の光受容細胞の一種である桿体細胞では、ヘテロクロマチンが核中央に局在した逆転型核構造(inverted nuclear architecture)を示します。桿体前駆細胞は標準型核構造を示し、最終分化過程で大々的な核構造の再編成が引き起こされます。ヘテロクロマチンを核膜につなぎ止めているLBR(LaminB受容体)とLamin A/Cたんぱく質が分化過程で失われることが再編成に必須であることはすでに報告されていますが、いかにしてヘテロクロマチンの集合および核構造の再編成が引き起こされるかは不明でした。
<研究成果の内容>
本研究では、CRISPR-Cas9システム注3)を利用してlbr/lama二重欠損細胞株を樹立し、核構造の再編成過程を生細胞観察しました。その結果、再編成過程で細胞核が大きく変形し、それに伴ってヘテロクロマチンが移動し、融合する過程が捉えられました(図1)。さらに、Phase-field法注4)を用いた新たな数理モデリング手法で細胞核の動的変形が核構造再編成の原動力になっていることを捉えました(図2)。動的変形を減少させた数理実験とin vitro実験を用いて定量的に細胞核の動的変形が核構造の再編成に直接関わっていることを明らかにしました。また、ex vivo実験を用いて実際のマウスの桿体細胞の核でも動的な細胞核の変形が見られることを確認しました(図3)。
本研究は、細胞核内のDNA構造をマクロ的に捉える全く新しい数理的手法と実験の新規の融合アプローチによって、細胞核の動的変形が核構造の再編成を引き起こすことを世界で初めて発見しました。細胞核の変形は動的な細胞システムにおいては普遍的な現象であり、種々の分化過程における核構造の再編成において重要な役割を果たしていると考えられます。
<今後の展開>
今回の研究では細胞核の動的変形が核構造の再編成に重要な役割を果たすことを発見しましたが、細胞核が動的に変形するその仕組み自体はまだ解明されていません。今後、その仕組みを明らかにすることで、細胞の物理的性質や、細胞核内DNAの空間構造制御機構の解明が期待できます。また、本研究の融合手法は、生命科学における新たな数理的アプローチを提案しており、クロマチン研究分野および学際的研究分野における発想の転換をもたらすことが期待されます。
<参考図>
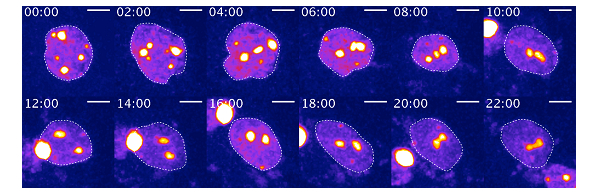
図1 核構造の再編成過程のライブイメージング
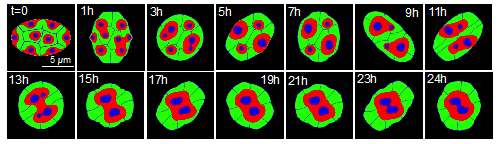
図2 Phase-filed法の数理モデルを用いた細胞核の動的変形による核構造の再編成過程のシミュレーション

図3 生後15日マウスの網膜細胞核の動的変形のライブイメージング
<用語解説>
- 注1)桿体細胞
- 桿体細胞(かんたいさいぼう)は、視細胞の一種である。眼球の網膜上に存在し、光の強弱に応じた明暗の認識に関わり、色覚にはほとんど関与しない。
- 注2)ヘテロクロマチン領域
- 細胞核内DNAのうち、特に凝集度の高い領域のこと。この領域に含まれる遺伝子は一般的に遺伝子発現活性が低い特徴がある。
- 注3)CRISPR-Cas9システム
- 特定のゲノムDNA領域を切断することができる分子生物学的ツール。特定のDNA領域を切断することで、当該領域のゲノムDNA情報を編集できる。本ツールを利用したDNA情報の編集技術は、ゲノム編集と呼ばれている。
- 注4)Phase-field法
- 主に材料科学の凝固現象を説明するために用いられた数理的手法で、2つの安定な状態を連続関数で表し、エネルギー関数を定義してその遷移を記述する。近年、生命科学におけるPhase-field法の応用が活発化している。
<論文タイトル>
- “Role of dynamic nuclear deformation on genomic architecture reorganization”
- DOI:10.1371/journal.pcbi.1007289
<お問い合わせ先>
<研究に関すること>
李 聖林(イ セイリン)
広島大学 大学院統合生命科学研究科 数理生命理学プログラム 准教授
落合 博(オチアイ ヒロシ)
広島大学 大学院統合生命科学研究科 生命医学プログラム 講師
<JST事業に関すること>
舘澤 博子(タテサワ ヒロコ)
科学技術振興機構 戦略研究推進部 ICTグループ
<報道担当>
広島大学 広報グループ
科学技術振興機構 広報課


